胰腺癌伴神经浸润动物模型的建立
2014-08-04张晓兰邢铃张志钢杨鸣吴红玉满晓华金晶李兆申金震东
张晓兰 邢铃 张志钢 杨鸣 吴红玉 满晓华 金晶 李兆申 金震东
神经浸润(perineural invasion ,PNI)是胰腺癌的典型表现,其发生率为50%~100%。PNI亦是肿瘤细胞侵犯周围神经及转移扩散的途径之一,疼痛的产生也与PNI密切相关。PNI的发生预示着胰腺癌的局部复发及胰腺癌患者较差的预后[1],但其发病机制目前仍未明确。由于缺乏有效的体内实验模型,既往针对PNI发病机制的研究多局限于体外实验。本研究建立有效的PNI体内模型,模拟肿瘤细胞浸润神经时的体内微环境,为PNI发病机制的研究提供一定的实验基础。
材料与方法
一、细胞培养
人胰腺癌细胞株CAPAN-2、PANC1及SW1990均购自美国ATCC(American Type Culture Collection),按照ATCC推荐的培养条件培养、传代,取对数生长期细胞,收集于1.5 ml EP管中备用。
二、实验动物及分组
4~5周龄BALB/c裸小鼠32只,体质量18~22 g,购自上海中科院斯莱克动物中心,于第二军医大学动物实验中心SPF级屏障系统饲养。饲养条件:室温26~28℃,相对湿度40%~60%,动物饲养箱置于层流架中,饮用水、饲料及垫料均经严格消毒,定期更换,专人管理。入室适应性喂养1周后开始实验。按完全随机法分为4组,其中3组分别接种CAPAN-2、PANC1、SW1990细胞,不做任何处理的裸鼠为对照组,每组8只。
三、造模方法
BALB/c裸小鼠称重后用1%戊巴比妥按照40 mg/kg体质量剂量腹腔注射麻醉。待麻醉完全后,消毒裸鼠右下肢,在其股骨头下约1~2 mm处沿股骨干走行方向切一3~4 mm的小切口,钝性沿肌肉走行轻轻剥离肌肉,找寻并暴露坐骨神经,在坐骨神经周围分别注射约106个胰腺癌细胞(图1),缝合切口。术后自由进食、水。动态观察成瘤情况、成瘤时间。待瘤块长至最长径约0.8 cm时,给予1%戊巴比妥钠麻醉裸鼠,沿股骨干剥离、切下肿瘤。给予冰PBS冲洗后将取下的肿瘤组织一分为二,一部分置-80℃冰箱冻存备用,另一部分置于4%多聚甲醛中固定48 h后常规行石蜡包埋、切片、HE染色,光镜下观察。
四、统计学处理

图1 暴露的坐骨神经(a)及注射胰腺癌细胞的裸鼠(b)
结 果
一、一般状况
对照组裸鼠体质量增加,各癌细胞注射组裸鼠成瘤后体质量明显下降(表1),活动度下降,甚至呈现恶液质,且成瘤侧肢体活动受限,跛行(图2)。
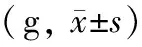
表1 各组裸鼠的体质量变化
注:与对照组比较,F=434.41,aP<0.01;与成瘤前比较,t值分别为7.719、6.481、5.640,bP<0.01
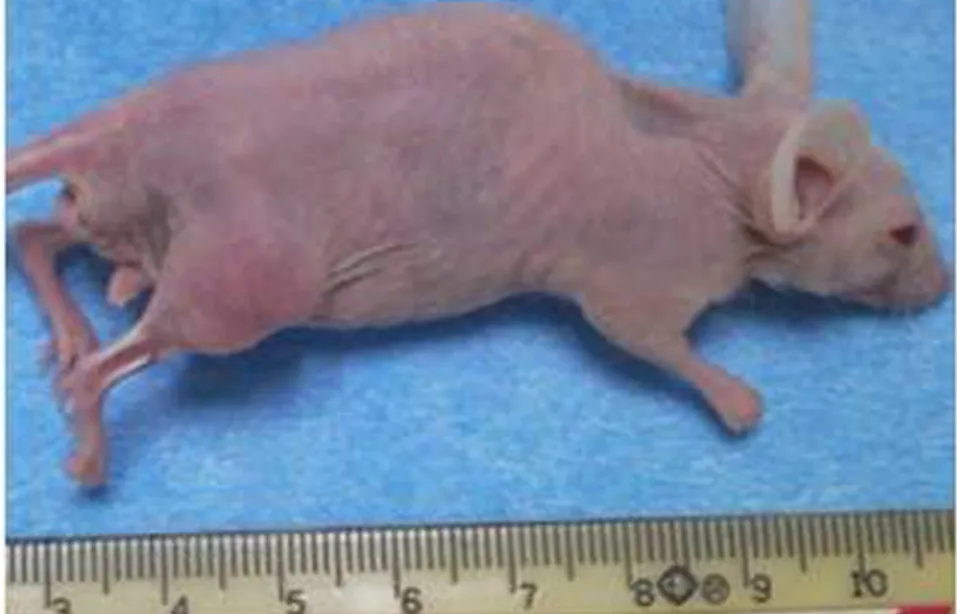
图2 成瘤侧肢体活动受限的裸鼠
二、成瘤情况及平均成瘤时间
CAPAN-2注射组及SW1990注射组的8只裸鼠最终均成瘤,PANC1注射组只有5只成瘤。
以肿瘤最长径长至约0.8 cm为时间截点,CAPAN-2注射组、PANC1注射组、SW1990注射组裸鼠的成瘤时间分别为(49.8±5.0)、(56.6±2.4)、(25.4±3.0)d。SW1990注射组3~4周成瘤,PANC1注射组8周左右成瘤,CAPAN-2注射组7~8周成瘤,3组成瘤时间的差异具有统计学意义(F=73.51,P<0.01)。
三、PNI造模成功率
待最终成瘤时,见肿瘤与表皮有部分粘连,但均可顺利分离。剥离表皮后暴露肿瘤,见大部分肿瘤呈类球状,部分呈不规则形状,包绕股骨干,侵及肌肉。部分肿瘤包绕坐骨神经(图3a),部分肿瘤位于坐骨神经旁。光镜下见癌细胞包绕神经生长,侵犯神经束膜(3b)。CAPAN-2注射组、PANC1注射组、SW1990注射组裸鼠造模成功率分别为87.5%(7/8)、20.0%(1/5)、50.0%(4/8)。
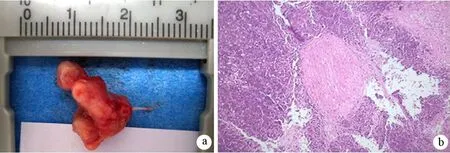
图3 肿瘤包绕神经生长(a),侵及神经束膜(b,HE ×100)
讨 论
Batsakis[2]广义的PNI定义为癌细胞侵及神经内、神经周围或穿过神经。有人认为PNI专指癌细胞能在神经束膜内观察到,但这一观点过于严格。大部分PNI是肿瘤与神经在神经束膜内接触,但在鞘膜内并未发现肿瘤细胞。因此,不同作者定义的肿瘤与神经接触的标准是不一样的。肿瘤生长方式的描述亦包括全部包绕、部分包绕、同心型板层结构及切面的接触等,因而PNI的定义也不一致。大部分作者建议,肿瘤细胞环绕神经周围至少33%以上才能称之为PNI。但起初描述癌细胞的PNI为癌细胞沿着肿瘤周围神经纤维的旁侧生长[3]。Leibig等[4]定义PNI为癌细胞在神经内、围绕或穿过神经,肿瘤密切接触神经并至少环绕神经外周的33%,或神经细胞侵及神经鞘3层结构的任何一层。本研究以Leibig的PNI定义作为判断标准。
目前国内外针对胰腺癌PNI的研究大多应用体外实验模型。本实验室既往曾应用BD Matrigel基质胶内小鼠背根神经节与人胰腺癌细胞株三维共培养的模式成功建立PNI的体外模型,可见神经突触与癌细胞间有相向生长的趋势[5]。但体外实验具有一定的局限性,不能完全模拟体内肿瘤细胞迁徙、转移的微环境。国外有少部分PNI体内模型建立的方法,如Gil等[6]采用微量注射器显微注射癌细胞于裸鼠坐骨神经建立PNI模型,用于观察癌细胞的浸润对神经功能的影响。但该方法需用微量注射器及显微注射技术,操作复杂且费用昂贵。因此,建立一种简单易行、复制率高的体内动物模型势在必行。
根据以往体外实验结果及相关文献报道,人胰腺癌细胞株CAPAN-2具有较高的神经侵犯特性,PANC1具有较低的神经侵犯特性。因此,本研究选择不同人胰腺癌细胞株进行裸鼠坐骨神经周围注射的方法建立PNI体内模型。结果显示, SW1990细胞扩增速度快,成瘤成功率高,时间短,但PNI发生率不高;CAPAN-2细胞扩增速度较慢,成瘤时间相对长,但PNI发生率最高;PANC1细胞扩增速度慢,成瘤时间最长,PNI发生率最低。本研究结果提示细胞株的选择对于胰腺癌PNI动物模型造模成功有重要的影响。
本研究建立的体内造模方法简单、易行,但存在一定的创伤性,且因存在切口,如缝合不好可出现注射的细胞外渗,从而导致成瘤率下降,甚至不成瘤。另外,分离坐骨神经时如将神经周围肌肉剥离暴露过多也可造成注入的癌细胞沿组织间隙扩散,不能很好地聚集在坐骨神经周围,从而导致成瘤率及PNI发生率的下降。
参 考 文 献
[1] Bapat AA, Hostetter G, Von Hoff DD, et al. Perineural invasion and associated pain in pancreatic cancer[J]. Nat Rev Cancer, 2011,11(10):695-707.
[2] Batsakis JG. Nerves and neurotropic carcinomas[J]. Ann Otol Rhinol Laryngol, 1984,94(4 Pt 1):426-427.
[3] Demir IE, Ceyhan GO, Liebl F, et al. Neural invasion in pancreatic cancer: the past, present and future[J]. Cancers(Basel), 2010,2(3):1513-1527.
[4] Liebig C, Ayala G, Wilks JA, et al. Perineural invasion in cancer: a review of the literature[J]. Cancer, 2009,115(15):3379-3391.
[5] 安薇, 李平, 李桂香, 等. 胰腺癌神经浸润体外模型的构建与观察[J]. 中华胰腺病杂志, 2012,12(3):160-163.
[6] Gil Z, Cavel O, Kelly K, et al. Paracrine regulation of pancreatic cancer cell invasion by peripheral nerves[J]. J Natl Cancer Inst, 2010,102(2):107-118.
