壶瓶枣提取物抗氧化性研究
2014-07-26李海平陈冬梅吴蓉蓉王迎进
李海平,陈冬梅,吴蓉蓉,王迎进
(忻州师范学院化学系,山西忻州034000)
壶瓶枣(Zizyphusjujuba cv.Huping)为鼠李科(Rhamnaceae)枣属植物果实。壶瓶枣个大、皮簿、肉厚,风味甘美,有“八个一尺,十个一斤”之美称,在国内外享有盛誉,主要产于山西太谷、榆次、交城、清徐等地。壶瓶枣是一种滋补佳品,中医认为有补中益气,养血安神,生津液,润心肺,补五脏,治虚损及解毒等功效,在产区有“每日三颗壶瓶枣,身体强健不服老”的说法。近年来,国内文献报道了对壶瓶枣的初步研究,多集中在壶瓶枣的防裂、栽培及储藏技术[1-2];另外,侯天宇研究了壶瓶枣中芦丁的超声波法提取工艺[3];王愈研究了壶瓶枣汁浸提和澄清工艺[4];而关于壶瓶枣提取抗氧化性的相关研究却鲜见报道。鉴于壶瓶枣药食两用的对重功效,本实验探讨了壶瓶枣提取物的抗氧化性,为进一步揭示壶瓶枣的生物活性提供参考。
1 材料与方法
1.1 材料与试剂
壶瓶枣:购于山西忻州农贸市场;芦丁标准品、菲洛嗪、DPPH:购于Sigma公司,其他试剂,均为分析纯。
1.2 方法
1.2.1 壶瓶枣的提取
将壶瓶枣去核,干燥,粉碎,过60目筛。取50 g置于圆底烧瓶中加入500 mL乙醚,回流提取2 h以脱脂,抽滤,然后再加入500 mL石油醚,回流提取2 h脱色,抽滤。滤渣通风干燥得壶瓶枣枣粉。
水提取物:称取脱脂脱色壶瓶枣粉5 g,料液比为1∶20(g/mL),在温度60℃、功率240 W条件下超声30 min,取上清液。同样方法重复提取一次,合并滤液得壶瓶枣水提取物。
醇提取物:以无水乙醇代替二次蒸馏水按上述方法得醇提取物。
1.2.2 提取物的定性实验
1.2.2.1 显色反应
取0.01 g/mL FeCl3溶液,向待测液中滴加该溶液,观察颜色变化。配制0.02 g/mL FeCl3溶液和0.01 g/mL铁氰化钾溶液,等体积混合,向待测液中滴加该溶液,观察颜色变化;加入HCl溶液,观察颜色变化。配制0.01 g/mL AlCl3溶液,向待测液中滴加该溶液,观察颜色变化[5]。
1.2.2.2 提取物黄酮类化合物含量的测定
准确称取芦丁标准品11.7 mg,用70%的乙醇定容至 50 mL 容量瓶中。分别取 0.0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL于8个10 mL比色管中,用70%乙醇补充至 5 mL,加入 0.3 mL 0.05 g/mL NaNO2,摇匀,放置6 min后加入0.3 mL 0.1g/mL Al(NO3)3,摇匀,6 min后加入4 mL 0.04 g/mL的NaOH,混匀,用70%乙醇定容,10 min后于510 nm波长处测定吸光度(A)值。得标准曲线方程:y=0.011 3x+0.004 5(R2=0.997 1)。
1.2.3 壶瓶枣提取物的抗氧化性
1.2.3.1 羟自由基清除率的测定参考文献[6]
量取2.0 mLPBS磷酸盐缓冲溶液(pH=7.4,下同)和4.0 mL蒸馏水于10 mL比色管中,定容作空白参比管;量取 2.0 mLPBS,1.0 mL 邻二氮菲(1.5 mmol/L,下同)、1.0 mLFeSO4(1.5 mmol/L,下同)和 2.0 mL蒸馏水于10 mL比色管中,混匀作未损伤管;量取2.0mL PBS,1.0 mL 邻二氮菲,1.0 mL FeSO4,1.0 mL 蒸馏水和1.0 mL H2O2(0.02%)于 10 mL 比色管中,作损伤管;量取2.0 mLPBS,1.0 mL样品液和3.0 mL蒸馏水于10 mL比色管中,作样品参比管;量取2.0 mLPBS,1.0 mL邻二氮菲,1.0 mLFeSO4,1.0 mL壶瓶枣试样液和1.0 mL H2O2于10 mL比色管中,定容作样品管。将上述试管置于恒温水浴锅中,37℃保温60 min,于波长536 nm处测吸光度(A)值,每种处理平行3次,用其平均值按下式计算羟自由基清除率(%)。以VC作对照。

1.2.3.2 超氧阴离子自由基清除率的测定参考文献[7]
采用邻苯三酚自氧化法,量取Tris-HCl缓冲溶液4.5 mL向其中加入1.0 mL邻苯三酚(7 mmol/L)并开始计时,定容到10 mL,于325 nm处测得反应体系的吸光值A0。按照上述方法,量取4.5 mLTris-HCl缓冲溶液和1 mL药液,在室温下放置4 min,立即加入1 mL邻苯三酚并开始计时,定容到10 mL,于325 nm处每隔30 s测定反应体系的吸光值Ai,共记录前4 min;实验平行3次,求其平均值。按下式计算超氧阴离子自由基清除率(%)。以VC作对照。
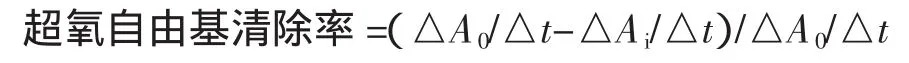
1.2.3.3 DPPH·清除率的测定参考文献[8]
量取2.0 mL药液及2.0 mL浓度为2×10-4mol/L的DPPH·溶液于10 mL比色管,30 min后以试样提取溶剂为空白调零于517 nm处测定其吸光度Ai;测定2.0 mL浓度为2×10-4mol/L的DPPH·溶液与2.0 mL 70%乙醇混合液的吸光度Ac;再测定2 mL壶瓶枣提取液与2.0 mL无水乙醇混合液的吸光度Aj;平行测定3次,求其平均值。根据下列公式计算壶瓶枣提取液对DPPH·的抑制率(%)。以VC作对照。
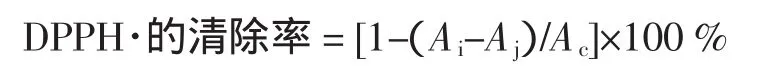
1.2.3.4 还原性测定参考文献[9]
移取壶瓶枣提取物,稀释成一定浓度的溶液,取1 mL不同浓度梯度的各样品,加入2.5 mL 0.01 g/mL K3Fe(CN)6,2.5 mL 0.2 mol/L,pH=6.6 的磷酸盐缓冲溶液,混合均匀,于50℃反应20 min。取出再加入2.5 mL 0.1 g/mL三氯乙酸。离心10 min,取上层溶液5.0 mL加入蒸馏水5.0 mL,0.1 g/100 mL FeCl31.0 mL,用分光光度计于700 nm波长处测定吸光度。
1.2.3.5 金属螯合能力的测定参考文献[10]
取不同浓度的样品溶液1.0 mL于试管中,分别加入0.05 mL 2 mmol/L的FeCl2溶液、0.2 mL 5 mmol/L的菲洛嗪溶液和2.75mL蒸馏水,混匀,10min后于562nm波长处测定吸光度。同时做样品空白实验(以水代替FeCl2溶液)。以水代替样液和FeCl2溶液,做参比实验调零。所有测定值均为3次平均值。混合体系中Ferrozine-Fe2+抑制率计算如下。
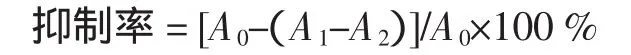
式中:A0为水代替样液时的吸光度值;A1为样品的吸光度值;A2为样品空白的吸光度值。
2 结果与分析
2.1 显色反应
壶瓶枣提取物的显色实验结果如表1所示。

表1 壶瓶枣提取物显色反应Table 1 Phenomena of color reaction for extracts from Zizyphus jujube cv.Huping
由表1可知,特定颜色反应表明壶瓶枣水提取物和乙醇提取物中均含有黄酮类化合物。
2.2 壶瓶枣提取物中黄酮类化合物含量测定
壶瓶枣水提物中黄酮类物质含量为2.86 mg/g,醇提物黄酮类物质含量为6.57 mg/g。
2.3 对羟自由基清除率的测定
羟自由基清除率是反映药物抗氧化作用的重要指标。壶瓶枣提取物和VC对羟自由基的清除效果见图1。
由图1可知,在较低浓度范围内,壶瓶枣提取物就具有较强的羟自由基清除能力,且随着质量浓度的增大,其羟自由基清除能力也随之增强。壶瓶枣提取物清除羟自由基能力为:壶瓶枣乙醇提取物IC50为60.03 μg/mL,水提取物 IC50为 61.04 μg/mL,稍高于 VC 70.31 μg/mL。
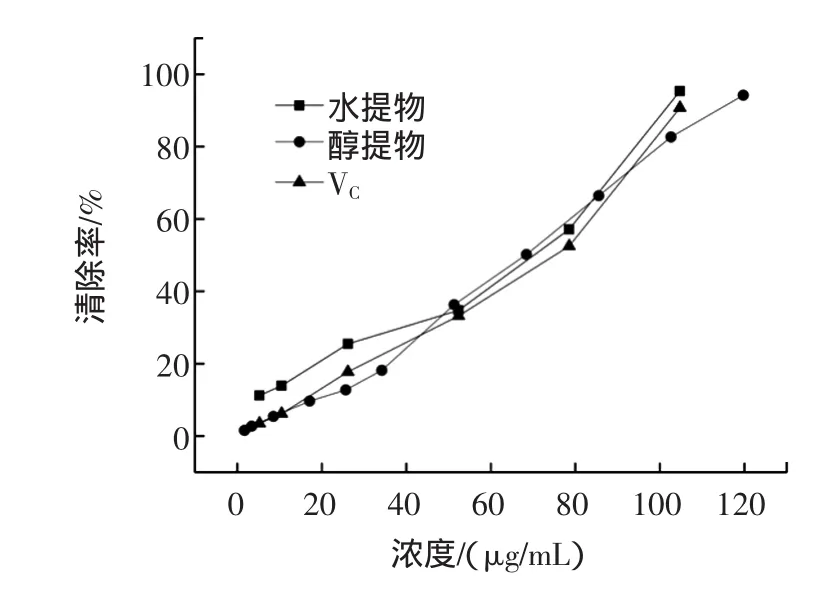
图1 壶瓶枣提取物对HO·的清除作用Fig.1 The HO·scavenging capacity of extracts from Zizyphus jujube cv.Huping
2.4 对超氧阴离子自由基清除率的测定
壶瓶枣提取物和VC对超氧阴离子自由基的清除效果见图2。
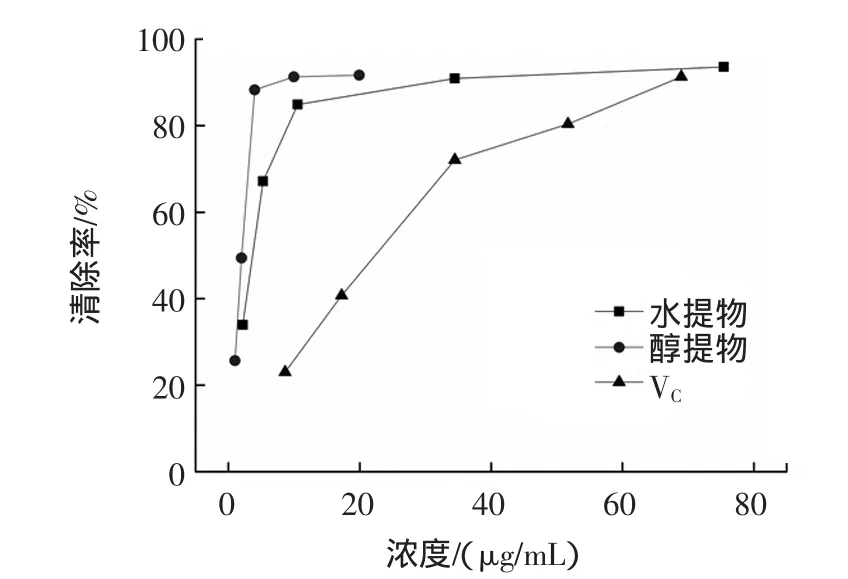
图2 壶瓶枣提取物对O2-·自由基的清除作用Fig.2 The O2-·scavenging capacity of extracts from Zizyphus jujube cv.Huping
由图2可知,壶瓶枣提取物清除超氧阴离子自由基能力高于VC(IC5022.03 μg/mL),且随着质量浓度的增大,对超氧阴离子自由基清除能力也随之增强。壶瓶枣水提取物IC50为1.80 μg/mL,乙醇提取物IC50为1.70 μg/mL。
2.5 对DPPH·自由基清除率的测定
壶瓶枣提取物和VC对DPPH·的清除效果见图3。
由图3可知,壶瓶枣提取物对DPPH·的清除能力与质量浓度呈正相关。壶瓶枣提取物对DPPH·自由基清除能力依次为:壶瓶枣乙醇提取物IC50为0.58μg/mL,壶瓶枣水提取物 IC50为 4.13 μg/mL,VC的IC50为 0.57 μg/mL。
2.6 还原性测定
物质的还原能力可以看作其潜在抗氧化性的重要体现。壶瓶枣提取物和VC的还原能力效果见图4。
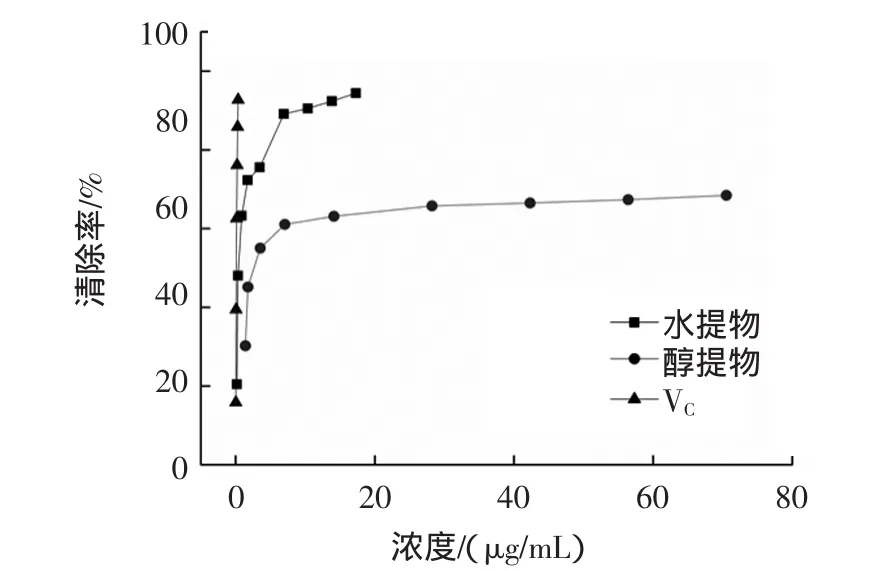
图3 壶瓶枣提取物对DPPH·的清除作用Fig.3 The DPPH·scavenging capacity of extracts from Zizyphus jujube cv.Huping
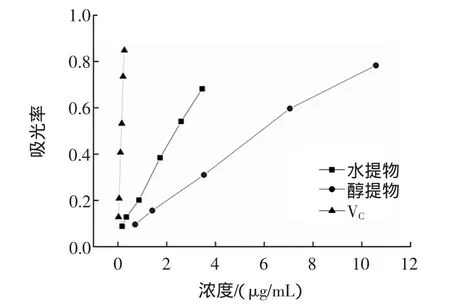
图4 壶瓶枣提取物还原性测定Fig.4 The reducing power of extracts from Zizyphus jujube cv.Huping
由图4可知,在较低浓度范围内,壶瓶枣提取物均表现出一定还原能力,且随着浓度的增大,其还原能力也逐渐增强。壶瓶枣提取物的还原能力为:VC>醇提取物>水提取物。
2.7 金属螯合能力测定
壶瓶枣提取物金属螯合能力效果如图5所示。
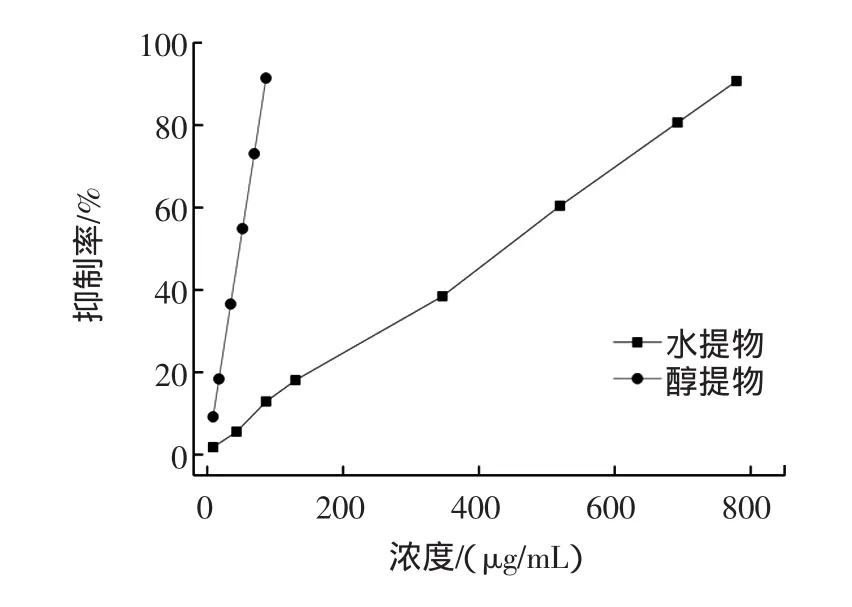
图5 壶瓶枣提取物金属螯合能力测定Fig.5 The ferrous iron chelating capacity of extracts from Zizyphus jujube cv.Huping
由图5可知,壶瓶枣水提取物和醇提取物均具有金属螯和能力,且金属螯合能力与质量浓度呈正相关。水提取物的IC50为426.02 μg/mL,而醇提取物的IC50为36.67 μg/mL,远远高于水提取物的金属螯合能力。
3 结论
实验证明:壶瓶枣提取物均具有清除DPPH自由基、羟自由基、超氧阴离子自由基的能力及金属螯合能力和还原能力。壶瓶枣水提取物的抗氧化能力为:超氧阴离子自由基(IC501.80 μg/mL)>DPPH·自由基(IC504.13 μg/mL)>羟自由基(IC5061.04 μg/mL)。而醇提取物的抗氧化能力为:DPPH·自由基(IC500.58 μg/mL)>超氧阴离子自由基(IC501.70 μg/mL)>羟自由基(IC5060.03 μg/mL)。醇提物的金属螯合能力和还原能力均高于水提物。
[1]吴萍,田世平,徐勇.气调贮藏对壶瓶枣果实细胞壁和角质层成分及品质的影响[J].中国农业科学,2009,42(2):619-625
[2]孟玉平,孙海峰,曹秋芬,等.壶瓶枣花芽分化与落性枝生长发育观察[J].果树学报,2009,26(4):487-491
[3]侯天宇,赖芳芳,孟凡欣.超声波提取壶瓶枣中芦丁的工艺研究[J].海南师范大学学报:自然科学版,2011,24(4):411-414
[4]王愈,张志勇.壶瓶枣汁浸提和澄清工艺参数的研究[J].食品科学,2005,26(增刊):61-63
[5]吕丽爽,谢天飞,樊玉洁.马兰提取物抗氧化性研究[J].食品科学,2010,31(13):122-125
[6]蔡仲军,陈仕江,伊定华,等.不同产地冬虫夏草清除羟基自由基作用的研究[J].中草药,2004,35(1):57-59
[7]Huang W,Xue A,Niu H.Optimised ultrasonic-assisted extraction of flavonoids from Folium eucommiae and evaluation of antioxidant activity in multi-test systems in vitro[J].Food chemistry,2009,114(3):1147-1154
[8]Amarowicz R,Naczk M,Shahidi F.Antioxidant activity of various fractions of non-tannin phenolics of canola hulls[J].Journal of agricultural and food chemistry,2000,48(7):2755-2759
[9]Mau J L,HuangP N,Huang S J,et al.Antioxidant properties of methanolic extracts from two kinds of Antrodia camphorata mycelia[J].Food chemistry,2004,86:25-31
[10]祝子坪,李娜.桑黄菌多糖体外抗氧化作用[J].食品科学,2011,32(19):92-95
