Geobacillus sp.GXS1α-淀粉酶基因的克隆表达及酶学性质研究
2014-07-26薛蓓裴建新刘振东罗章韦宇拓
薛蓓,裴建新,刘振东,罗章,韦宇拓
(1.西藏大学农牧学院,西藏林芝860000;2.广西南宁市疾病预防控制中心,广西南宁530023;3.广西大学微生物及植物遗传工程教育部重点实验室,广西南宁530003)
α-淀粉酶(1,4-α-D-葡萄糖苷水解酶,EC3.2.1.1)能够以淀粉为底物,从淀粉链内部水解其1,4-α-D-葡萄糖苷键。随着分子生物学的发展,目前已研究清楚了α-淀粉酶的蛋白质结构,并已经分别从假单胞菌(Pseudomonas stutzeri Mo-19)[1]、米曲霉(Aspergillus oryzae)[2]、枯草杆菌(Bacillus subtilis)[3]、黄单胞菌(Xanthomonas campestuis PV,campestris)[4]等微生物以及动物和植物中克隆到α-淀粉酶基因。人们正积极寻找产生α-淀粉酶的新菌株,并用分子生物学的方法克隆新基因,同时构建基因工程菌高效表达酶蛋白,廉价大规模生产α-淀粉酶。本工作克隆了一株从广西象州温泉中筛选分离得到的可水解淀粉的中度嗜热菌地芽孢杆菌Geobacillus sp.GXS1的α-淀粉酶基因,并在大肠杆菌JM109(DE3)中成功表达,用金属镍亲和层析将重组蛋白进行分离纯化,对酶的酶学性质做了初步研究。
1 材料和方法
1.1 材料
1.1.1 菌种和质粒
Geobacillus sp.GXS1 和 E.coli JM109(DE3)为本实验室保存,pSE380表达载体购自Invitrogen公司。
1.1.2 酶和试剂
PrimerSTARDNA聚合酶、TaqDNA聚合酶、dNTP、各种限制性内切酶λDNA/HindIII DNA Marker为大连TaKaRa宝生物工程公司产品;T4DNA连接酶、限制性内切酶DpnI购自MBI Fermentas公司;小量胶回收试剂盒及小量DNA纯化试剂盒Omega biotek公司产品;PCR引物合成和测序委托上海捷瑞生物公司完成;其他试剂为国产分析纯试剂。
1.1.3 培养基
LB 培养基:1%(质量分数)Tryptone,0.5%(质量分数)Yeast extract,1%(质量分数)NaCl。
1.2 方法
1.2.1 Geobacillus sp.GXS1菌株培养及总DNA的提取
将Geobacillus sp.GXS1接种到M9液体培养基中,65℃,200 r/min振荡培养16 h,然后取3 mL的培养液收集菌体,参考文献[5]提取总DNA。
1.2.2 质粒的提取、酶切、连接和转化
质粒的提取、酶切、连接和转化均按参考文献[5]进行。
1.2.3 Geobacillus sp.GXS1α-淀粉酶成熟肽基因的克隆
根据GeneBank已公布的与本研究的α-淀粉酶的相似度较高的α-淀粉酶序列和丹麦技术大学生物序列分析中心(CBS)的网站通过其SignalP 3.0 Server信号肽切割位点预测,设计含有信号肽的引物:
sense-Primer:5’-ATATCATGAAAATGGGGAACCGGCTCTTTATGCT-3’
antisense-Primer:5’-ATAAAGCTTCTAGTGGTGGTGGTGGTGGTGTTCCGGCATCCGCTTCGCCCGTT-3’
为了便于与载体连接及定向验证,在上下游分别设计了PagI和HindⅢ位点酶切位点(下划线表示);为了方便后期镍柱纯化目的蛋白,通过设计引物在表达的目的蛋白中加上组氨酸标签,PCR扩增条件为98℃10 s,68℃ 1 min 40 s,完成30个循环后72℃延伸10 min,将扩增出目的基因片断。
1.2.4 重组质粒的构建
扩增得到amy的基因片段用试剂盒纯化后,用PagI和HindⅢ内切酶进行消化,然后与NcoI和HindⅢ酶切过的pSE380载体片段连接,连接产物转化大肠杆菌感受态细胞,提取质粒酶切电泳正确的并进行测序验证,筛选得到重组质粒命名为pSE-amy。
1.2.5 α-淀粉酶基因的表达与纯化
将重组质粒pSE-amy转化大肠杆菌E.coli JM109(DE3),挑取重组子于37℃、220 r/min摇床培养至OD600为0.6,加入终浓度为1 mmol/L的IPTG于37℃、220 r/min诱导表达10 h,收集菌体超声破碎,粗酶液分别经Ni-NTA进行纯化。
1.2.6 α-淀粉酶酶活测定
淀粉酶活力的测定按照参考文献[6]中的Bernfeld法,一个酶活力单位(1 U)定义为:在65℃、pH7.0条件下,1 min生成1 μmol葡萄糖所需的酶量[6]。
1.2.7 蛋白含量测定
按照Bradford方法测定[7]。
2 结果与分析
2.1 Geobacillus sp.GXS1α-淀粉酶基因的克隆及重组质粒构建
以Geobacillus sp.GXS1菌株的基因组DNA为模板PCR扩增α-淀粉酶基因,所得PCR产物为1.5 kb左右,与预期大小相符如图1(A)。
以BamHI和HindIII对表达质粒pSE380-amy进行双酶切,由于amy基因处有BamHI位点,用BamHI、HindIII双酶切必将切下约1.3 kb左右的amy基因片段和4.3 kb片段,如图1(B)所示,表明amy基因与pSE380表达载体连接成功。
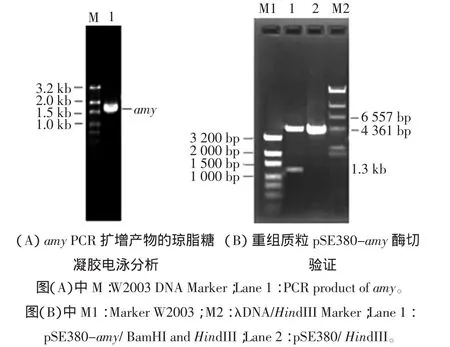
图1 amy PCR扩增产物的琼脂糖凝胶电泳分析及重组质粒pSE380-amy酶切验证Fig.1 Garose gel electrophoresis analysis of PCR and Agarose gel electrophoresis analysis of recombinant plasmids pSE380-amy digested with BamHI and HindIII
2.2 Geobacillus sp.GXS1的α-淀粉酶基因的同源性分析
将酶切验证正确后的重组质粒pSE-amy测序,测序结果提交GenBank,Geobacillus sp.GXS1的α-淀粉酶核苷酸序列GenBank登录号为FJ481119,利用NCBI数据库进行Blast分析,发现Geobacillus sp.GXS1的α-淀粉酶基因序列和已报道的alpha-amylase基因的DNA序列有很高的同源性,其中与G.sp.Y412MC52( 登 录 号 :ACNM01000012)、Geobacillus kaustophilus HTA426(登录号:BA000043)、Geobacillus sp.POT5(登录号:EF080863)、GeobacillusthermodenitrificansNG80-2(登录号:CP000557)的alpha-amylase基因氨基酸序列的相似性分别为95.5%、94%、89%和84%,而DNA序列上相似性分别为96.5%、96%、93%和90%。应用Mega4.0、ClustalW等软件对GXS1株菌的alpha-amylase基因的氨基酸进行同源性比对分析、系统发育分析,采用邻接法构建系统进化树,结果如图2。
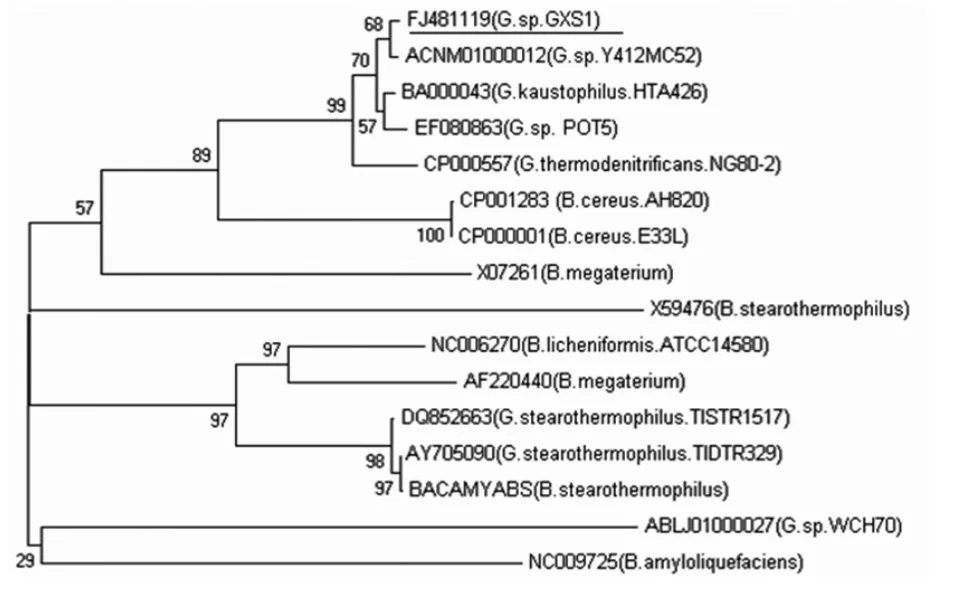
图2 GXS1菌株α-淀粉酶系统发育树分析Fig.2 Phylogenetic tree of alpha-amylase from strain GXS1
从图2可以看出,GXS1的α-淀粉酶与G.sp.Y412MC52(ACNM01000012)的 α-淀粉酶基因亲缘关系最密切。
2.3 α-淀粉酶基因的表达及纯化
将含有重组质粒pSE-amy的菌株pAMY培养,诱导表达及镍柱纯化后进行SDS-PAGE电泳,结果如图3。
从图3中可以看出,重组菌与对照菌相比在58 ku处出现特征蛋白带,与核酸序列理论推算的蛋白质分子量相符,表明amy基因已在大肠杆菌中成功地表达,并且酶的纯度已经可以进行下一步的酶学特性的研究。
2.4 重组α-淀粉酶基因的酶学性质
2.4.1 温度对α-淀粉酶活力的影响
在不同温度下(30℃~100℃)反应,按照标准方法[11]测定酶活,以酶活最高者为100%,结果见图4。
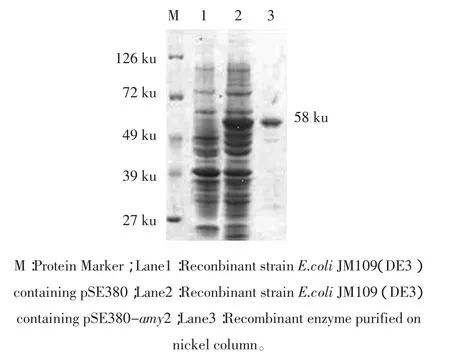
图3 纯化后的重组α-淀粉酶的SDS–PAGE分析Fig.3 SDS-PAGE protein of purified alpha-amylase and the gel stained for alpha-amylase activity
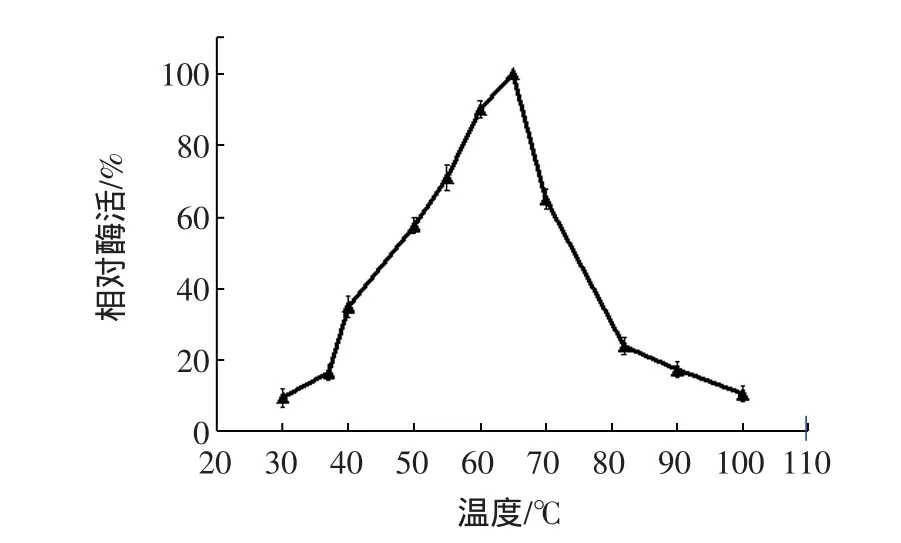
图4 温度对Geobacillus.sp.GXS1α-淀粉酶活力的影响Fig.4 Effect of temperature on the activity of GXS1 alphaamylase
从图4可以看出,在30℃~65℃之间,酶活随着温度的升高而增强,而在65℃~100℃之间,酶活随着温度的升高而降低,结果显示重组α-淀粉酶的最适反应温度为65℃。
2.4.2 pH对α-淀粉酶活力及稳定性的影响
在最适温度下,不同pH条件下下反应,按标准方法[11]测酶活力,以酶活最高者为100%结果见图5。
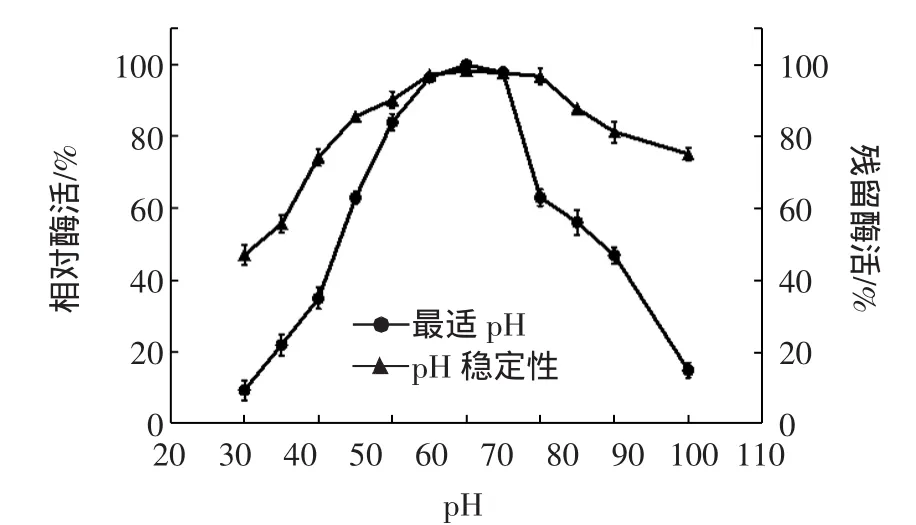
图5 pH对酶活力及其稳定性的影响Fig.5 Effect of pH on the activity and stability of GXS1 alphaamylase
将酶放置在不同pH条件下,30℃保温2 h后,以未处理的原酶液活力为100%,测定残余酶活力,作pH稳定性曲线。图5所示重组的α-淀粉酶的最适反应pH为7.0,该酶在pH5.0-10.0之间活性相对稳定,在pH10.0下保温2 h后残余酶活力为74%。
2.4.3 米氏常数(Km)及最大反应速度(Vmax)测定
以可溶性淀粉为底物,在不同底物浓度下测定酶活,用Linewear-Burk作图法求出该酶对底物的Km值,见图6。结果表明大肠杆菌重组子表达的α-淀粉酶的酶动力学常数Km值为2.79 mg/mL,Vmax为32.5 μmol/mL·min。
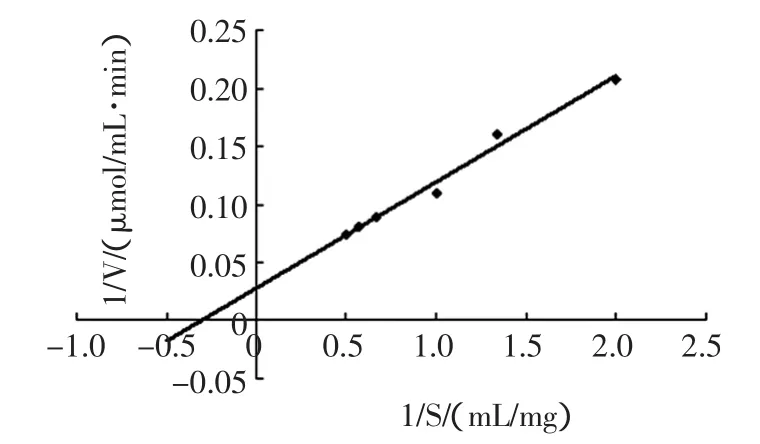
图6 Lineweaver-Burk双倒数作图法测定α-淀粉酶对可溶性淀粉的Km值Fig.6 Lineweaver-Burk plot used for determination of the Km values for alpha-amylase on soluble-starch substrate
2.4.4 EDTA对酶活性的影响
实验以1 mmol/L~10 mmol/L不同浓度的EDTA加入到酶与底物的反应体系中,结果如图7所示。
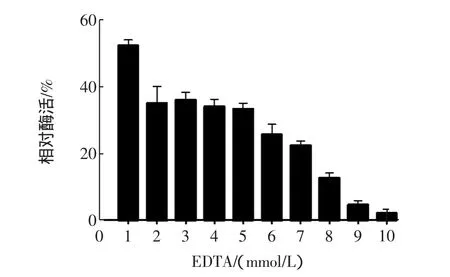
图7 EDTA对α-淀粉酶酶活的影响Fig.7 Effect of EDTA on the enzyme activity of alpha-amylase
EDTA对α-淀粉酶活性的抑制作用随着浓度的增加而加强。
2.4.5 其他化学试剂对酶活的影响
在反应体系中加入不同浓度金属离子,使其终浓度2.0 mmol/L,50℃保温0.5 h后,放置冰上迅速冷却至室温,按标准方法,测残余酶相对活力,以不含金属离子的酶液为对照(表1)。从表1结果可以看出,金属离子 Cu2+、Fe3+、Fe2+、Zn2+、Co2+、Hg2+、Ag+对酶活有显著抑制作用,其中Cu2+的抑制作用最大,Mn2+、Ba2+对酶活有微弱的抑制作用,K+、Ca2+、Mg2+、巯基乙醇对酶活有微弱的激活作用,而其他一些离子如Na+、Li+则对酶活影响不大。

表1 化学试剂对α-淀粉酶活力的影响Table 1 Effects of chemical reagents on α-amylase activity
2.4.6 重组α-淀粉酶水解特性的研究
在1 mL含有10 g/L底物(可溶性淀粉)的磷酸缓钠冲液(pH7.0)中加入纯化酶,65 ℃分别水浴 1、3、6、12、24 h后,以10 g/L的麦芽糖及葡萄糖标准样作为对照,用HPLC检测其反应产物。通过高效液相我们可清楚的发现反应6 h,此α-淀粉酶能把1%的可溶性淀粉转化为5.3 g/L的麦芽糖,随着反应时间的延长,葡萄糖的比例在增加,而麦芽糖与麦芽三糖的比例在下降。本研究重组α-淀粉酶不同时间水解淀粉产物中各组分所占比例如表2。
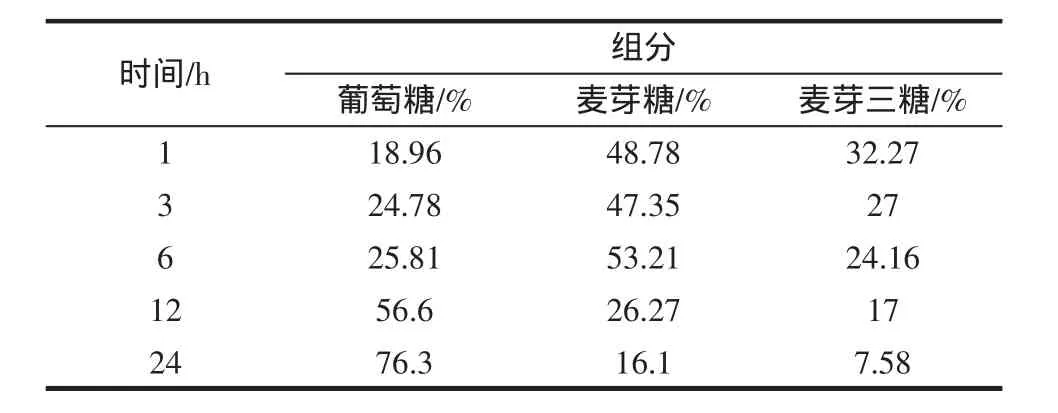
表2 不同时间α-淀粉酶水解可溶性淀粉产物的浓度比Table 2 The concentration of reaction products by alpha-amylase hydrolysis soluble starch at different times
3 讨论
本文克隆了Geobacillus sp.GXS1的α-淀粉酶基因,并在大肠杆菌中成功表达,为今后对α-淀粉酶基因进行改造以期获得高活力的突变酶以及进一步工业化生产α-淀粉酶提供参考。但仍然存在问题:重组α-淀粉酶表达需在低温诱导(20℃),才能有效防止包涵体的生成,不利于工业化生产;含有信号肽的Geobacillus sp.GXS1α-淀粉酶基因在大肠杆菌中表达的分泌效率低;重组的α-淀粉酶基因作用于淀粉转化麦芽糖的效率不是很高。
本课题组下一步将利用蛋白质数据库同源建模以及计算机软件辅助设计,对Geobacullus sp.GXS1的α-淀粉酶基因进行半理性设计改造来提高酶学性质。
[1]Fujita M,Torigoe K,Nakada T,et al.Cloning and Nucleotide Sequence of the Gene(Amyp)for Maltotetraose-Forming Amylase from Pseudomonas Stutzeri Mo-19[J].J Bacteriol,1989,171(3):1333-1339
[2]Tada S,Imura Y,Gomi K,et al.Cloning and Nucleotide Sequence of the Genomic Taka-Amylase a Gene of Aspergillus Oryzae[J].Agricultural and Biological Chemistry,1989,53:593-599
[3]Kuriki T,Okada S,Imanaka T.New Type of Pullulanase from Bacillus Stearothermophilus and Molecular Cloning and Expression of the Gene in Bacillus Subtilis[J].J Bacterilo,1988,170(4):1554-1559
[4]Hu N T,Hung M N,Huang A M.Molecular Cloning,Characterizatiom and Nucleotide Sequence of the Gene for Secreted Alpha-amylase from Xanthomonas Campestris Pv.Campestris[J].General Microbiology,1992,138(8):1647-1655
[5]Sambrcok J.Molecular Cloning-A Laboratory Manual[M].third edition.New York:Cold Spring Harbor Laboratory Press,2001:156-164
[6]Bernfeld P.Amylases,α and β.In:Colovick SP,Kaplan NO eds.Methods inEnzymology[M].New York,USA:Academic Press,1955:149-158
[7]汪家政.蛋白质技术手册[M].北京:科学出版社,2000:42-46
