掺锶仿生涂层用于促进种植体早期骨结合的初步研究
2014-05-18李永锋沈舒宁张永强申明明李永明
高 麒,牛 强,李永锋,沈舒宁,张永强,申明明,孔 亮,李永明
(1.第四军医大学口腔医院正畸科军事口腔医学国家重点实验室,陕西 西安 710032;2.河北医科大学第二医院口腔颌面外科,河北 石家庄 050000 3.第四军医大学口腔医院颌面外科军事口腔医学国家重点实验室,陕西 西安 710032)
口腔种植是牙列缺损或缺失的重要修复方法之一,由于其良好的功能恢复及美学效果,越来越受到口腔医生及患者的欢迎。随着种植体在临床的使用越来越广泛,对种植的成功率及稳定性也提出了更高的要求[1]。影响种植体成功率的因素很多,如种植体设计、表面微观形貌以及患者骨骼的条件等,其中种植体表面微观形貌是影响种植体稳定性的重要因素之一[2]。越来越多的研究表明,粗糙的种植体表面能有效促进骨结合,提高骨种植体接触面积和拔出力矩值[3]。在种植体表面构建微纳米级涂层具有骨组织仿生的效果,之前学者的报道以及我们前期的研究也证明,微纳米级涂层可显著促进种植体周围新生骨形成,并具有更高的骨结合率[4-6]。同时还有研究发现,锶盐具有促进成骨和抑制破骨的双重作用,可能会在种植体早期骨结合方面产生积极影响[7]。本研究借助磁控溅射技术在种植体表面构建掺锶的仿生化涂层,并通过动物实验观察其对种植体早期骨结合的影响。
1 材料和方法
1.1 涂层构建及其表面形貌观察和元素分析
1.1.1 种植体表面掺锶涂层的构建
取纯钛种植体(直径1.5 mm,长度4 mm,螺帽上带横向小孔,西安中邦生物钛有限公司)40枚,分别经12.5 g/L HF酸蚀15 min后,取20枚作为基体;然后以钛酸锶(直径75 mm,北京汇方圆科技有限公司)为靶材对基体进行磁控溅射处理(西安交大材料与强度实验室,SKY Technology Development Co.Ltd,沈阳)使之在其表面形成掺锶涂层。
1.1.2 涂层表面形貌观察及其元素分析
取构建有表面涂层的种植体和机械处理的纯钛种植体,分别用扫描电镜(SEM,JSM-6460,日本)观察其表面形貌;能量色散型X射线谱(energy dispersive X-ray spectroscopy,EDS)系统检测表面锶及其他元素的含量。经以上检测确定涂层构建成功后,以其作为实验组,另取20枚机械处理的纯钛种植体作为对照组。然后将2组材料分别用丙酮、无水乙醇、去离子水各超声荡洗10 min,干燥后塑封包装,钴60照射消毒后备用。
1.2 动物体内植入实验
1.2.1 种植体植入
取6月龄雌性SD大鼠(第四军医大学实验动物中心提供)20只[体质量(320±30)g],10 g/L戊巴比妥钠(4 mL/kg)腹腔注射麻醉下,分别在每只大鼠双侧股骨的近膝关节外侧延长轴方向切开皮肤、皮下组织(长约2 cm);找到股骨干骺端后沿长轴切开骨膜(约1.5 cm),钝性分离暴露干骺端表面,并用手动钻垂直于股骨长轴制备长4 mm、直径1.2 mm的圆柱形植入窝。然后按随机原则分别在每只大鼠的一侧股骨各植入一枚掺锶涂层(实验组)种植体;另一侧植入机械处理(对照组)的种植体(每组各20枚)。分层严密缝合手术创口,并在创口表面涂抹红霉素软膏。术后前3 d肌肉注射青霉素(60万单位/d),并严密观察伤口情况。
1.2.2 取材和标本制备
各组动物分别在处死前10 d腹腔注射四环素(25 mg/kg,连续3 d);处死前3 d注射钙黄绿素(5 mg/kg,连续3 d)。术后4周处死所有动物,取双侧股骨制成包含种植体的15 mm长骨段标本后,分别置800 mL/L乙醇液中4℃避光固定2~3 d。
1.2.3 组织学观察和双荧光染色分析
分别从实验组和对照组标本中各随机抽取10个标本,逐级脱水后树脂包埋,并分别在硬组织切片机(Leica sp1600,德国)上切成100 μm厚的切片。取各组切片,分别进行丽春红染色及荧光染色后,在倒置相差显微镜及荧光显微镜(Olympus-BX51,日本)下观察种植体—骨界面的结构特征并采集图像。然后用Image-Pro Plus图像分析软件测量各组种植体的骨接触率(bone implant contact,BIC)以及骨矿化沉积率(mineral apposition ratio,MAR)。
1.2.4 种植体轴向拔出力检测
取各组所余的10个股骨标本,暴露股骨干骺端的螺帽部分,并在螺帽的小孔内穿入结扎丝。然后将各标本固定于万能材料试验机(AGS-10KNG,Shimadzu,日本)上,并以2 mm/min的速度牵拉种植体。当种植体从骨内拉出时,计算出各种植体的最大拔出力值。
1.3 统计学分析
使用SPSS 13.0统计软件进行统计分析,组间比较用t检验,检验水准α=0.05。
2 结果
2.1 掺锶微纳米化仿生涂层表面形貌观察
SEM观察显示,对照组种植体的表面相对于实验组较为平缓,并可见同方向的机械加工刻痕(图1a、c);氢氟酸酸蚀后再经磁控溅射喷涂的实验组种植体表面可见酸蚀形成的微米级蚀坑,并在此基础上,继续生长出均匀连续且圆钝的纳米棒状结构,两者共同构成微纳米级的种植体表面(图1b、d),其粗糙度明显提高。

图1 扫描电镜下的种植体表面形貌
2.2 涂层表面元素分析
EDS系统显示实验组种植体表面氟离子含量约2.8%,锶的含量约1.2%,证实已成功建立掺锶的微纳米化种植体涂层。
2.3 体内植入后观察结果
2.3.1 大体观察
种植体植入后,所有动物均无异常反应,创口愈合良好,未发生感染、破溃和异常分泌物。取材时可见种植体完整包埋于骨组织内部,未发生松动及骨吸收现象。
2.3.2 组织学观察
体内植入4周后,丽春红染色观察显示,2组种植体均与骨组织紧密结合,未发现炎症反应(图2)。其中对照组种植体与骨组织之间多为点接触(图2a),实验组种植体涂层表面新生骨小梁较为宽大且与种植体表面连接紧密,同时可见多个骨陷窝(图2b)。图像分析显示,实验组的BIC显著高于对照组(P<0.05)(表1)。
2.3.3 双荧光染色观察
免疫荧光显微镜下钙黄绿素呈绿色荧光条带(多为双标记),代表种植术后(14~16 d)骨的代谢和增生较为旺盛;四环素标记的区域为土黄色的条带,代表后期(25~27 d)骨改建和骨成熟阶段。本实验观察显示,对照组的土黄色条带较分散且不明显(图3a),而实验组则可见明显的大面积的绿色荧光条带和土黄色条带(图3b)。图像分析显示,实验组的MAR显著高于对照组(P<0.05)(表1)。
2.3.4 种植体轴向拔出观察
种植体植入骨内4周时,实验组的最大拔出力为89.0 ±19.3,明显高于对照组(P <0.05)(表1)。

表1 不同处理组种植体植入4周后BIC、MAR及最大拔出力的比较 (n=20)
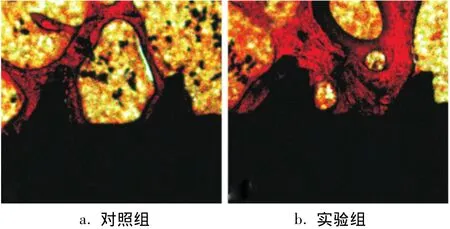
图2 干骺端种植术后4周硬组织丽春红染色(×100)

图3 骨结合的荧光显微观察(×100)
3 讨论
影响种植体稳定性的因素很多,如种植体设计、种植体表面微观形貌、患者的骨骼条件及植入部位等,其中种植体表面的微观形貌被认为是影响早期骨结合的关键因素之一[8]。通过适当的表面处理,不仅可增加种植体表面的粗糙度使之与周围骨组织的接触面积增大、固位增强;同时还能提高种植体的生物相容性和生物活性,从而促进骨结合[9]。由于骨组织是由纳米级单元的胶原纤维、矿物盐离子先组装为微米级单元的骨板、哈佛斯(Haversian)系统,然后再进一步组装为宏观的松质骨、皮质骨等结构[10];因此,从仿生角度而言,将种植体表面处理为微纳米化梯度有序的结构,则可使其具备仿生的效果,从而更有利于种植体的骨结合。本课题组在前期的研究也初步证实了微纳米化涂层可显著促进种植体周围的新骨形成[4-5]。
目前在种植体表面构建微纳米化涂层的技术多种多样,磁控溅射技术就是其中一种。该技术的原理是通过对靶材进行激发,使之呈原子状态;然后再以高能溅射的方式将其粒子喷涂于基底材料表面,因此能在基底材料表面形成纳米级形貌[11]。本实验扫描电镜观察显示,机械加工的种植体经酸蚀后表面出现了微米级的蚀坑,而经磁控溅射技术将钛酸锶掺入种植体表面后,则在其表面均匀出现了致密分布的纳米棒样结构。提示,通过磁控溅射技术构建涂层后,可使基体原有的微观形貌发生改变,并最终形成兼具微米级蚀坑及纳米级突起的微纳米级仿生化结构。
磁控溅射的另一特点是通过对溅射靶材的优选,可在基底表面载入新的元素,从而改变其表面的化学成分,使种植体表面掺入生物活性成分成为可能[12]。有研究证明,锶盐具有既能抑制破骨细胞增殖、分化和骨吸收,同时又能增加成骨细胞的活性并促进骨生成的双重作用[13-14],因此被广泛应用于骨缺损代替修复以及各种骨代谢疾病的治疗。国内有学者制备出不同掺锶量(0.5% ~90%)的骨组织工程支架材料,通过MTT法及SEM观察其与成骨细胞及血管内皮细胞的相容性,结果显示掺锶量为1%的支架材料其表面生长的成骨细胞及内皮细胞生长状态更好,具有更高的生物活性[15]。本实验通过将钛酸锶作为溅射靶材,在种植体表面构建掺锶涂层,EDS分析显示,实验组种植体表面有锶元素的加入,含量约1.2%,具有较好的生物相容性和生物活性。有研究认为,通过将锶盐作为靶材溅射到种植体的表面,可使其直接作用于周围的骨组织,从而避免了全身用药可能产生的毒副作用[16]。
本实验通过丽春红染色观察显示,实验组的涂层表面与种植体结合紧密,并可见多个骨陷窝,提示其成骨活跃。双荧光染色结果显示,实验组有大面积的绿色荧光条带和土黄色条带,提示其表面有新生骨组织的生长和沉积,并形成了较为完整的骨界面;而对照组中土黄色条带分散且不明显,提示其新骨形成较少,其骨接触率(BIC)及骨矿化沉积率(MAR)均显著低于实验组。种植体轴向拔出力检测显示,实验组的最大拔出力明显高于对照组,显示出了更好的固位能力及生物力学性能。究其原因,一方面可能是粗化的微纳米表面有着很好的生物相容性及促进骨结合的能力[4-5];另一方面是锶元素的掺入加速了骨结合的速度,两者的协同作用更有利于促进种植体的早期骨结合。
总之,本实验通过磁控溅射技术在种植体表面成功构建了掺锶的微纳米级仿生化涂层,并通过动物实验验证了其对种植体早期骨结合具有较好的促进作用。但还需在以后的实验中进一步研究该涂层在不同骨质条件下的骨结合效果,为其在临床上的应用提供实验室依据。
[1]Pjetursson BE,Bragger U,Lang NP,et al.Comparison of survival and complication rates of tooth-supported fixed dental prostheses(FDPs)and implant-supported FDPs and single crowns(SCs)[J].Clin Oral Implants Res,2007,18(Suppl 3):97-113.
[2]Wennerberg A,Albrektsson T.Effects of titanium surface topography on bone integration:a systematic review[J].Clin Oral Implants Res,2009,20(Suppl):4172 -4184.
[3]Le Guehennec L,Soueidan A,Layrolle P,et al.Surface treatments of titanium dental implants for rapid osseointegration[J].Dent Mater,2007,23(7):844 -854.
[4]Li Y,Gao Y,Shao B,et al.Effects of hydrofluoric acid and anodised micro and micro/nano surface implants on early osseointegration in rats[J].Br J Oral Maxillofac Surg,2012,50(8):779-783.
[5]Gao Y,Li Y,Xiao J,et al.Effects of microrough and hierarchical hybrid micro/nanorough surface implants on osseointegration in ovariectomized rats:A longitudinal in vivo microcomputed tomography evaluation[J].J Biomed Mater Res A,2012,100(8):2159-2167.
[6]Zhao L,Mei S,Chu PK,et al.The influence of hierarchical hybrid micro/nano-textured titanium surface with titania nanotubes on osteoblast functions [J].Biomaterials,2010,31(19):5072-5082.
[7]Bonnelye E,Chabadel A,Saltel F,et al.Dual effect of strontium ranelate:stimulation of osteoblast differentiation and inhibition of osteoclast formation and resorption in vitro [J].Bone,2008,42(1):129-138.
[8]Dohan Ehrenfest DM,Coelho PG,Kang B,et al.Classification of osseointegrated implant surfaces:materials,chemistry and topography[J].Trends in Biotechnology,2010,28(4):198 -206.
[9]Albrektsson T,Wennerberg A.Oral implant surfaces:Part 1-review focusing on topographic and chemical properties of different surfaces and in vivo responses to them [J].Int J Prosthodont,2004,17(5):536-543.
[10]Rho JY,Kuhn-Spearing L,Zioupos P.Mechanical properties and the hierarchical structure of bone [J].Med Eng Phys,1998,20(2):92-102.
[11]Takeda S,Suzuki S,Odaka H,et al.Photocatalytic TiO2thin film deposited onto glass by DC magnetron sputtering[J].Thin Solid Films,2001,392(2):338-344.
[12]Chen W,Liu Y,Courtney HS,et al.In vitro anti-bacterial and biological properties of magnetron co-sputtered silver-containing hydroxyapatite coating [J].Biomaterials,2006,27(32):5512-5517.
[13]Maimoun L,Brennan TC,Badoud I,et al.Strontium ranelate improves implant osseointegration[J].Bone,2010,46(5):1436-1441.
[14]李蕾,雷云坤,孟增东.锶的成骨效应及其在骨科中应用的研究进展[J].中国修复重建外科杂志,2012,26(11):1398-1402.
[15]余喜讯,陈元维,史国齐,等.掺锶聚磷酸钙骨组织工程支架材料与成骨细胞及内皮细胞的相容性研究[J].中国组织工程研究与临床康复,2007,5:857-860.
[16]Lee HY,Lie D,Lim KS,et al.Strontium ranelate-induced toxic epidermal necrolysis in a patient with post-menopausal osteoporosis[J].Osteoporos Int,2009,20(1):161-162.
