强酸性电解质水对根尖外多菌种生物膜作用的体外研究
2014-05-18于丁一赵春苗程小刚
于丁一,赵春苗,杨 扬,程小刚,仇 珺,王 聪,田 宇,余 擎
(陕西:1.第四军医大学口腔医院牙体牙髓病科军事口腔医学国家重点实验室,西安 710032;2.市口腔医院牙体牙髓病科,宝鸡 721001)
在根管治疗的过程中,常见到少数病例虽然接受了彻底地根管治疗,但仍出现反复发作的根尖周炎症。有研究认为,引起根尖周组织反复感染的原因主要与根尖外生物膜有关[1]。感染根管内的细菌不是单一菌种,而是由多菌种组成的混合感染;各菌种间通过相互共生,不仅能在根管壁上形成细菌生物膜,同时还可穿过根尖孔并在根管外根尖牙骨质上形成生物膜[2],从而导致尖周炎症的反复发作。
在去除根管内细菌生物膜方面,已有各种具有杀菌作用的根管冲洗液如:次氯酸钠(NaClO)、强酸性电解质水(SAEW)等用于临床。其中应用最多的是NaClO冲洗剂,该溶液不仅具有杀菌和溶解有机物质的能力,还可破坏细菌生物膜的结构[3]。SAEW是一种在日常生活中广泛使用的杀菌剂之一,因其对细菌如大肠杆菌、肠球菌属和病毒HIV等均具有良好的抑制或杀灭作用[4],近年来也逐渐用于根管冲洗。
在去除根尖外细菌生物膜方面,目前最常用的方法是根尖外科手术;而使用具有杀菌作用的冲洗剂去除根尖外生物膜的方法尚未见报道。因此,本实验通过建立根尖外多菌种生物膜体外模型,观察比较不同根管冲洗剂对其的杀灭作用,以期为更好的去除根尖外生物膜提供参考。
1 材料和方法
1.1 主要材料和仪器
粪肠球菌(ATCC 29212,美国);血液链球菌(ATCC 10556,美国);衣氏放线菌 (ATCC 12103,美国);牛心脑浸液培养基(BHI,青岛海博生物技术有限公司);强酸性电解质水(Alfa Light;Amano Co.,Yokohama,日本);次氯酸钠液(天津天力化学试剂有限公司);厌氧培养箱(Hypoxystation H85,Don Whitley Scientific Limited,英国);慢速切锯(BUEHLER,美国);麦氏比浊仪(PhoenixSpec Nephelometer,Becton Dickinson & Company,美国);酶标仪(Power Wave 340,BIO TEK,美国);扫描电镜(S 一 4800,Hitachi,日本);Live/dead 荧光活死菌染色剂(LIVE/DEAD@BacLight Bacterial Viability Kit.L -13152,Molecular Probes;Invitrogen Inc.;Carls bad,CA);激光共聚焦显微镜(CLSM,Fluo-View 1 000,OLYMPUS,日本)。
1.2 细菌培养和菌悬液制备
分别将粪肠球菌和血链球菌接种于BHI琼脂平板,衣氏放线菌接种于血琼脂平板,并划线分离出单个菌落;然后将3种细菌放入37℃厌氧箱(920 mL/L N2、80 mL/L CO2)中进行培养,分别于培养12 h(粪肠球菌和血液链球菌)、24 h(衣氏放线菌)时,挑取各菌种单菌落转种于BHI液体培养基,厌氧条件下继续培养。粪肠球菌和血液链球菌培养12 h后,衣氏放线菌培养48 h后,取各菌菌液用BHI液体培养基进行稀释;并在麦氏比浊仪上调整麦氏值为0.5(细菌浓度约为1×108cfu/mL)。
1.3 3种细菌相互作用实验
取上述稀释好的衣氏放线菌菌悬液5 μL分别接种于1/2 BHI琼脂平板和BHI琼脂平板,37℃厌氧条件下进行培养。培养48 h后,紧挨放线菌菌落分别滴加血链球菌和粪肠球菌菌悬液各5 μL,再次厌氧培养12 h后,分别观察两种培养基中的菌落生长情况[5]。
1.4 3种细菌生物膜成膜观察
取96孔板分别于每孔加入200 μL BHI培养液后,再于每孔中各滴入5 μL衣氏放线菌悬菌液,置于37℃厌氧培养箱中进行培养。培养48 h后先取3个孔用结晶紫染色法观察单菌种生物膜成膜情况;其余各孔再分别滴入血链球菌和粪肠球菌菌悬液各5 μL,厌氧条件下共同培养。分别于培养后24、48、54、56、58、70、76、82、106 h 每时间点各取3孔终止培养,用三蒸水冲洗3次后每孔加入250 μL的乙醇溶液(960 mL/L)固定30 min;固定结束后弃原液,分别用1 g/L结晶紫染色(200 μL/孔)5 min;330 mL/L 冰醋酸洗去染液后,用酶标仪分别测定各孔570 nm波长处的OD值,并以此绘制生长曲线[6]。
1.5 多细菌生物膜在根尖牙骨质上形成的观察
取因正畸减数拔除的人单根恒牙3个,用慢速切锯切取长约3 mm的根尖,并沿长轴纵行劈开制成牙骨质片;分别经170 g/L EDTA浸泡10 min、52.5 g/L NaClO浸泡15 min、生理盐水彻底冲洗后;放入每孔加有2 mL BHI的24孔板中。先分别在各孔中加入10 μL衣氏放线菌悬菌液,置37℃厌氧培养箱中培养48 h;然后再分别于每孔中加入血链球菌和粪肠球菌菌悬液各10 μL继续培养。每天换1次BHI培养液,连续培养至第5天时取出各牙骨质片,用25 mL/L戊二醛溶液4℃固定过夜后,500、600、750、850、950、1 000 mL/L 乙腈梯度脱水;干燥、喷金,扫描电镜观察并拍照。
1.6 不同冲洗剂对多细菌生物膜作用的观察
取8 mm×8 mm细胞爬片45片,三蒸水冲洗,120℃ 30 min高压灭菌后,置于每孔加有2 mL BHI的24孔板中。先分别在各孔中加入10 μL衣氏放线菌菌悬液,并于37℃厌氧条件下培养48 h;然后再分别于每孔中加入血链球菌和粪肠球菌菌悬液各10 μL继续培养。每天换1次BHI培养液,连续培养至第5天时取出所有细胞爬片,用三蒸水冲洗两遍后按不同冲洗剂将其随机分为5大组:生理盐水冲洗组、SAEW 冲洗组以及 5、10、52.5 g/L NaClO冲洗组(生理盐水为阴性对照,52.5 g/L NaClO为阳性对照);然后将每一大组按不同冲洗时间再各随机分为3个亚组(15 s和1、5 min)。分别取上述各组爬片,并以相应的冲洗剂(每片1 mL)距样本1 cm进行缓慢冲洗相应的时间。冲洗结束后的各样本分别用Live/dead荧光活死菌染色剂(激发波和吸收波分别为480/500 nm和490/635 nm)进行染色后,激光共聚焦显微镜观察,并用ImageJ软件进行分析[7]。
1.7 统计学分析
2 结果
2.1 3种细菌相互作用实验结果
3种细菌分别在BHI琼脂平板以及营养缺乏的1/2 BHI琼脂平板中共同厌氧培养12 h后,均可见形态完整的菌落,3种细菌间未出现明显相互抑制(图1)。
2.2 多细菌生物膜成膜情况的观察
结晶紫染色观察结果显示,衣氏放线菌单菌种时,其细菌量(OD570 nm)在培养48 h内始终维持在0.3左右;当同时接种另外两种细菌共同培养时,其OD值从24 h开始随培养时间逐渐升高,70 h后快速升高,82 h达到峰值,此后趋于稳定(图2)。

图1 3种细菌在BHI和1/2 BHI培养基中的生长情况

图2 多细菌生物膜生长曲线
2.3 多细菌生物膜在牙骨质上形成的观察
3种细菌接种于牙骨质片上共同培养5 d后扫描电镜观察显示:牙骨质表面有大量表面光滑、形态完整的链状、球状和杆状细菌(图3 A~C);且各细菌相互聚集呈片状或团块状而形成的生物膜(图3 a~c)。
2.4 不同冲洗剂对生物膜细菌的杀灭作用
激光共聚焦观察显示,各冲洗时间(15 s和1、5 min)组的生物膜中均以绿色荧光为主,仅有少量红色荧光,且不随时间的延长而有明显改变(图4)。与生理盐水相比SAEW冲洗15 s组的绿色荧光明显减少,随着冲洗时间延长,红色荧光逐渐增多,亮度也逐渐增强(图 5);而各浓度(5、10、52.5 g/L)NaClO冲洗15 s组则以红色荧光为主,且随着冲洗时间延长而逐渐增多,但其亮度逐渐减弱(图6)。
ImageJ软件对各组的活菌比例进行分析显示:与生理盐水组相比,SAEW 以及5、10、52.5 g/L Na-ClO冲洗15 s和1、5 min各组的活菌比例均显著减少(P<0.05),其中SAEW 冲洗15 s组,5 g/L Na-ClO冲洗15 s和1、5 min组,10 g/L NaClO 冲洗15 s、1 min组的活菌比例均高于52.5 g/L NaClO相应冲洗时间组,差异有统计学意义(P<0.05);而SEAW冲洗1、5 min组,10 g/L NaClO冲洗5 min组的活菌比例分别与52.5 g/L NaClO相应冲洗组相比均无统计学差异(P>0.05)(图7)。以上结果提示,SAEW以及不同浓度的NaClO冲洗剂均能有效杀死生物膜上的细菌,其中SAEW在冲洗15 s时的活菌比例虽明显高于其他冲洗剂组,但延长冲洗时间至1 min即可达到与阳性对照组(52.5 g/L NaClO)相当的杀菌效果。

图3 多菌种生物膜在牙骨质上形成的SEM观察

图4 生理盐水冲洗不同时间后的多细菌生物膜CLSM图像(600×)

图5 强酸性电解质水冲洗不同时间后的多细菌生物膜CLSM图像(600×)
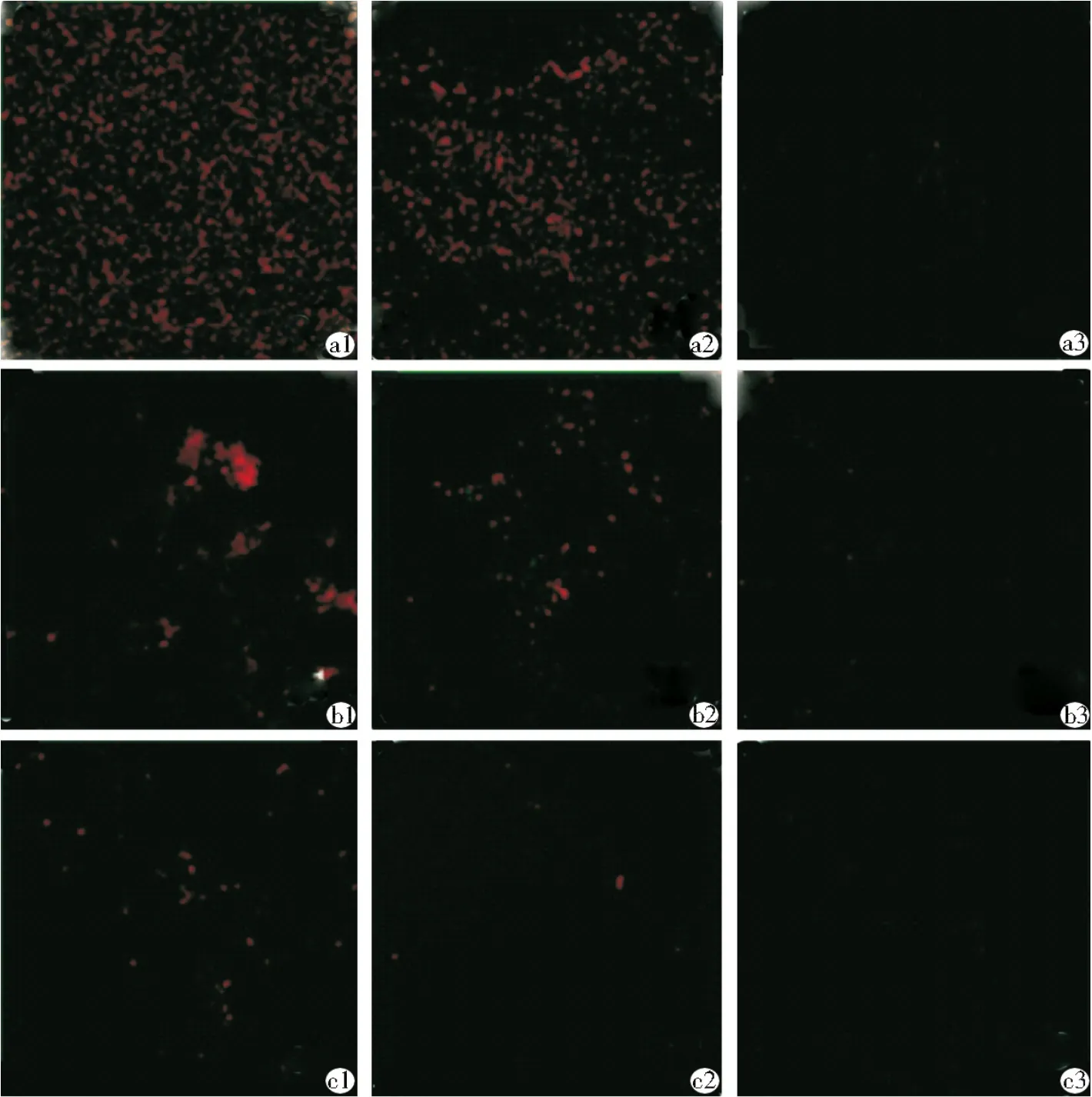
图6 不同浓度次氯酸钠冲洗不同时间后的多细菌生物膜CLSM图像(600×)
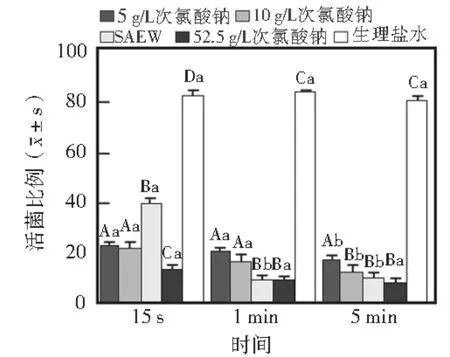
图7 各活菌比例比较
3 讨论
在细菌感染造成的疾病中60%都与生物膜有关[8]。有研究证明,根尖外生物膜是引起尖周组织反复感染的主要原因;而细菌生物膜与浮游态细菌相比,具有更强的耐药性和免疫抵抗性,仅靠机体自身免疫系统很难将其彻底清除[1]。
Leonardo等[9]通过电镜观察发现人的根尖外生物膜包绕于根尖及根尖牙骨质表面,其中细菌主要由球状菌、杆状菌和丝状菌组成。虽然有不少学者对根尖外生物膜的细菌组成进行了相关研究,如Noguchi等[10]对根尖外细菌进行 PCR-based 16srRNA测序,高阳[11]对根尖外的细菌进行了分离培养和鉴定,但均未得出完全一致的结果。有研究指出,放线菌常出现在持续性反复感染的根管内,可能是造成根管外感染的原因之一,特别是与临床相关的根尖放线菌病[12]。也有报道链球菌是根尖外生物膜中检测出最多的细菌,其中以血链球菌为主;该菌是最早定居在牙面的细菌,可通过与唾液作用而粘附,并能与多种细菌发生聚集反应[13]。另外,在根尖外感染中还发现有粪肠球菌,该菌能侵入牙本质小管内,并在营养缺乏的恶劣环境下生长,是难治性感染根管中最常检出的细菌;且在根尖外细菌生物膜中也有发现[11]。根据以上研究结果,本实验选用根尖生物膜中常见的衣氏放线菌,粪肠球菌和血链球菌在根尖牙骨质上共同培养,建立多细菌生物膜模型,并进行相关研究。
结晶紫染色法是观察生物膜上细菌生物量的手段之一,已有实验证明该方法所得结果与细菌计数结果密切相关[14]。本实验用结晶紫染色法检测显示,3种细菌所形成的生物膜随着时间的延长其中的细菌量逐渐增加,72 h后达到峰值。表明3种细菌共同培养72 h后可以形成完整的多细菌生物膜。
目前临床上去除根尖外生物膜的方法主要是进行根尖外科手术,通过切除根尖3 mm有生物膜的组织,以消除细菌依附的环境;也有学者提出,可采用Er:YAG激光照射的方法去除根尖外生物膜,并进行了体外研究[15],但有关杀菌液冲洗去除根尖外生物膜的方法目前尚未有报道。对于根管内生物膜,已有实验表明用SAEW对粪肠球菌生物膜进行处理后,其作用与52.5 g/L NaClO结果相当[16]。本结果显示,与生理盐水相比,SAEW以及不同浓度NaClO冲洗不同时间均能杀灭生物膜中的细菌。其中SAEW冲洗15 s时,生物膜中的活菌比例明显高于其他组,但延长冲洗时间至1 min时即可达到与52.5 g/L NaClO相同的效果。有研究表明SAEW在环境中可自然降解成盐水,与NaClO相比更安全并且无细胞毒性[17]。提示,SAEW在去除根尖外生物膜方面有着较好的应用前景。
[1]Nair PN.Pathogenesis of apical periodontitis and the causes of endodontic failures[J].Crit Rev Oral Biol Med,2004,15:348-381.
[2]Noiri Y,Ehara A,Kawahara T,et al.Participation of bacterial biofilms in refractory and chronic periapical periodontitis[J].J Endod,2002,28(10):679 -683.
[3]Bryce G,O’Donnell D,Ready D,Ng Y,et al.Contemporary root canal irrigants are able to disrupt and eradicate single-and dual-species biofilms[J].J Endod,2009,35:1243 -1248.
[4]Thorn RM,Lee SW,Robinson GM,et al Electrochemically activated solutions:evidence for antimicrobial efficacy and applications in healthcare environments[J].Eur J Clinl Microbiol Infect Dis,2012,31(5):641 -653.
[5]Chen L,Ge X,Wang X,et al SpxA1 involved in hydrogen peroxide production,stress tolerance and endocarditis virulence in Streptococcus sanguinis[J].PLoS One,2012,7(6):e40034.
[6]Teodósio JS,Silva FC,Moreira JM,et al.Flow cells as quasiideal systems for biofouling simulation of industrial piping systems[J].Biofouling,2013,29(8):953 -966.
[7]Lynch SV,Mukundakrishnan K,Benoit MR,et al..Escheriehia coli biofims formed under low-shear modeled microgravity in a ground"based system[J].Appl Environ Microbiol,2006,72(12):7701-7710.
[8]Shunmugaperumal T.Microbial colonization of medical devices and novel preventive strategies[J].Recent Pat Drug Deliv Formul Review,2010,4(2):153-173.
[9]Leonardo MR,Rossi MA,Silva LA,et al.EM evaluation of bacterial biofilm and microorganisms on the apical external root surface of human teeth[J].J Endod,2002,28(12):815 -818.
[10]Noguchi N,Noiri Y,Narimatsu M,et al.Identification and localization of extraradicular biofilm-forming bacteria associated with refractory endodontic pathogens[J].Appl Environ Microbiol,2005,71(12):8738 -8743.
[11]高阳.难治性根尖周炎的基础和临床实验研究[D].西安:第四军医大学硕士学位论文,2009-04-01.
[12]Signoretti FG,Endo MS,Gomes BP,et al.Persistent extraradicular infection in root-filled asymptomatic human tooth:scanning electron microscopic analysis and microbial investigation after apical microsurgery [J].J Endod,2011 Dec,37(12):1696-1700.
[13]Chen L,Ge X,Wang X,et al SpxA1 involved in hydrogen peroxide production,stress tolerance and endocarditis virulence in Streptococcus sanguinis[J].PLoS One,2012,7(6):e40034.
[14]Alnnasouri M,Dagot C,Pons MN,et al.Comparison of four methods to assess biofilm development[J].Water Sci.Technol,2011.63(3):432 -439.
[15]Araki AT,Ibraki Y,Kawakami T,et al.Er:Yag laser irradiation of the microbiological apical biofilm[J].Braz Dent J,2006,17(4):296 -299.
[16]赵春苗,程小刚,范晓敏,等.电解质水对粪肠球菌生物膜的杀菌作用研究[J].牙体牙髓牙周病学杂志,2013.23(1):17-20.
[17]Iwasawa A,Nakamura Y Cytotoxic effect of anti-septics:comparison In vitro.In vivo examination of strong acidic electrolyzed water,povidone-iodine,chlorhexi-dine and benzalkonium chloride[J].Kansenshogaku Zasshi,2003,77(5):316 -322.
