NICD过表达对人牙髓干细胞细胞增殖及细胞迁移的影响
2014-05-18李适廷谭颖徽
胡 超,李适廷,张 纲,谭颖徽
(第三军医大学新桥医院口腔科,重庆 400037)
DPSCs是Gronthos等(2000)从人第三磨牙牙髓中分离出的具有克隆源性的多潜能细胞[1]。进一步研究发现,DPSCs在体外能形成高密度散在的矿化结节;植入免疫缺陷小鼠皮下能形成与天然牙齿结构近似的牙髓 — 牙本质复合体,从而证实DPSCs具有自我更新的能力[2]。另外,DPSCs还具有横向分化的潜能,在不同的微环境作用下可分化为成牙本质细胞、肌细胞、脂肪细胞等多种细胞。
Notch信号通路可通过细胞间相互作用的方式精确地调节细胞的增殖、分化和凋亡,在生物体发育过程中决定着细胞的不同命运[3]。目前已证实,Notch信号通路的激活是由两个相邻细胞的Notch受体与配体相互作用而实现的:位于相邻细胞间的细胞膜上的Notch受体与配体结合后,可通过两次酶切释放出Notch1的胞内段NICD,并进而激活Notch信号通路[4]。本课题组前期研究发现,采用慢病毒介导的RNAi抑制Notch配体Delata1的表达时,能够抑制 DPSCs的增殖,促进其分化[5]。然而,当NICD过表达时对DPSCs有何生物学效应目前尚缺乏研究。本实验在前期研究过表达NICD的基础上,研究NICD在DPSCs上的表达及其对DPSCs的增殖和迁移的影响。
1 材料和方法
1.1 主要试剂和仪器
DMEM/F12培养基(Hyclon,美国);胎牛血清(Gibco,美国);CCK-8 试剂盒(DOJINDO,日本);Western blot相关试剂(武汉博士德);Notch1抗体(Cell Signaling,美国);RNA提取试剂盒及实时聚合酶链反应(Polymerase chain reaction,PCR)试剂盒(TAKARA,日本);Transwll小室(北京康宁);超净工作台(YG875型,苏州);倒置显微镜(Olympus IMT-Z型,日本);凝胶成像系统(GelDco2000,美国);所用引物由大连宝生物公司合成。
1.2 方法
1.2.1 人牙髓干细胞的分离和培养
选取16~25岁志愿者因正畸减数拔除的健康(无牙体牙周疾病)恒牙,无菌条件下取出牙髓组织,参照文献[5]报道的方法,采用酶消化法分离、培养牙髓干细胞(DPSCs);并分别经 vimentin、GFAP、nestin表达的检测,以及成牙本质诱导后标志性蛋白DSPP表达的检测和钙化结节形成情况等鉴定后[5],接种于100 mL的培养瓶;加入含100 mL/L胎牛血清(FBS)的 DMEM/F12于50 mL/L CO237℃ 条件下进行培养和传代。取第2~3代细胞用于实验。
1.2.2 慢病毒转染及稳定株的筛选
取生长良好的第3代DPSCs,以每孔2×104的密度接种于24孔板,常规培养至细胞贴壁后,用本课题组前期构建的NICD过表达的慢病毒按MOI值为50所对应的病毒量转染细胞;2 d后用含嘌呤霉素终浓度为0.8 μg/mL的培养基筛选,即可得到稳定过表达NICD的细胞株。然后分别取经慢病毒转染过表达NICD的细胞株(DPSCs/NICD组)、经空病毒感染的空载细胞株(DPSCs/vector组)以及正常细胞株(DPSCs/wt组)进行以下检测和观察。
1.2.3 RT-PCR 检测 NICD 的 mRNA表达
分别取上述3组细胞株,用RNA提取试剂盒提取细胞总RNA,并反转录合成cDNA。然后以cDNA为模板、GAPDH为内参照,用以下引物(上游:5’-CGCGGATCCATGCACCTGGATGCCGCTGACCTG-3’;下游:5’-ACGTCTAGACTTGAAGGCCTCCGGAATGCG -3’)按 RT-PCR 试剂盒说明进行特异性扩增。反应条件为:94℃预变性5 min,随后 94 ℃ 30 sec,60 ℃ 30 sec,72°C 30 sec,并进行35个循环;最后72℃ 5 min延伸。扩增产物经凝胶电泳(15 g/L琼脂糖+6 μL EB制胶,电泳缓冲液为 TBE,每孔上样约5 μL,电泳时间约40 min)后,用凝胶成像分析系统分析并拍照。
1.2.4 Western-blot检测 NICD 的蛋白水平表达
3组细胞用蛋白裂解液裂解细胞,待细胞充分裂解后收集裂解液,12 000 r/min离心10 min,取上清获得总蛋白;并用BCA法测定蛋白浓度。然后取各组细胞总蛋白,以60 μg/孔上样,用10%SDSPAGE胶进行电泳。电泳后 PVDF转膜,加入1∶1 000稀释的一抗NICD 4℃孵育过夜;TBST洗膜,加入二抗37℃孵育1 h;DAB显色、凝胶成像仪显像后,以β-actin作为内参照,用Quantity one软件对蛋白质印迹图像进行灰度分析,以NICD蛋白条带与β-actin蛋白条带的比值作为NICD表达的相对含量,实验重复3次。
1.2.5 CCK8法检测3组细胞增殖的变化
分别取上述3组细胞以每孔5×103的密度接种于96孔板,37℃、50 mL/L CO2条件下进行培养。分别于培养1、2、3、4、5 d各时间点取各组细胞(每组5个复孔),每孔加入10 μL CCK8继续孵育4 h后,用酶标仪在450 nm波长下检测各孔的吸光度值。
1.2.6 流式细胞仪检测3组细胞周期的变化
分别取上述3组细胞消化制成单细胞悬液,PBS洗涤后加入至预冷的700 mL/L乙醇中4℃固定过夜;然后每组各取100 μL细胞悬液并分别加入碘化丙啶各5 μL,室温静置1 h后用流式细胞仪检测细胞S期的比例。
1.2.7 细胞免疫荧光检测NICD表达的位置
分别取上述3组细胞制作细胞爬片,用40 g/L多聚甲醛固定10 min后PBS冲洗,50 g/L Triton穿孔15 min;PBS冲洗,50 g/L BSA封闭30 min;PBS冲洗,滴加1∶200稀释的一抗NICD 4℃冰箱过夜,二抗37℃杂交2 min;DAPI避光染色5 min,抗猝灭封片剂封片,激光共聚焦下观察并拍照。
1.2.8 Transwll检测3组细胞的迁移能力
取康宁公司8 μm规格带基质胶的Transwell小室,铺上无血清培养基与Matrigel胶8∶1稀释的液体50 μL,12 h后吸出多余的液体备用。然后取上述3组细胞,分别用无血清的培养基制成单细胞悬液后,各取100 μL(含3 000个细胞)接种于Transwell的上室;并在其下室加入 600 μL含100 mL/L胎牛血清的培养基作为趋化剂,放入37℃、50 mL/L CO2的培养箱内培养。培养48 h后用棉签刮除上室底部的基质胶,PBS漂洗上表面3次后,用4℃预冷的40 g/L多聚甲醛固定细胞20 min;然后取出各小室,用PBS洗涤3次后风干,用1 g/L的结晶紫染色30 min。染色后的各组小室分别用显微镜进行观察,并于高倍镜下各随机选取5个视野计算其细胞数,每组重复3次。
1.3 统计学分析
2 结果
2.1 NICD mRNA在3组细胞中的表达
RT-PCR检测结果显示,DPSCs/NICD组(实验组)的NICD mRNA表达较另外两组明显增强,而DPSCs/vector组(空载组)和DPSCs/wt组(正常对照组)的NICD mRNA表达均很弱,且两组间无明显差异(图1)。进一步从转录水平证明了DPSCs/NICD组NICD的mRNA表达水平增强。
2.2 NICD蛋白在3组细胞中的表达
Western-Blot检测结果显示,DPSCs/NICD组的NICD蛋白相对表达量为0.46±0.047,均明显高于 DPSCs/vector组 0.233±0.022和 DPSCs/wt组0.218 ±0.023,差异有统计学意义(P <0.05);而DPSCs/vector组与DPSCs/wt组相比无统计学差异(P>0.05)(图2)。

图1 RT-PCR检测NICD mRNA在3组细胞中的表达

图2 western blot检测NICD蛋白在3组细胞中的表达
2.3 NICD过表达对DPSCs增殖的影响
2.3.1 CCK8 法检测结果
培养1 d时,3组细胞的增殖速度均无明显差异(P>0.05);从第2天起到第5天各时间点,DPSCs/NICD组的细胞增殖速度均明显高于另外两组(P <0.05),而 DPSCs/vector组与 DPSCs/wt组相比,各时间点的细胞增殖速度均无统计学差异(P>0.05)(表 1)。
2.3.2 流式细胞仪检测结果
流式细胞仪检测各组细胞时项中S期的比列显示:DPSCs/NICD组的S期比例最高,与另两组相比差异均有统计学意义(P<0.05);而DPSCs/vector组与DPSCs/wt组的S期比例相比无统计学差异(P>0.05)(图3、表2)。以上结果表明,转染外源性NICD后的DPSCs处于增殖活跃状态。
表1 各组细胞1~5 d内的增殖情况比较()

表1 各组细胞1~5 d内的增殖情况比较()
不同字母组间P<0.05
吸光度值1 d 2 d 3 d 4 d 5 d DPSCs/NICD 0.6924 ±0.043a 1.0042 ±0.057a 1.3350 ±0.051a 1.7018 ±0.057a 1.8934 ±0.058组别a DPSCs/vector 0.7032 ±0.024a 0.8778 ±0.041b 1.1232 ±0.035 1.4590 ±0.039b 1.5996 ±0.067b DPSCs/wt 0.6994 ±0.031a 0.8993 ±0.030b 1.1136 ±0.062 1.4822 ±0.067b 1.5620 ±0.044b

图3 流式细胞仪检测各细胞周期的比例
表2 3组细胞S期百分率比较()

表2 3组细胞S期百分率比较()
不同字母组建P<0.05
期百分率DPSCs/NICD 3 43.54 ±1.55组别 n S a DPSCs/vector 3 26.13 ±3.00b DPSCs/wt 3 24.91 ±1.50b
2.4 细胞免疫荧光检测NICD在3组细胞中的表达
荧光显微镜观察显示:单通道下3组细胞的DAPI染色均呈亮蓝色,NICD染色在DPSCs/wt组和DPSCs/vector组中呈微弱绿色,但胞核中未见绿色表达;而在DPSCs/NICD中亮度明显增强,且在胞核中亦有绿色荧光表达,双通道下胞核与胞质完全对应(图4~6)。表明NICD在DPSCs/NICD组中的表达较另外两组明显增强,而且除胞膜和胞浆外,在细胞核中也有表达。
2.5 NICD过表达对DPSCs迁移能力的影响
Transwll检测结果显示:DPSCs/NICD组的迁移细胞数明显高于DPSCs/wt组和DPSCs/vector组(P <0.05);而 DPSCs/vector组与 DPSCs/wt组迁移细胞数相比,无统计学差异(P>0.05)(图7,表3)。表明转染外源性NICD可增强DPSCs细胞的迁移能力。

图4 DPSCs/wt DAPI和NICD荧光染料双染(×800)
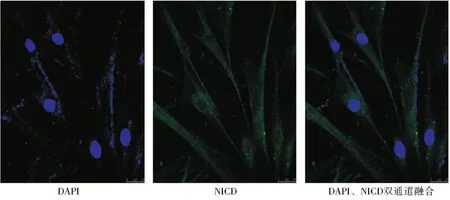
图5 DPSCs/vector DAPI和NICD荧光染料双染(×800)

图6 DPSCs/NICD DAPI和NICD荧光染料双染(×800)

图7 3组细胞在高倍镜下的细胞个数(×400)
表3 各组迁移的细胞数比较()

表3 各组迁移的细胞数比较()
不同字母组间P<0.05
细胞个数DPSCs/NICD 5 32.40 ±4.669组别 n a DPSCs/vector 5 18.80 ±4.4944b DPSCs/wt 5 18.20 ±2.9496b
3 讨论
DPSCs是位于牙髓组织中的一种成体干细胞,在正常情况下处于静息状态,并参与细胞的新旧更替,维持牙髓内环境的稳定。当外界刺激导致牙本质细胞受损时,DPSCs能够分化成为成牙本质细胞,并通过形成修复性牙本质而参与组织的再生[6]。随着人们对成牙机理的认识和组织工程学的飞速发展,牙齿组织工程化已成为国内外关注的热点,而DPSCs作为牙组织工程的种子细胞,已受到越来越多的关注。DPSCs与一些生物相容性材料植入裸鼠体内能够获得牙髓-牙本质复合体结构[7],从而为牙体损伤修复开辟了一条新的路径。
DPSCs在自身增殖及分化为成牙本质细胞的过程中,受到多种信号通路的调控,Notch信号通路就是其中非常重要的一种。本课题组前期分别通过慢病毒载体过表达Notch配体Delta1和RNAi抑制Notch配体Delta1,证明Notch信号通路能够促进细胞的增殖,抑制细胞的分化,维持细胞的原始梭形形态[5,8]。
Notch信号通路由两个邻近细胞的Notch受体与配体相互作用而激活。受体与配体结合后经过α -转化酶 (TNF-α converting enzyme,TACE)和 γ分泌酶的两次酶切,释放出Notch的胞内段(Notch intracellular domain,NICD),NICD转移至细胞核内则可激活通路下游的基因。将外源性NICD编码基因导入靶细胞后,能够活化Notch通路下游的基因,其对靶基因的调控与 Notch配体所诱导的Notch信号途径的激活相一致[9-10]。因此,通过高表达NICD来模拟细胞内Notch途径上调的过程被广泛应用于Notch途径的研究中[11]。
本实验发现,转染外源性NICD后的DPSCs增殖速度明显加快,细胞周期中S期比例升高。细胞S期的比率能间接反映细胞增殖能力的强弱,处于S期的细胞较其他期的细胞有更高的增殖能力[12]。Notch信号通路的受体Notch1主要分布在胞膜和胞浆上,而释放的胞内段NICD除了在胞膜和胞浆表达以外,在胞核也出现了表达,表明NICD在Notch信号通路中起到了一个信号传递的作用,并继而在胞核内激活下游基因的表达。Notch信号通路与肿瘤发生发展过程关系密切,根据组织来源和细胞类型的不同,Notch的配体Notch1可以促进或抑制细胞的迁移。有研究证实,在肺癌[13]、乳腺癌[14]中,Notch1能够促进肿瘤细胞的迁移;而在前列腺癌[15]中,转染外源性Notch1能够抑制肿瘤细胞的迁移。然而,Notch1对DPSCs迁移的作用目前未见报道。本实验发现,转染外源性NICD后的DPSCs迁移能力明显增强,表明当牙髓损伤时,Notch信号通路被激活,从而促进DPSCs能够迅速迁移至牙髓损伤处,参与组织的修复。
本实验结果提示,当牙髓损伤时可通过激活Notch信号通路而促进DPSCs迅速增殖,并迁移至牙髓损伤处。然而Notch信号通路本身会抑制DPSCs向成牙本质细胞分化,表明在内环境调控修复性牙本质生成的过程中,必然会有另外的调控机制与Notch产生协同和拮抗作用,因此还有待于进一步研究。
[1]Laino G,Aquino R,Graziano A,et al.A new population of human adult dental pulp stem cells:a useful source of living autologous fibrous bone tissue(LAB)[J].Bone Mineral Res,2005,20(8):1394-1402.
[2]Gronthos S,Brahim J,Li W,et al.Stem cell properties of human dental pulp stem cells[J].Dent Res,2002,81(8):531 -535.
[3]Hori K,Sen A,Artavanis-Tsakonas S.Notch signaling at a glance[J].Cell Sci,,2013,126(10):2135 -2140.
[4]Artavanis T,Rand M,Lake R,et al.Notch signaling:cell fate control and signal integration in development[J].Science,1999,284(5415):770-776.
[5]Wang X,He F,Tan Y,et al.Inhibition of Delta1 promotes differentiation of odontoblasts and inhibits proliferation of human dental pulp stem cells in vitro[J].Oral Biology,2011,56(9):837-845.
[6]张萍,朱聪慧,谭颖徽,等.人牙髓干细胞向成牙本质细胞定向分化过程中miRNAs表达谱筛选及鉴定[J].实用口腔医学杂志,2011,27(2),212-217.
[7]郭红延,郭希明,吴补领,等.重建牙本质-牙髓复合体样结构的实验研究[J].中华口腔医学杂志,2005,40(6):511-514.
[8]He F,Yang Z,Tan Y,et al.Effects of Notch ligand Delta1 on the proliferation and differentiation of human dental pulp stem cells in vitro[J].Arch Oral Biol,2009,54(3):216 - 2 22.
[9]Penton AL,Leonard LD,Spinner NB.Notch signaling in human development and disease[J].Semin Cell Dev Biol,2012,23(4):450-457.
[10]Talora C,Cialfi S,Segatto O,et al.Constitutively active Notch1 induces growth arrest of HPV-positive cervical cance cells via separate signaling pathways[J].Exp Cell Res,2005,305(2):343-354.
[11]陈龙,王丹,李红,等.人源性Notch1胞内段真核表达载体的构建[J].辽宁医学院学报,2011,32(2):102-104.
[12]赵智亮,张纲,谭颖徽,等.受体活性修饰蛋白1过表达对降钙素基因相关肽促MG-63增殖作用的影响[J].中华口腔医学杂志,2012,47(8):495-500.
[13]Zhou H,Luo Y,Chen J,et al.Knockdown of TRB3 induces apoptosis in human lung adenocarcinoma cells through regulation of Notch 1 expression[J].Mol Med Rep,2013,8(1):47 -52.
[14]Zhu H,Bhaijee F,Ishaq N,et al.Correlation of Notch1,pAKT and nuclear NF-κB expression in triple negative breast cancer[J].Cancer Res,2013,3(2):230 -239.
[15]Zhu H,Zhou X,Redfield S,et al.Elevated Jagged-1 and Notch-1 expression in high grade and metastatic prostate cancers[J].Transl Res,2013,5(3):368-378.
