克诺罗杆菌检测用单克隆抗体的制备及功效评价
2014-05-17袁辰刚杨海荣杨捷琳潘良文何宇平
袁辰刚,杨海荣,杨捷琳,*,吴 杨,陈 颖,潘良文,何宇平
(1.上海出入境检验检疫局,上海200135;2.中国检验检疫科学研究院,北京100123;3.上海友科生物科技有限公司,上海201203)
克诺罗杆菌,原名阪崎肠杆菌。2008年,Iversen建议将阪崎肠杆菌重新分类,成为肠杆菌科1个新属,即克罗诺杆菌属(Cronobacter spp.)。包括5个新种(其中Cronobacter sakazakii称为新组合)、1个克罗诺杆菌基因种(genomospecies)和三个新亚种[1-3],2011年增加了一个新种C.condimenti[4]。Mullane等[5]对克诺罗杆菌O抗原的研究结果也支持这一新分类方法。
克诺罗杆菌作为近年来日渐受到关注的食源性致病菌,感染多见于新生儿和出生3d到4岁左右的婴幼儿,其中尤以免疫力低下儿童为主。目前为止有9例成人感染克诺罗杆菌病例的报道[6]。该菌能够引起婴儿脑膜炎、脓血症和小肠结肠炎[7],在牛奶中易于形成生物膜,也使这一致病菌的防控更加困难[8]。1961年到2003年报道的76个病例中19例死亡,综合统计死亡率高达50%以上[9-10],也使得各方面对这一污染来源、生态学及毒力因子尚不清楚的微生物更加关注。WHO/FAO会议将克诺罗杆菌列为“A”类细菌,即已经确证能够引起人类疾病的高风险性食源性病原菌[11]。Muytjens等发现,来自35个国家的141种婴儿配方奶粉约14%含有克诺罗杆菌,含量从0.36 ~66.0CFU/100g不等[12]。Nazarowec-White和Farber测试了加拿大5家不同公司的120罐婴儿配方奶粉,发现其中6.7%含有克诺罗杆菌,阳性样品中克诺罗杆菌的量通常是0.36CFU/100g[13]。2004年,我国阜阳劣质奶粉样品中阪崎肠杆菌(克诺罗杆菌)污染率为12.6%[14]。
现行的《GB 4789.40-2010食品微生物学检验阪崎肠杆菌检验》中,利用克诺罗杆菌特有的α-葡萄糖苷酶活性,采用DFI选择性平板培养进行分离检验。整个检测过程需要4 ~5d才能完成,周期较长。目前建立的克诺罗杆菌快速检测方法以分子生物学检测方法为主,存在专业技能要求高,设备昂贵,难以区分死活细菌的弊端,而免疫学检测方法的建立以获得特异性、灵敏度较好的抗体为基础,一旦建立,具有应用简便,成本低廉,快速,高通量等多重优势。
克诺罗杆菌属这一新属的建立,说明了克诺罗杆菌分类学地位上的复杂性。目前,克诺罗杆菌代表菌株种类已有9株,菌株之间DNA同源性差异较大,因此增加了抗体制备的复杂性[2-4]。本文以克诺罗杆菌多个代表菌株为抗原,进行了单抗原、多抗原单独免疫、组合免疫的多种尝试,筛选制备克诺罗杆菌的单克隆抗体,为建立克诺罗杆菌免疫学快速检测方法打下基础。
1 材料与方法
1.1 材料与仪器
克诺罗杆菌(8株标准菌株)购自美国模式培养物保藏所(American Tissue Culture Collection,ATCC)及德国微生物菌种保藏中心(Deutsche Sammlung von Mikroorganismen und Zellkulturen,DSMZ)菌种保藏中心;大肠杆菌(ATCC 25922)、沙门氏菌(ATCC 13076)、阴沟肠杆菌(ATCC 13047)、志贺菌(ATCC 25931)、奇异变形杆菌(ATCC 12453)、肺炎克雷伯氏菌(ATCC 27336)均为上海出入境检验检疫局动植物与食品检验技术中心保存;6 ~8周龄雌性BABL/c小鼠 体质量20g左右,购自第二医科大学实验动物中心;福氏佐剂、PEG 4000、HAT、Protein G Sepharose、HRP标记的羊抗鼠IgG及小鼠Ig亚类检测试剂盒 均购自Sigma公司;Protein G Sepharose硝酸纤维膜 购自上海生工生物技术公司;RPMI1640培养基 Gibco公司产品;胎牛血清 Hyclone公司产品;小鼠骨髓瘤细胞Sp2/0 中国武汉典型培养物保藏中心(IQCC)保存。
二氧化碳培养箱 日本三洋;倒置显微镜 上海蔡康;超净工作台 上海上净;恒温摇床 上海天呈;超声破碎仪 宁波新芝;酶标仪 美国Thermo。
1.2 实验步骤
1.2.1 动物免疫 克诺罗杆菌标准菌接种于50mL LB培养基中,37℃250r/min摇培养过夜,0.5%甲醛灭活,10000r/min离心10min弃上清液,菌体用10mL无菌PBS重悬。抗原制备采用两种方式结合:a:超声裂解:菌体悬液超声裂解,超声功率300W,超声12s,停12s,每轮3min,2轮,裂解液离心(10000r/min,10min),弃去沉淀,上清液即为细菌裂解蛋白溶液;b:冻融裂解:4℃离心细菌培养物,PBS洗3次,液氮反复冻融三次,13000r/min冷冻离心后取上清液。四倍体积冷丙酮沉淀蛋白并洗涤沉淀两次去除色素等杂质,冷冻保存备用。两种方式制备的细菌裂解物按1∶1比例混合作为抗原使用。
克诺罗杆菌的标准菌株共8株,分别为ATCC 29544、ATCC 51329、NCTC 9529、DSM 18702、DSM 18703、DSM 18705、DSM 18706、DSM 18707,按照克诺罗杆菌新属的分类学研究,每个标准株代表一个种或亚种的克诺罗杆菌,不同的种或亚种之间基因差异较大,因此推测其免疫原性也存在差别。因此,选择8株标准菌株中部分进行免疫,分别为DSM 18702、DSM 18705、NCTC 9529、ATCC 29544。
细菌裂解蛋白溶液用BCA法确定蛋白浓度,即为抗原蛋白,抗原用PBS稀释至1.5mg/mL,分装冻存于-20℃,第一次免疫取1000μL抗原与1000μL福氏完全佐剂混合,乳化,腹腔注射6只小鼠;14d后,取1000μL抗原与1000μL福氏不完全佐剂混合,乳化,腹腔注射6只小鼠免疫;第二次免疫14d后进行第三次免疫,取1000μL原与1000μL福氏不完全佐剂混合,乳化,腹腔注射6只小鼠;第36d进行第四次免疫。第四次免疫间隔3d后,小鼠眼眶静脉采血,收集血清,Elisa检测小鼠血清效价,血清效价大于104时,即达到进行融合的最低标准。融合前3d进行加强免疫,取50μg抗原直接腹腔注射6只小鼠;选定合格的小鼠,3d后进行细胞融合。
2018年培训内容和形式已逐渐趋向成熟。考虑以后将手机、电脑联机,操作通过扫描大屏二维码注册使用中、外文数据库,演示检索过程,让新员工有更直观的认识和更深入地参与。
1.2.2 细胞融合 选择处于对数生长期的SP2/0细胞,用弯头吸管将细胞吹下,收集于50mL离心管中,离心弃上清液,用DMEM培养基将细胞重悬调整细胞数,置孵箱中备用。小鼠摘眼球取血收集血清作为阳性对照,取脾脏经筛网研磨后收集脾细胞进行融合,将脾细胞与SP2/0细胞混匀,1200r/min离心5min,尽量弃去上清液,将细胞弹松,吸1mL预热的融合剂(PEG1450),在1 min内逐滴加入,再放置37℃水浴中反应1min,然后加入终止液(在5min内加入25mL DMEM培养基,并轻轻搅拌细胞),1200r/min离心5min。弃去上清液,加入100mL预热的HAT培养基,将细胞重悬,轻轻混匀(用吸管从底部吸起细胞,在液面顶部轻轻盘旋滴入)。用排枪加入预先接种饲养细胞的96孔板中,每孔100μL,铺10块板,置孵箱中培养,有限稀释后接种96孔板,每孔100μL,铺10块板,常规方法进行单克隆。
1.2.3 ELISA检测抗体效价 将抗原用CBS稀释为10μg/mL,加入酶标板中,每孔100μL,4℃过夜。将包被液弃去,每孔加入200μL封闭液(5%脱脂奶粉),37℃放置1.5h。弃去封闭液,加入样品,每孔100μL加入酶标板,37℃放置1h。酶标羊抗鼠用封闭液稀释至工作浓度,每孔100μL加入酶标板,37℃放置30min,用自来水冲洗10次,拍干,加入TMB显色底物,每孔100μL加入酶标板,37℃放置15min,每孔加入2mol/L H2SO450μL终止液,酶标仪OD450nm读数。
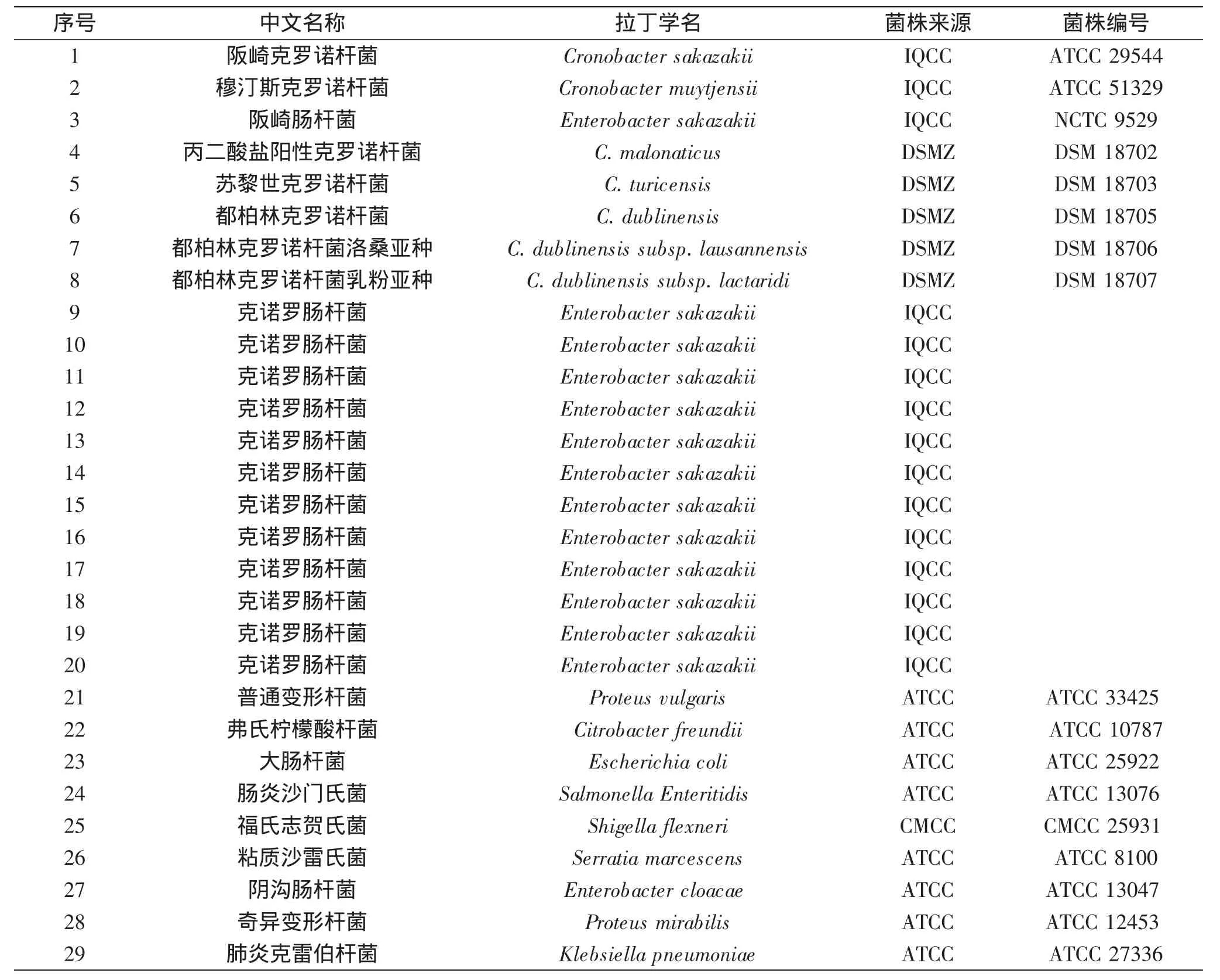
表1 克诺罗杆菌单克隆抗体制备中所用菌株Table 1 Strains used in Cronobacter sakazakii monoclonal antibody screen
1.2.4 抗体腹水制备 预先腹腔注射石蜡油到小鼠体内,将杂交瘤细胞用弯头吸管吹打制成悬液,计数,用少量DMEM将细胞重悬,腹腔注射入石蜡鼠体内(每只小鼠注射2×106细胞),处死小鼠吸出腹水,并取少量Elisa检测腹水效价,Protein G柱纯化,PBS透析过夜,Elisa检测效价。Protein G纯化抗体,紫外吸收测定浓度,SDS-PAGE进行纯度分析,-20℃分装保存。
1.2.5 抗体特异性鉴定 Western blot鉴定:将克诺罗杆菌(ATCC29544)、大肠杆菌、肠炎沙门氏菌、阴沟肠杆菌、福氏志贺氏菌、奇异变形杆菌各取少量菌液与2×Loading Buffer等体积混合均匀后煮沸10min,每孔12μL上样(上样量约为20μg全菌蛋白),SDS-PAGE电泳,转膜(300mA,1h),用5%脱脂奶粉封闭过夜,抗体稀释至1μg/mL,室温振荡孵育1h,洗涤3次,用GE的ECL-PLUS试剂盒曝光,将成像后的胶片扫描保存。
ELISA鉴定:用灭活的菌体作为抗原包被96孔酶标板,采用间接ELISA法,设置空白、阳性、阴性对照,分别和20种不同菌株进行交叉反应实验。
1.2.6 单克隆抗体亚类鉴定 按照mAb亚类检测试剂盒说明书进行操作。
1.2.7 亲和力的测定 以80、40、20、10、5、2.5ng/mL浓度的菌体抗原包被96孔板,间接ELISA法检测相应的OD值,以1000 ~0ng/mL对倍稀释的mAb对数值为横坐标,以其相应的OD值为纵坐标,绘制出测定曲线,以各曲线上部趋于平坦段的OD值为100%,查出其OD值为50%时的mAb浓度,根据公式计算每株mAb的亲和力常数。
1.3 胶体金检测试纸条的制备
1.4 灵敏度及特异性测试
取阪崎肠杆菌标准菌株ATCC 29544,37℃过夜培养,10倍梯度稀释,添加到购买的牛奶中使细菌终浓度达到10 ~108CFU/mL,按照GB 4789.40-2010食品微生物学检验阪崎肠杆菌检验中所述方法,取检样加入缓冲蛋白胨水,充分混匀后(36±1)℃培养(18±2)h。将每个梯度的菌液取1mL进行胶体金试纸条检测,同时以缓冲蛋白胨水作为空白对照。取克诺罗杆菌标准菌株代表株、分离菌株及其他阴性菌株包括沙门氏菌、克雷伯氏菌、沙雷氏菌、大肠杆菌、阴沟肠杆菌、枸橼酸杆菌、志贺氏菌、变形杆菌等,接种于5mL肉汤37℃过夜培养,取1mL进行胶体金试纸条检测,同时以缓冲蛋白胨水作为空白对照,确定克诺罗杆菌胶体金试纸条的特异性。
2 结果与讨论
2.1 杂交瘤细胞株的筛选和亚克隆
抗原免疫后,杂交瘤细胞株建立过程中进行2次融合,融合率在90%以上。细胞融合10d后,杂交瘤细胞克隆生长至肉眼可见时,采用间接ELISA对其进行检测,抗原采用超声破碎、冻融及全抗原,检测结果表明,超声破碎的抗原检测阳性率最高。筛选出效价高,特异性好或覆盖面大的细胞孔进行三次以上的亚克隆。细胞融合时,在HAT选择培养下,一些未融合或自身融合的细胞死亡,背景杂乱,经亚克隆培养后,可见背景相对干净的单个克隆生长。经筛选和检测获得6株能稳定分泌mAb的杂交瘤细胞株,分别命名为:5A8、2H1、1F2、4H11、2H8、5C4。
2.2 单克隆抗体特异性鉴定
选择克诺罗杆菌阳性菌株共20株,包括8株标准菌株及12株分离株,以及克诺罗杆菌同属的阴沟肠杆菌、产气肠杆菌以及常见的食源性致病菌等9株作为阴性对照,共29种菌进行交叉反应实验(见表2)。从反应结果来看,克诺罗杆菌各标准菌株单独或混合作为免疫原,获得的抗体性质差异较大,DSM18702免疫的小鼠选取2只进行两次融合,都没有筛选到阳性克隆,DSM 18705免疫的小鼠进行融合,筛选到阳性克隆,最后建株的单克隆抗体细胞株均来自菌株DSM 18705免疫所获得。在所有筛选获得的细胞株中,5A8针对所有的测试细菌都有反应,虽然该抗体的特异性较差,但由于5A8与实验中所有的克诺罗杆菌标准菌株和分离菌株都呈阳性反应,覆盖面最大,可以在后续的胶体金试纸条制备及试剂盒研发等实际产品的应用开发中作为捕获抗体,可以提高检测的灵敏度,因此在最后的筛选过程中予以保留(见表2)。

图1 Western Blot检测克诺罗杆菌5C4抗体特异性Fig.1 Weatern Blot test of C.sakazakii mAb 5C4 specificity

表2 单克隆抗体特异性测试Table 2 Specificity test for established C.sakazakii Mabs
采用Western Blot鉴定抗体特异性(图1),结果表明,获得的5C4抗体用于克诺罗杆菌ATCC29544检测有阳性条带出现,但对于肠炎沙门氏菌、阴沟肠杆菌、福氏志贺氏菌、粘质沙雷氏菌、大肠杆菌、奇异变形杆菌、肺炎克雷伯氏菌、普通变形杆菌、弗氏柠檬酸杆菌等对照菌株没有反应条带出现。
2.3 细胞培养上清液和腹水效价测定
分别收集阳性杂交瘤细胞培养上清和腹水,按10倍梯度稀释,间接ELISA方法检测效价,以P/N值≥2.1时的最高稀释倍数为此单抗的效价,所制备的单克隆抗体及腹水效价均能达到1×107以上。
2.4 单克隆抗体亚类鉴定及亲和力的测定
采用抗体亚类试剂盒测定,6株单克隆抗体1F2、5C4、2H8、5A8、4H11、2H1的Ig亚类分别为IgG3、IgG2b、IgG3、IgG1、IgG3、IgG1(见表3)。间接ELISA法测定本研究中的6株mAb的相对亲和常数均大于1.0×1010L/mol,显示制备的单抗与克诺罗杆菌的亲和力高(见表4)。
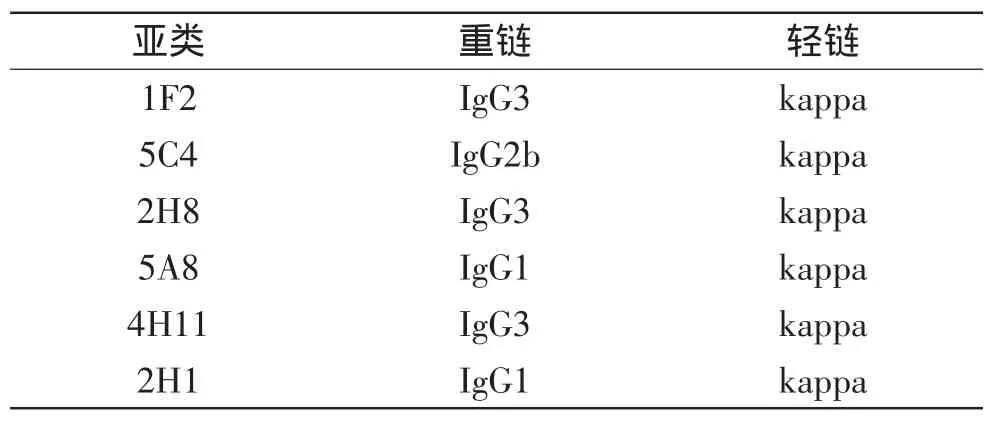
表3 单克隆抗体亚类鉴定Fig.3 Subgroup identification of MAb
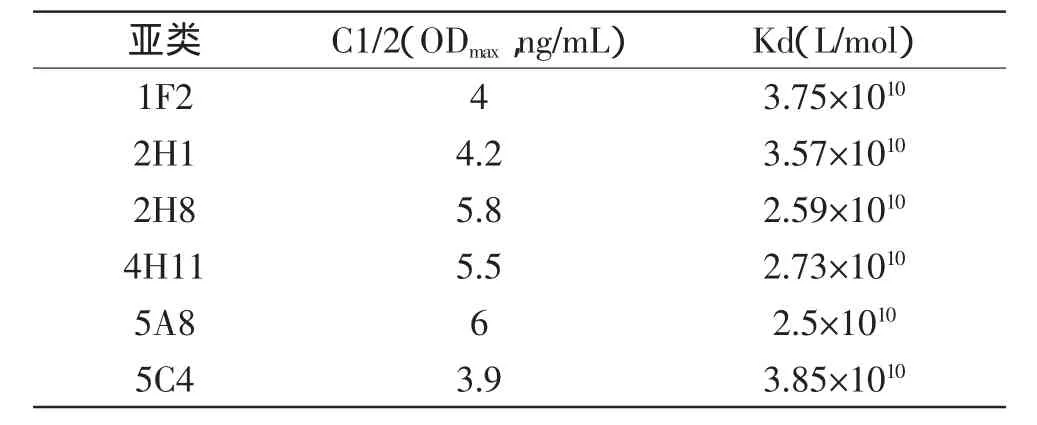
表4 克诺罗杆菌抗体亲和常数的测定Fig.4 Measurement of affinity constant bycompetitive
2.5 胶体金试纸条灵敏度及特异性测试
将克诺罗杆菌培养物梯度稀释后,用于计数和胶体金试纸条检测,以确定本方法的灵敏度。结果显示,试纸条检测灵敏度为105CFU/mL。结果显示,试纸条仅对克诺罗杆菌菌株检测为阳性,对其他细菌检测结果均为阴性。
3 讨论
针对食源性致病菌的检测,免疫学方法一直是必不可少的,具有高通量、快速简便、适合现场筛查使用等多项优势,ELISA、免疫磁珠、层析试纸条等技术已经成为目前的主流方向。常规的分离培养和生理生化检测,周期长,工作量大,不利于疾病爆发时准确、快速地溯源检测,但免疫学方法建立的基础是获得稳定、高效表达的抗体[15]。
本文采用克诺罗杆菌多株代表菌株DSM 18702、DSM 18705、NCTC 9529、ATCC 29544进行免疫,希望能获得覆盖面较广、特异性较好的单克隆抗体。在整个单克隆抗体制备的过程中,进行了多次细胞融合,多次筛选,工作量极大。实验获得了6株克诺罗杆菌的单克隆抗体。一株与多株阴性菌存在交叉反应,但同时也能与所有的克诺罗杆菌阳性菌株反应。将该细胞株建立优化后保藏,希望该细胞株反映的广泛性能够在后面的检测中获得运用。同时,实验挑选了5株能够和不同克诺罗杆菌标准株进行反应,并且具有良好特异性的单克隆抗体细胞株建株,这5株细胞株的结合能够完全覆盖克诺罗杆菌8株代表性标准菌株以及实验中所用的12株分离株。在Western检测抗体特异性的实验中,选择了部分克诺罗杆菌和阴性菌株的部分代表菌株,并将这些菌株放在同一张Western检测膜上,以减少实验条件带来的误差。本研究的目的是希望将制备获得的抗体用于最终的实际检测中,由于Western Blot是检测在变性状态下抗体结合的特异性,相比较而言,ELISA检测更能反映抗体天然状态下的特异性,因此本论文中多采用ELISA方法检测抗体特异性。
周鹤峰等以一株克诺罗杆菌作为免疫原免疫小鼠后筛选单克隆抗体,获得的抗体针对免疫的克诺罗杆菌特异性较好,但由于免疫原和筛选所用抗原的数量限制,没有检测该抗体对克诺罗杆菌属其他细菌的覆盖性[16]。在Igor Hoche等制备抗体的过程中,以ATCC 29544标准菌株作为抗原免疫新西兰白兔,检测免疫获得的多克隆抗体与13株克诺罗杆菌(克诺罗杆菌,其中标准菌株1株,即ATCC29544,其余为分离菌株)的交叉反应性,结果发现仅对作为免疫原的ATCC 29544和另一株分离株CNCTC Eb 34/87呈现阳性反应,而对其他的克诺罗杆菌反应均为阴性[17]。
克诺罗杆菌个别菌株免疫获得的IgGs具有血清型特异性,与其他的克诺罗杆菌菌株不能反应,表明克诺罗杆菌菌株间抗原差异较大,制备的抗血清通用性较差。要解决这个问题可以采用多种特异性抗体组合应用的鸡尾酒法,鸡尾酒法可以抑制检测中的交叉反应和非特异性结合,但这一方式又增加了检测优化的难度。
另一方面来说,血清型特异性的抗体可以作为克诺罗杆菌血清学分型的有效工具。血清学分型是使用较为广泛的一种分型方式,即制备一系列特异的抗血清,分别将它们与待测菌株进行凝集反应,不同菌株带有的不同表面抗原,会与不同的血清发生凝集,根据凝集结果进行分型。常用到的表面抗原有K抗原(荚膜抗原)、O抗原(菌体抗原)及H抗原(鞭毛抗原)。大多数肠杆菌科致病菌的抗原都是关键的致病因子,所以血清学分型在肠杆菌科中应用广泛。
4 结论
本研究选择克诺罗杆菌8株标准菌株中的DSM 18702、DSM 18705、NCTC 9529、ATCC 29544菌株分别进行免疫,成功制备了针对克诺罗杆菌的多株单克隆抗体,6株单克隆抗体1F2、5C4、2H8、5A8、4H11、2H1的Ig亚类分别为IgG3、IgG2b、IgG3、IgG1、IgG3、IgG1。多种单抗采用“鸡尾酒法”联合运用能够完全覆盖作为阳性对照的20株克诺罗杆菌。采用抗体亚类试剂盒测定结果表明,间接ELISA法测定本研究中的6株mAb的相对亲和常数均大于1.0×1010L/mol,显示制备的单抗与克诺罗杆菌的亲和力较高。将克诺罗杆菌抗体应用于胶体金试纸条的制备,试纸条检测灵敏度为105CFU/mL,且试纸条仅对克诺罗杆菌菌株检测为阳性,对其他细菌检测结果均为阴性。利用单克隆抗体建立了抗原包被间接ELISA(ACP-ELISA)检测阪崎肠杆菌的方法。为进一步研制检测阪崎肠杆菌的胶体金免疫试纸条,建立快速的检测方法创造条件。
[1]Carol Iversen,Angelika Lehner,Niall Mullane,et al.The taxonomy of Enterobacter sakazakii:proposal of a new genus Cronobacter gen.nov.and descriptions of Cronobacter sakazakii comb.nov.Cronobacter sakazakii sub sp.sakazakii,comb.nov.,Cronobactersakazakiisub sp.malonaticussub sp.nov.,Cronobacter turicensis sp.nov.,Cronobacter muytjensii sp.nov.,Cronobacter dublinensis sp.nov.and Cronobacter genomospecies 1[J].BMC Evolutionary Biology,2007(7):64-75.
[2]CarolIversen,NiallMullane,Barbara McCardell,etal.Cronobacter gen.nov.,a new genus to accommodate the biogroups of Enterobacter sakazakii,and proposal of Cronobacter sakazakii gen.nov.,comb.nov.,Cronobacter malonaticus sp.nov.,Cronobacter turicensis sp.nov.,Cronobacter muytjensii sp.nov.,Cronobacter dublinensis sp.nov.,Cronobacter genomospecies 1,and of three subspecies,Cronobacter dublinensis sub sp.dublinensis sub sp.nov.,Cronobacter dublinensis sub sp.lausannensis sub sp.nov.and Cronobacter dublinensis sub sp.lactaridi sub sp.nov[J].International Journal of Systematic and Evolutionary Microbiology,2008,58:1442-1447.
[3]Carol Iversen,Angelika Lehner,Niall Mullane,et al.Identification of“Cronobacter”spp.(Enterobacter sakazakii)[J].Journal of Clinical Microbiology,2007,45(11):3814-3816.
[4]Joseph S,Forsythe S J.Predominance of Cronobacter sakazakii sequence type 4 in neonatal infections[J].Emerg Infect Dis,2011(17):1713-1715.
[5]Mullane N,O’Gaora P,Nally J E,et al.Molecular analysis of the Enterobacter sakazakii O-antigen gene locus[J].Appl Environ Microbiol,2008,74(12):3783-3794.
[6]Farmer JJ III,Asbury MA,Hickman FW,et al.Enterobacter sakazakii:a new species of“Enterobacteriaceae”isolated from clinical specimens[J].Int J Syst Bacteriol 30(3):569-584.
[7]Susan Joseph,Stephen J.Forsythe,Predominance of Cronobacter sakazakii Sequence Type 4 in Neonatal Infections[J].Emerg Infect Dis,2011,17(9):1713-1715.
[8]G I Dancer,J-H Mah,D-H Kang,Influences of milk components on biofilm formation of Cronobacter spp.(Enterobacter sakazakii)[J].Letters in Applied Microbiology,2009,48:718-725.
[9]Healy B,Cooney S,O’Brien S,et al.Cronobacter(Enterobacter sakazakii):an opportunistic foodborne pathogen[J].Foodborne Pathog Dis,2010,7(4):339-350.
[10]Eva Kucerova,Susan Joseph,Stephen Forsythe.The Cronobacter genus:ubiquity and diversity[J].Quality Assurance and Safety of Crops&Foods,2011,3(3):104-122.
[11]Enterobacter sakazakii(Cronobacter spp.)in powdered follow-up formulae http://www.who.int/foodsafety/publications/micro/MRA_follow up.pdf.
[12]Muygjens H L,Roelofs W H,Jaspar G H J.Quality of powdered substitutes for breast milk with regard to members of the family Enterobacteriaceae[J].Journal of Clinical Microbiology,1988,26:743-746.
[13]Nazarowec-White M,Farber J M.Incidence,survival,and growth of Enterobacter sakazakii ininfant formula[J].Journal of Food Protection,1997,60:226-230.
[14]潘蓓蕾,中国食品工业与科技蓝皮书[M].北京:中国食品学报出版社,2005.
[15]王报贵,武晓丽,董素琴,等.抗肠炎沙门氏菌单链抗体制备及其特异性分析[J].中国生物工程杂志,2013,33(5):62-67.
[16]周鹤峰,邵敏,于立强,等.阪崎肠杆菌单克隆抗体的制备与特性鉴定[J].中国免疫学杂志,2012,28(9):817-820.
[17]Igor Hoche,Jír,Characterisation of antibodies for the immunochemical detection of Enterobacter sakazakii[J].Czech J Food Sci,2009,27(2):S2-66-S2-74.
