补肾益气活血中药对大鼠缺血再灌注脑组织血管内皮生长因子表达和血脑屏障通透性的影响
2013-10-17赵凤玲孙佳红张宝兰张秀梅
赵凤玲 孙佳红 张宝兰 张秀梅
内蒙古医学院第四附属医院,内蒙古包头 014030
寻求脑梗死的治疗方法一直是世界医学的焦点。血管内皮生长因子(VEGF)是一类普遍存在于中枢神经系统的生长因子,又称为血管通透性因子,具有刺激血管内皮细胞增生、迁移,促进血管生成和增加血管通透性的作用[1]。VEGF直接作用于血管内皮细胞的有丝分裂原及内皮细胞上的受体,发挥其促血管再生的作用[2]。目前认为VEGF是最重要的成血管因子[3]。研究表明,VEGF是强效血管再生因子,VEGF可使血脑屏障(BBB)内皮细胞间紧密联接蛋白复合物的完整性破坏,从而引起BBB通透性增高,诱发脑水肿[4]。VEGF是主要的血管生成的调节介质和一个强血管通透性因子。VEGF能够开放BBB和介导脑水肿[5]。Davisa等[6]发现在VEGF表达后BBB有着明显的开放,并得出了VEGF是通过提高表达VEGFR-2而实现开放血脑屏障的结论。本实验研究旨在深入探讨脑缺血再灌注后VEGF表达的动态变化与BBB破坏的关系,为VEGF临床应用前景提供实验依据。
1 仪器与试药
1.1 试验动物
健康雄性Wistar大鼠80只,体重350~420 g,包头医学院实验动物部提供(符合国家清洁级动物标准)。
1.2 试药
血塞通注射液(昆明制药集团股份有限公司,批号:12FB17),脉络宁注射液(金陵药业股份有限公司南京金陵制药厂,批号:20111023),10%水合氯醛,生理盐水,4%多聚甲醛(PBS,0.1 mol,pH 7.4),甲酰胺,伊文思蓝(Evans blue,EB),试剂盒(武汉博士德公司提供)。
1.3 仪器
荧光分光光度仪(960型,上海光学仪三厂),单尼龙线,水浴箱,石蜡切片机,光学显微镜。
1.4 试验动物分组及模型制备
大鼠随机分为假手术组8只,生理盐水对照组36只(分别为缺血90 min再灌注1,3,7 d各12只)和中药组36只(分组同生理盐水对照组)。每小组中6只用于BBB通透性的测定,6只用于VEGF的检测。大脑中动脉闭塞再灌注模型制作参照koizumis线栓法[7]。10%水合氯醛(350 mg/kg)腹腔注射麻醉后,颈部切口,分离左侧的颈总动脉、颈内动脉、颈外动脉及其分支,结扎颈外动脉及其分支,在颈内动脉近端放线,远端放动脉夹,颈总动脉分叉处剪一小口,将直径0.25 mm单尼龙线经小口插入颈内动脉(18±1)mm。尼龙线外留15~20 mm,线栓成功后移除远端动脉夹;再灌注时只需将栓线抽出至颈内动脉起始部。模型成功的标准是:栓线即刻出现左侧Horner征,麻醉清醒后出现右前肢运动功能障碍。假手术组除栓线只插入0.5 cm左右外,余均同动物模型制备。中药组给药剂量按成人用量10 mL/60 kg,2次/d的10倍换算应为1.67 mL/kg,2次/d,腹腔注射。生理盐水组腹腔注射生理盐水1.67 mL/kg,2次/d。
1.5 行为学检查
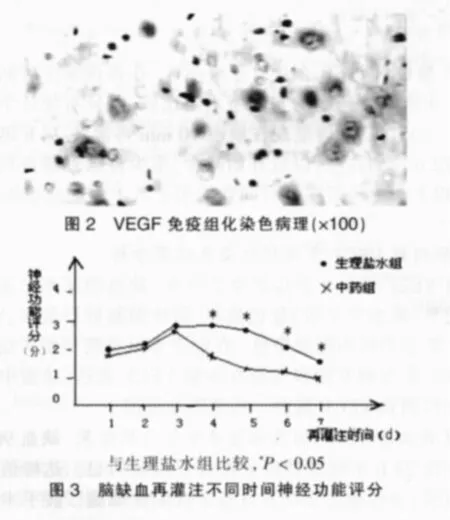
参照Bederson等[8]的评分方法对大鼠进行神经症状评分。无神经病学征象为0分;提尾时右侧前肢不能完全伸直为1分;向右侧旋转征象为2分;向右侧跌倒为3分;无自发活动及意识障碍者为4分。均于术后每日观察。
1.6 血脑屏障通透性的定量测定[9-10]
使用EB作为测量血脑屏障通透性的标踪剂,各小组内随机取6只动物在处死前2 h按20 mg/kg体重自尾静脉注入2%EB液。几秒钟后,大鼠眼球结膜,四肢等显示蓝色,表示注射成功。在预定的时间内用250 mL生理盐水进行心脏灌注,迅速取左半球称重后机械性粉碎脑组织标本,按每100 mg湿脑组织加3 mL甲酰胺加盖避光,在37℃水浴箱中提取72 h,提取液在荧光分光光度仪上测定荧光强度,激发波长624 nm,发射波长683 nm,波宽为10 nm。用倍比稀释法制作EB标准曲线计算出线性回归方程,再根据线性回归方程计算出提取液中EB的浓度,最后求得脑组织EB的含量,以μg/g湿脑组织表示。
1.7 VEGF表达检测
到达各再灌注时间点后迅速以10%水合氯醛麻醉各组大鼠(每组中剩余的6只),经左心室用生理盐水冲洗,用 4%多聚甲醛(PBS,0.1 mol,pH 7.4)灌注固定脑组织,将脑组织浸于相同固定液中48 h。取视交叉平面作为观察平面。石蜡包埋,以石蜡切片机切成4 μm厚的连续冠状切片。每张切片分别计数高倍镜下缺血区5个视野里阳性细胞数,取其均值为该张切片每高倍视野下阳性细胞数。VEGF免疫组织化学染色采用SABC法,按试剂盒操作说明书进行。
1.8 脑组织病理学检查
从各组织中随机选取与用于免疫组化的切片相邻的4张连续切片进行常规HE染色,在光镜下观察其组织形态学变化特点。
1.9 统计学方法
采用统计软件SPSS 13.0对实验数据进行分析,计量资料数据以均数±标准差(±s)表示,采用方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 脑组织血脑屏障的变化
2.1.1 肉眼观察 假手术组左侧半球未见蓝染;生理盐水组和药物组左侧半球(MCAO侧)均有以大脑中动脉为圆心的蓝染,药物组蓝染区颜色较淡。见表1。
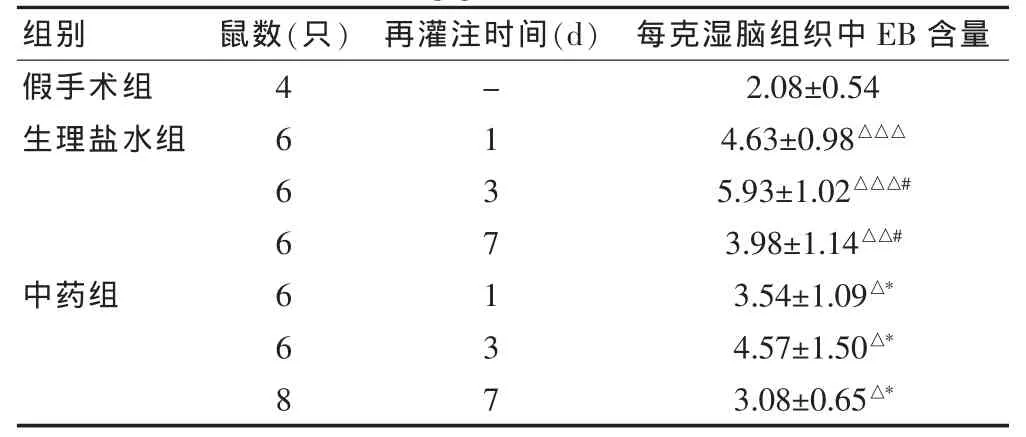
表1 大鼠脑组织不同再灌注时间脑组织EB含量分析结果(μg/g湿脑组织)
2.1.2 脑组织中EB含量的检测分析 在各再灌注时间点生理盐水组和中药组均与假手术组比较,差异有统计学意义(P<0.05),二者均呈现在缺血90 min再灌注24 h迅速升高,72 h达到高峰,以后开始减少,至少持续到缺血再灌注7 d以上。中药组在各时间点均明显低于生理盐水组(P<0.05)。
2.2 脑组织VEGF免疫组化染色结果分析
2.2.1 VEGF蛋白在脑组织中的分布 缺血侧坏死与正常组织交界(缺血半暗带)显色最深,阳性细胞数目最多;VEGF阳性细胞为核周胞浆染色。在假手术组及模型组各组大鼠脑组织在双侧室管膜均存在少量VEGF表达,缺血中心区未能检测到VEGF蛋白。病理图片见图1。
2.2.2 缺血区VEGF阳性细胞半定量分析结果 缺血90 min再灌注24 h半暗带神经元阳性反应最明显。达峰值后迅速减少,至再灌注3~7 d只有少数阳性细胞。假手术组皮层未能检测到VEGF蛋白阳性细胞。见表2。
2.2.3 中药对VEGF蛋白表达的影响 中药在再灌注1~7 d对VEGF蛋白的表达没有影响(P>0.05)。
2.3 病理学观察
组织病理学研究显示:MCA区呈典型的脑缺血后坏死改变,以尾壳核外侧部分损害最重,其次是背外侧皮层,神经元呈缺血性改变,胞体缩小胞核固缩,数量减少。胶质细胞反应性增生和少量白细胞渗出。毛细血管扩张明显,内皮细胞肿胀。病理图片见图1。
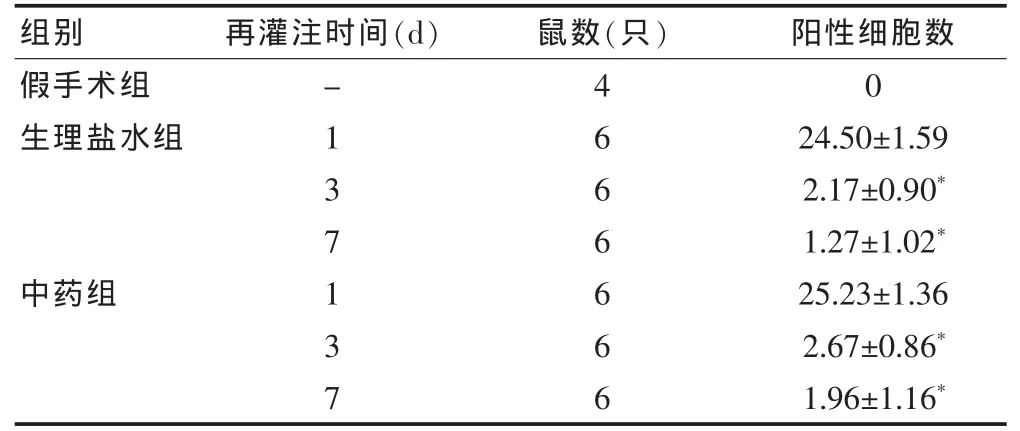
表2 大鼠脑组织不同再灌注时间缺血区免疫组化分析结果(个/高倍视野,×400)

2.4 症状变化
栓线即刻出现左侧Horner综合征,麻醉清醒后出现右前肢瘫痪。模型组动物偏瘫症状评分均为在缺血再灌注3 d后趋于稳定,逐渐降低。中药组在3 d后较生理盐水组评分降低(P<0.005)。 见图2。
3 讨论
本实验显示脑缺血再灌注后血脑屏障破坏为一动态变化过程,在缺血再灌注1 d脑组织EB含量已明显升高(P < 0.001),72 h达高峰(与 1 d比较,P < 0.05),这与临床上大面积脑梗死病情多在3 d内恶化相一致。因为血脑屏障破坏导致血管源性脑水肿,脑水肿加重是缺血性脑损伤病情恶化最主要的危险因素。故对能引起血脑屏障破坏的因素进行深入讨论进而实施有针对性的治疗成为缺血性脑血管疾病研究的热点。
近年有关VEGF在缺血性脑组织中的表达调节及作用机制的研究迅速增多。VEGF在缺血性损伤后脑组织功能的保护和修复中的作用逐渐引起了人们的注意并已取得积极的研究进展,许多实验结果证实VEGF在抗脑缺血损伤中起着非常重要的作用。VEGF是一种内皮细胞特异的有丝分裂原,可以刺激体内尤其是缺血部位的血管形成[11]。目前认为,缺氧是VEGF/VEGFR表达的最主要的调节因素[12]。缺血、缺氧时,VEGF表达明显增加,尤以脑组织中VEGF表达升高明显。在脑缺血后的“缺血半暗带”低氧区,低氧激活低氧诱导因子后促使VEGF及其受体VEGFR-1和VEGFR-2的表达,引起血管反应,以血管内皮细胞增殖和新血管形成为特征,刺激缺氧组织建立有效的侧支循环并恢复内皮细胞的完整性,发挥搭桥作用,诱导新生血管形成,并使新生血管从正常组织向半暗带及缺血中心区延伸,增加受累脑组织再灌注及供氧量,从而减轻脑缺血再灌注损伤[13]。但是VEGF可增加血管通透性,促使病变组织微血管内血浆外渗,尤其对皮肤微血管通透性影响最明显。国外已有少数研究涉及VEGF在卒中后脑水肿形成中的作用,但结果不尽一致。本实验动态观察了MCA闭塞后再灌注不同时间点BBB破坏和VEGF表达的动态变化,显示脑组织EB含量在24 h升高明显,72 h达高峰,其后逐渐回落。而VEGF在24 h达高峰,其后迅速下降,72 h已回落接近正常。从二者动态变化的时程上看BBB破坏并不是VEGF表达的结果。另外实验结果还显示:补肾益气活血中药能够降低各再灌注时间点大鼠脑组织EB含量,维护血脑屏障,减轻神经功能缺损症状,但对VEGF蛋白表达没有影响,故从这两方面实验结果说明VEGF不是BBB结构和功能破坏的重要介质,VEGF未加重卒中后血管源性脑水肿。这为应用外源性VEGF蛋白或基因治疗缺血性脑损伤提供了实验依据。中药组大鼠的肢体活动改善在3 d后较生理盐水组进步,证明中药正是通过改善BBB的功能,减轻血管源性脑水肿,进而使肢体功能改善成为可能。应用中医中药治疗缺血性脑损伤是我国神经科学工作者探索的一个方向,中药作用的多途径性似乎与缺血性脑损伤病理变化的多样性具有针对性效应,补肾益气活血中药在一定程度上能够减轻BBB的破坏,临床上可以安全使用,其BBB开放的机制及与其他促血管生成因子的关系仍需进一步探讨。
[1]徐双云,徐家丽.血管内皮细胞生长因子在缺氧缺血性脑损伤中的神经保护作用[J].国际儿科学杂志,2009,36(3):290-292.
[2]李雪梅,牛文泽,陈翔.芹菜素对大鼠脑缺血再灌注后VEGF表达的影响及意义[J].中国病理生理杂志,2010,26(12):2473-2477.
[3]孙国栋,岳永花,李先荣,等.芪蛭通络胶囊辅助阿司匹林对脑缺血再灌注损伤大鼠的影响[J].中国实验方剂学杂志,2010,16(17):202-210.
[4]邓志宽,钱桂生,程赛宇,等.siRNA沉默脑组织血管内皮生长因子表达对高原大鼠血脑屏障通透性的影响[J].中华医学杂志,2009,89(37):2640-2643.
[5]田子健,杨楠,杨蕾琪.缺血再灌注后血脑屏障通透性改变的研究进展[J].中国医药指南,2011,9(23):222-223.
[6]Davisa B,Tang J,Zhang L,et al.Ferriero Role of vasodilator stimulated phosphoprotein in VEGF induced blood-brainbarrier permeability in endothelial cell monolayers [J].Int J Devl Neurosci,2010,28(6):423-428.
[7]Nagasawa H,Kogure K.Correlation between cerebral blood and histologic changes in a new rat model of cerebral artery occlusion[J].Stroke,1989,20:1037.
[8]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17:472.
[9]Drummond JC,Patel PM,Cole DT,et al.The effect of the reduction of colloid oncotic pressure,with and without reduction of osmolality,on post-traumatic cerebral edema[J].Auesthesiology,1998,88(4):993-1002.
[10]Kawai N,Kawanishi M,Okauchi M,et al.Effects of hypothermia on thronrbin-induced brain edema formation [J].Brain Res,2001,895(1-2):50-58.
[11]韩为,王颖,程红亮,等.针刺涌泉、重灸百会对局灶性脑缺血大鼠VEGF 表达的影响[J].上海针灸杂志,2009,28(9):554-557.
[12]Kiselyov A,Balakin KV,Tkachenko SE.VEGF/VEGFR signaling as a target for inhibiting angiogenesis[J].Expert Opin Investing Drugs,2007,16(1):83-107.
[13]李逸尘,姜信诚,景玉宏,等.大鼠脑缺血再灌注后海马CA1区血管内皮细胞生长因子与突触素的关系[J].兰州大学学报:医学版,2010,36(1):9-12.
