丙型肝炎病毒高变区1模拟表位7肽对LPS刺激RAW264.7细胞炎症因子影响的研究
2013-10-17迟淑萍张诗龙陈红鸽由莉越
迟淑萍 张诗龙 陈红鸽 刘 军 孙 杰 由莉越 杜 丽 程 云
解放军第三〇二医院药学部研究室,北京 100039
内毒素/脂多糖(lipopolysaccharides,LPS)是革兰阴性菌(G-)细胞壁的活性组分。RAW264.7细胞是小鼠腹腔巨噬细胞株,它被广泛应用于体外实验,用LPS诱导细胞则能引起类似于脓毒血症等的炎症反应。促炎细胞主要是指活化的巨噬细胞,它们在炎症的过程中能够产生大量细胞因子和促炎分子,内毒素血症与肝损害可互为因果,从而对肝病的发生发展及预后产生重要影响[1]。目前,国内外针对HCV高变区1(HVR1)设计了各种模拟表位及疫苗[2],本课题组前期工作已经根据HCVⅡ/1b和Ⅲ/2a高变区1(hyper variable region 1,HVR1)序列变异的规律[3-4],经过计算机模建的分析,设计、合成了十二条多肽表位,检测了其与HCV感染者的血清以及外周血液淋巴细胞交叉反应性[5],并基于这些多肽表位与HCV感染者的血清的反应性[6],课题组选择了其中最好活性的含有7个氨基酸片段的一条短肽(简称7P),在小鼠及体外进行了一系列的研究[7-9]以及HCV感染患者抗病毒、免疫应答、单克隆抗体制备等的研究[10-14],鉴于上述研究,本实验进一步在细胞炎症模型水平上观察7P在体外和小鼠RAW264.7细胞共同孵育,研究7P对LPS诱导的小鼠RAW264.7细胞分泌炎症细胞因子的影响,观察7P是否对LPS攻击细胞具有保护作用,以期为其在炎症反应引起肝脏组织严重损伤中具有保护作用提供实验的数据,旨为进一步研究其抗炎作用机制提供基础。
1 仪器与试药
1.1 仪器
MR1882型高速冷冻离心机(法国);ZS-3型酶标仪(北京市新风机电技术公司);MCO-15AC型二氧化碳孵箱(SANYO,日本);THZ-82气浴恒温振荡器(江苏金坛市金城国胜实验仪器厂)。
1.2 试药
1.2.1 7 P的合成 根据其丙型肝炎病毒(HCV)E2胞膜蛋白中的高度可变区1(HVR1)七个氨基酸的位点(383 GQTYTSG 389)设计,合成之7P经过高效液相色谱(HPLC)进行其纯度鉴定,纯度均为≥98.9%,符合了实验要求,批号:20100101,使用之前用生理氯化钠溶解成所需使用浓度。
1.2.2 LPS 规格:10 mg,批号:L2880,Sigma 公司;小鼠肿瘤坏死因子、白介素-6酶联免疫试剂盒(TNF-α、IL-6 ELISA KIT)上海依科赛生物制品有限公司;单溶液细胞增殖检测(MTS)试剂盒美国promega公司;胎牛血清:杭州四季青生物工程有限公司。
1.3 细胞株
小鼠巨噬细胞系RAW264.7细胞,购自北京协和医院基础研究所细胞中心细胞库。
2 方法与结果
2.1 方法
2.1.1 培养与传代RAW264.7细胞 小鼠巨噬细胞RAW246.7加入含有10%胎牛血清的RMPI-1640培养基,使用时加入1%双抗(100 U/mL青霉素、100 U/mL链霉素)后置于5%CO2、37℃培养箱中培养生长。待细胞生长至70%~80%融合后即可进行传代,根据生长情况2 d可换液1次,3~5 d传代一次。
2.1.2 去热源处理细胞实验用品及试剂[15]实验需用的刻度离心管、移液管、吸管等等玻璃器材均要经过250℃的高温1.5~3 h作去热原处理,培养板、其他塑料器材均要通过辐照去热原,试剂配制均使用超纯水来代替双蒸水,严格遵循无热原处理原则,以排除实验过程中可能存在的内毒素污染。
2.1.3 7 P对RAW264.7细胞细胞因子释放的影响 调整细胞悬液密度为1×105/mL,分别加入7P终浓度为5~160 μg/mL(5.0、10.0、20.0、40.0、80.0、160.0 μg/mL),置于温度 37℃摇速100 r/min的摇床内,共孵育1 h。取每管0.5 mL加于24孔板内,置37℃、5%CO2温箱培养6 h,每孔取出培养上清,1 000 r/min,离心10 min后吸取上清用于测定TNF-α和IL-6,每组均设立3个复孔,所有上清均需放置-80℃冰箱保存待测。以酶联免疫吸附(ELISA)法检测TNF-α及IL-6的含量操作严格按照试剂盒说明书要求进行,于酶联仪450 nm处测定TNF-α及IL-6光密度值(A450)值。
2.1.4 7 P对LPS刺激RAW246.7细胞细胞因子释放的影响 见“2.1.3”项下方法,即加入7P后共孵育1 h,再加入终浓度为0.1 μg/mL LPS,置于37℃培养箱继续培养6 h,每孔取出培养上清,离心后吸取上清,用于测定TNF-α和IL-6。以酶联免疫吸附(ELISA)法检测TNF-α及IL-6的含量,严格按照试剂盒说明书要求操作,于酶联仪450 nm处测定TNF-α及IL-6光密度值(A450)值。
2.1.5 单溶液细胞增殖(MTS)法检测7P对细胞活力的影响调整细胞悬液浓度为5×104/mL,实验组加入7P终浓度为5~160 μg/mL(5.0、10.0、20.0、40.0、80.0、160.0 μg/mL),对照组加入等体积生理氯化钠,置摇床上37℃低速振荡,共孵育1 h。取出按每孔100 μL接种于96孔细胞培养板内,每组均设8复孔,取平均值。培养板放置于37℃、5%CO2培养箱,培养24 h后,每孔再加入20 μL的单溶液细胞增殖液,继续再培养4 h,于酶联仪上测定490 nm处光密度值(A490)OD 值。
2.1.6 统计学方法 应用SPSS 12.0软件对数据进行统计处理。计量资料数据以均数±标准差(±s)表示,采用方差分析,两两比较采用LSD-t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
表1 7P对LPS刺激和未刺激RAW264.7细胞释放细胞因子TNF-α和IL-6的影响(±s,ng/L)
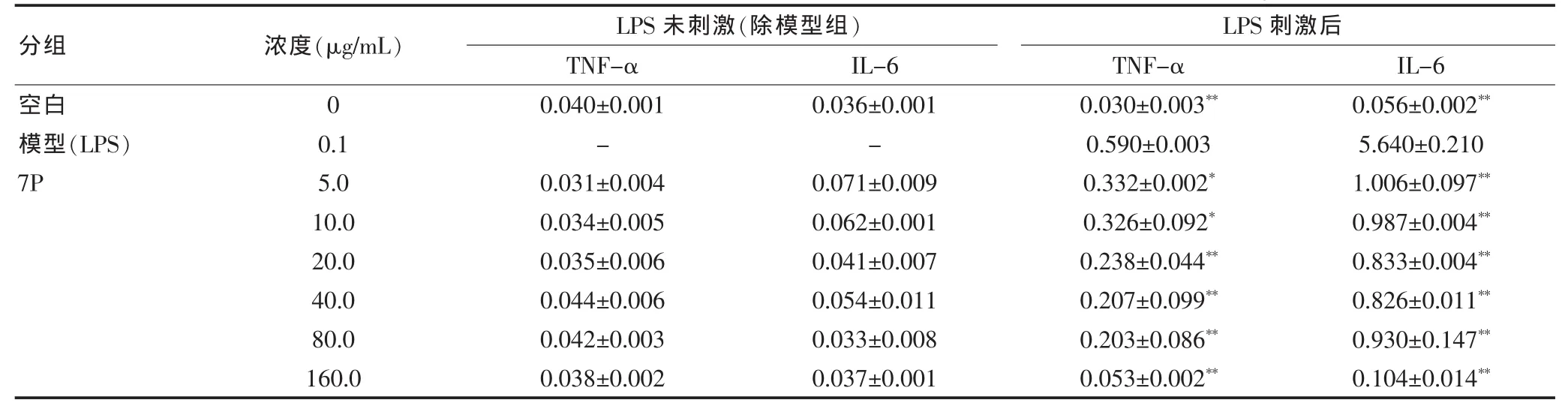
表1 7P对LPS刺激和未刺激RAW264.7细胞释放细胞因子TNF-α和IL-6的影响(±s,ng/L)
注:与模型组比较,*P < 0.05,**P < 0.01;“-”表示无数据
分组 浓度(μg/mL)LPS未刺激(除模型组)TNF-α IL-6 LPS刺激后TNF-α IL-6空白模型(LPS)7P 0 0.1 5.0 10.0 20.0 40.0 80.0 160.0 0.040±0.001-0.031±0.004 0.034±0.005 0.035±0.006 0.044±0.006 0.042±0.003 0.038±0.002 0.036±0.001-0.071±0.009 0.062±0.001 0.041±0.007 0.054±0.011 0.033±0.008 0.037±0.001 0.030±0.003**0.590±0.003 0.332±0.002*0.326±0.092*0.238±0.044**0.207±0.099**0.203±0.086**0.053±0.002**0.056±0.002**5.640±0.210 1.006±0.097**0.987±0.004**0.833±0.004**0.826±0.011**0.930±0.147**0.104±0.014**
2.2 结果
2.2.1 7 P对RAW264.7细胞细胞因子释放的影响 为考虑排除7P对RAW264.7细胞正常释放细胞因子可能引起的直接作用,课题组检测了不同浓度的7P对RAW264.7细胞细胞因子释放的影响。其结果表明:未加7P的细胞上清孔中的 TNF-α 和 IL-6浓度分别为(0.040±0.001)和(0.036±0.001)ng/L,而加入了不同浓度的(5.0、10.0、20.0、40.0、80.0、160.0 μL/mL)7P 之后,其细胞上清中的 TNF-α和IL-6的浓度与正常细胞的细胞因子差异无统计学意义(P>0.05),这就说明了7P对RAW264.7释放细胞因子TNF-α和IL-6均不存在直接的影响,见表1。
2.2.2 7 P对LPS刺激RAW246.7细胞细胞因子释放的影响 RAW264.7细胞上清正常分泌的TNF-α及IL-6的含量较低,而给予 LPS(0.1 μg/mL)刺激后,TNF-α 及 IL-6 的含量都显著增加,提前1 h用5~160 μg/mL 7P预处理细胞后,TNF-α及IL-6的释放均受到不同程度抑制,且又呈现剂量依赖关系,见表1。
2.2.3 7 P对RAW246.7细胞活力的影响 为了明确7P抑制细胞因子释放作用是否与其细胞毒的作用有关,笔者检测了7P对RAW264.7细胞细胞活力的影响。结果显示,7P在 5.0、10.0、20.0、40.0、80.0、160.0 μg/mL 浓度刺激下其活力差异均无统计学意义(P>0.05),说明7P对RAW246.7细胞均无损伤作用,见表2。
3 讨论
脂多糖(LPS)可以激活单核-巨噬细胞﹑内皮细胞合成和释放多种细胞因子,当LPS与其细胞膜上的相应受体作用之后启动了细胞内信号传导系统,通过激活了单核转录因子-κB(nuclearfactor-κ,NF-κB) 等引起肿瘤坏死因子-α(tumornecrosisfactor,TNF-α)﹑白细胞介素-6(intorlenkin,IL-6)和一氧化氮(nitricoxide)等多种细胞因子和炎症介子的表达和释放,很多研究表明,LPS是诱导和产生炎症介质最有效的刺激物,其中单核巨噬细胞则是产生多种炎症介质最主要的细胞之一[16]。内毒素可以引起各种细胞因子和炎症介质的过度表达进而触发机体内的炎症瀑布式的连锁反应,进一步引起全身炎症反应综合征[15],据国外大部分实验室报道,浓度在10 ng/mL的内毒素即可诱导人免疫细胞释放细胞因子[17],而本研究参照其他的实验室对去热原的处理经验,依据大量的实验探究与摸索,排除了可能的内毒素污染,最终选择了LPS为0.1 μg/mL为刺激浓度刺激细胞。
表2 7P对RAW264.7细胞活力的影响(±s)
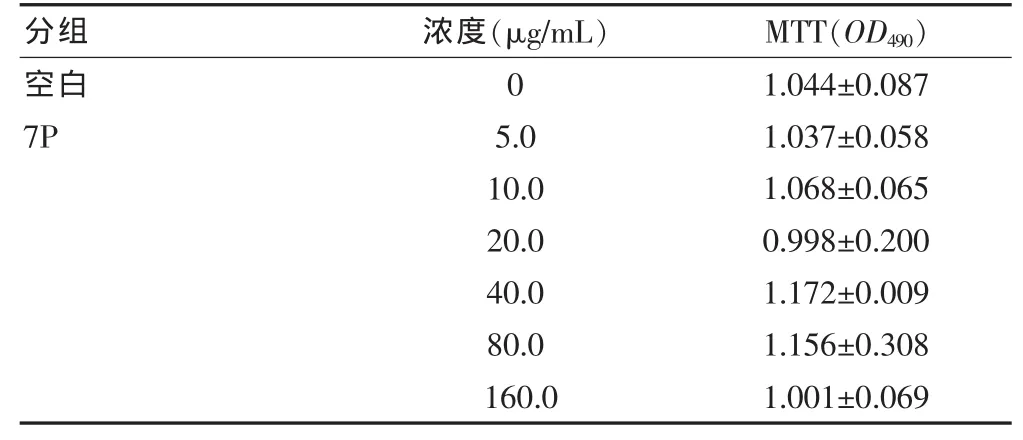
表2 7P对RAW264.7细胞活力的影响(±s)
分组 浓度(μg/mL) MTT(OD490)空白7P 0 5.0 10.0 20.0 40.0 80.0 160.0 1.044±0.087 1.037±0.058 1.068±0.065 0.998±0.200 1.172±0.009 1.156±0.308 1.001±0.069
TNF-α和IL–6两个因子是最重要的参与炎症反应的细胞因子,其在脓毒症过程中发挥着极为重要的作用,因此选择这两个细胞因子作为实验指标,观察7P对LPS刺激细胞释放炎症因子的影响。研究结果显示7P能抑制LPS诱导AW264.7细胞释放致炎细胞因子TNF-α和IL-6,能够对LPS攻击细胞具有一定保护作用,以避免过激的免疫及缓解炎症反应,这为7P是否对LPS攻击小鼠产生脓毒症也具有保护作用提供了实验数据,探究发炎反应的真正过程亦将成为研究的重要目标。7P对LPS促发其他的炎症因子例如COX-2以及炎症抑制因子IL-10等有否作用尚有待进一步实验证实。实验研究提示通过对活化的巨噬细胞功能的调节(促进或抑制),从而调控免疫功能很可能是一条有效的抗炎药物发现的新途径。为其开发成为免疫调节及抗炎药物提供依据,并有待进一步的研究。
[1]李丽,刘东阳,江骥,等.灯盏乙素药理学研究进展[J].中草药,2006,37(8):171-173.
[2]Mucha B,Ozaltin F,Hinkes BG,et al.Mutations in the Wilms’tumor 1 gene cause isolated steroid resistant nephrotic syndrome and occur in exons 8 and 9[J].Pediatr Res,2006,59(2):325.
[3]赵军,程云,陈菊梅,等.对中国人群中Ⅲ/2a型HCV高变区1序列变异规律的横断研究 [J].细胞与分子免疫学杂志,2000,16(4):302-305.
[4]赵军,程云,苏琴,等.20例中国人HCVⅡ/1b型高变区1序列变异的动态观察[J].中华微生物和免疫学杂志,2000,20(6):507-511.
[5]赵军,李靖,陈昊,等.HCV高变区1串联模拟表位基因免疫研究[J].第三军医大学学报,2004,26(24):2254-2257.
[6]Eckels DD,Flomenberg P,Gill1 Hepatitis C virus:models of immun opathogenesis and p rophylaxis[J].Transfusion,1996,36:836-844.
[7]宋春辉,杨斌,程云,等.模拟HCVHVR1免疫7肽对免疫细胞分泌细胞因子的影响[J].解放军医学杂志,2009,34(11):1333-1339.
[8]迟淑萍,李靖,高蓉,等.丙型肝炎高变区1合成肽体外刺激HCV感染PBMC细胞因子分泌的研究[J].中华实验和临床病毒学杂志,2005,19(3):279-281.
[9]迟淑萍,汪辰,汪力亚,等.丙型肝炎高变区1合成肽对免疫小鼠脾淋巴细胞增殖作用的研究[J].解放军医学杂志,2010,35(5)541-542.
[10]宋春辉,杨斌,陈黎明,等.HCV感染患者免疫细胞部分细胞因子分泌情况的初步研究[J].胃肠病学和肝病学杂志,2009,18(9):846-848.
[11]赵志海,迟淑萍,邱淑媛,等.丙型肝炎病毒慢性感染者血清Th1-Th2相关细胞因子的检测及动态变化[J].临床肝胆病杂志,2010,26(1):30-32.
[12]孙杰,戚扬,迟淑萍,等.抗HCVHVRI模拟合成肽单克隆抗体的制备及特性鉴定[J].细胞与分子免疫学杂志,2011,27(5):542-544.
[13]杨斌,宋春辉,迟淑萍,等.HCVHVR1模拟肽诱导小鼠骨髓树突状细胞免疫应答机制的初步研究[J].实用肝脏病杂志,2011,14(1):7-10.
[14]杨斌,宋春辉,迟淑萍,等.HCV包膜蛋白E2高变区1模拟肽诱导小鼠树突状细胞免疫反应机制的实验研究[J].军医进修学院学报,2011,32(4):363-365.
[15]姜鲜,章卓,李晓冰,等.积雪草苷对LPS刺激RAW264.7细胞炎症因子的影响[J].中药药理与临床,2008,24(1):23-25.
[16]李小琼,金微,陶凤,等.脂多糖诱导小鼠腹腔巨噬细胞TNF-amRNA,iNOSmRNA 的表达[J].遵义医学 院学 报,2009,32(5):445-447.
[17]Manimtim WM,Hasday JD,Hester L,et al.Ureap lasma urealyticummodulates endotoxin2induced cytokine release by human monocytes derivedfrom p reterm and term newborns and adults[J].Infect Immun,2001,69(6)∶3906-3915.
