锌离子影响地中海拟无枝酸菌合成有机酸和利福霉素SV
2013-09-22邓鹏飞李长军黄亚男
邓鹏飞,周 峰,李长军,陈 雄,黄亚男,王 志*
(1.湖北工业大学,湖北 武汉 430068;2.河南省南街村(集团)有限公司,河南 临颍 462600)
利福霉素SV是由一个萘醌发色团和脂肪链桥组成的[1]。萘醌发色团的主要成分是3-氨基-5-羟基苯甲酸(即AHBA),由合成芳香族氨基酸的莽草酸途径的平行途径合成[2];AHBA为利福霉素芳香发色基团的直接前体[3-4],因而,芳香氨基酸可协同抑制AHBA的生物合成[5]。脂肪链桥部分由8个甲基丙二酰-CoA单位和2个丙二酰-CoA单位在I型聚酮合成酶(PKS)的作用下连续缩合延伸而成[6]。焦瑞身等[7]报道:利福霉素的氨同化途径主要包含丙氨酸脱氢酶(ADH)、谷氨酰胺合成酶(GS)和谷氨酸合成酶(GOG TA),ADH在A.mediterraneiU32中的活力与利福霉素的生物合成具有负相关性,而且(GS)/(ADH)酶活性比值增大与利福霉素SV产量有正相关性。GS和ADH受到氨浓度的调节,高浓度氨有利于ADH催化活性增强,而低浓度氨时GS催化活性增强。这种相关性表明,GS不仅是同化氨的重要酶,而且在利福霉素生物合成过程中起着关键作用[8]。
基于此分析,若能提高GS的活性或者抑制ADH的积累,从而提高(GS)/(ADH)比值,可能会使代谢朝着有利于利福霉素SV合成的方向进行。工业发酵微生物在生长繁殖和产物合成中都需要微量金属元素作为酶的组成部分或作为酶的活性调节剂[9]。有文献报道,丙氨酸脱氢酶可被锌离子所抑制[10]。因此,本研究讨论了Zn2+对地中海拟无枝酸菌生物合成有机酸和利福霉素SV的影响,根据发酵过程中有机酸和氨基酸的变化,探讨了Zn2+影响利福霉素SV合成的机理。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种来源
地中海拟无枝酸菌(Amycolatopsis mediterranei)U-32由河南省南街村(集团)有限公司技术中心提供。
1.1.2 培养基
种子培养基:葡萄糖1.5%,黄豆饼粉1%,蛋白胨2%,CaCO30.2%,KNO30.05%。115℃、20min条件下蒸汽灭菌,备用。
发酵培养基:葡萄糖6.0%,磷酸二氢钾0.02%,黄豆饼粉1.5%,碳酸钙0.5%,蛋白胨2%,KNO30.8%。120℃、20min条件下蒸汽灭菌,备用。
1.2 方法
1.2.1 培养方法
种子培养:
一级种子:从试管斜面上挖块0.5cm×2cm大小菌落接种于三角瓶(50mL/250mL)种子培养基中,在摇床上培养48h,培养条件为28℃、220r/min。
二级种子:将培养好的一级种子取3mL接种于三角瓶50mL/250mL)种子培养基中,培养条件为28℃、220r/min,在摇床上培养48h后合瓶备用。
摇瓶发酵培养:将以上培养好的二级种子液都以3mL接种于三角瓶(50mL/250mL)发酵培养基,在摇床上培养141h后放瓶,培养条件为28℃、220r/min。
10L发酵罐培养:计料体积6L,二级种子接种量6%。培养条件为28℃、220r/min,空气流量为0.5m3/h,培养141h后放罐。
1.2.2 效价测定方法
按照参考文献[11]进行。
1.2.3 氨基酸的检测
衍生化气相色谱法,以乙酸苯乙酯为内标,操作参考文献进行[12-13]。
2 结果与分析
2.1 摇瓶培养添加锌离子对利福霉素SV效价的影响
由图1可知,锌离子在低浓度时,随着浓度的增加,利福霉素SV的产量不断提高,0.75mg/L时达到最大,此时的效价比对照增加了4.3%;而当锌离子加量超过0.75mg/L时,利福霉素SV的产量增加甚微,可能是高浓度的锌离子对菌体产生了毒性。
2.2 10L罐培养添加0.75mg/L锌离子对利福霉素SV合成和pH值的影响

图1 锌离子浓度对利福霉素SV效价的影响Fig.1 Effect of Zn2+addition on rifamycin SV in shake flasks
10L罐培养中基料添加0.75mg/L锌离子对利福霉素SV合成和pH值的影响见图2。发酵过程中的pH值趋势与对照相似,总体上添加组pH值比对照低0.40%~1.60%,说明其氨基酸和有机酸代谢可能存在差异。另外,72h前利福霉素SV效价的增长与对照相似,96h时利福霉素SV的产量提高了11.72%,120h时效价提高了9.1%,但141h时仅提高了3.5%。
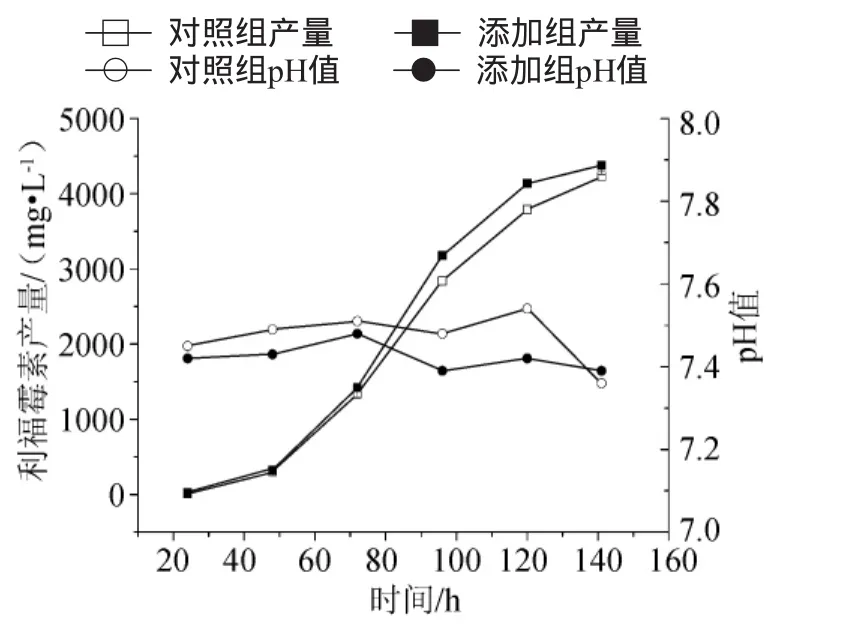
图2 10L罐培养添加0.75mg/L锌离子对利福霉素SV合成和pH值的影响Fig.2 Effect of Zn2+addition(0.75mg/L)on rifamycin SV production and pH value in a 10L bioreactor
2.3 10L罐发酵培养添加0.75mg/L锌离子对氨基酸和丙酮酸合成的影响
发酵过程中胞外丙酮酸和氨基酸的变化规律见图3~图5。发酵过程中(72h~141h),胞外丙酮酸浓度为49.98mg/L~85.63mg/L,比对照提高19.73%~93.72%,尤其是72h时,丙酮酸浓度为49.98mg/L,是对照组的1.94倍;胞外丙氨酸浓度在3.97mg/L~18.33mg/L之间,只有对照的40.45%~62.31%,特别是在96h胞外丙氨酸的浓度为11.90mg/L,比对照降低60%。这说明锌离子确实抑制了丙氨酸脱氢酶的活性,致使丙氨酸(Ala)积累明显减少,同时引起该酶催化底物——丙酮酸的积累。由于Ala会对谷氨酰胺合成酶产生抑制作用[9],所以Ala降低会引起谷氨酰胺合成酶活力的提高,从而促进谷氨酰胺(Gln)的积累,而Gln会直接促进利福霉素SV的合成,使得利福霉素SV效价提高。
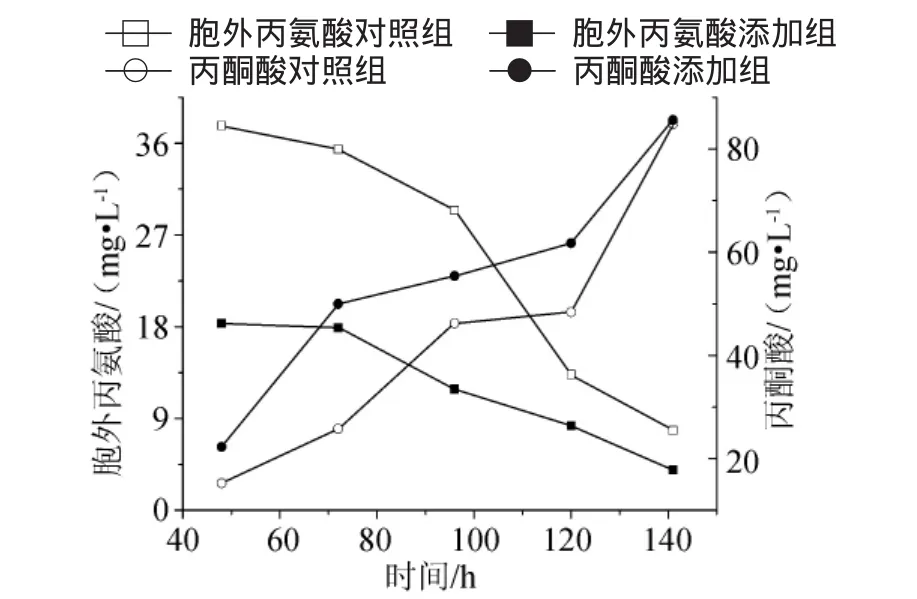
图3 10L罐培养添加0.75mg/L锌离子对胞外丙氨酸和丙酮酸合成的影响Fig.3 Effect of Zn2+addition(0.75mg/L)on Ala and pyruvatein a 10L bioreactor

图4 10L罐培养添加0.75mg/L锌离子对谷氨酸和赖氨酸合成的影响Fig.4 Effect Zn2+addition(0.75mg/L)on Glu and Lys in a 10L bioreactor
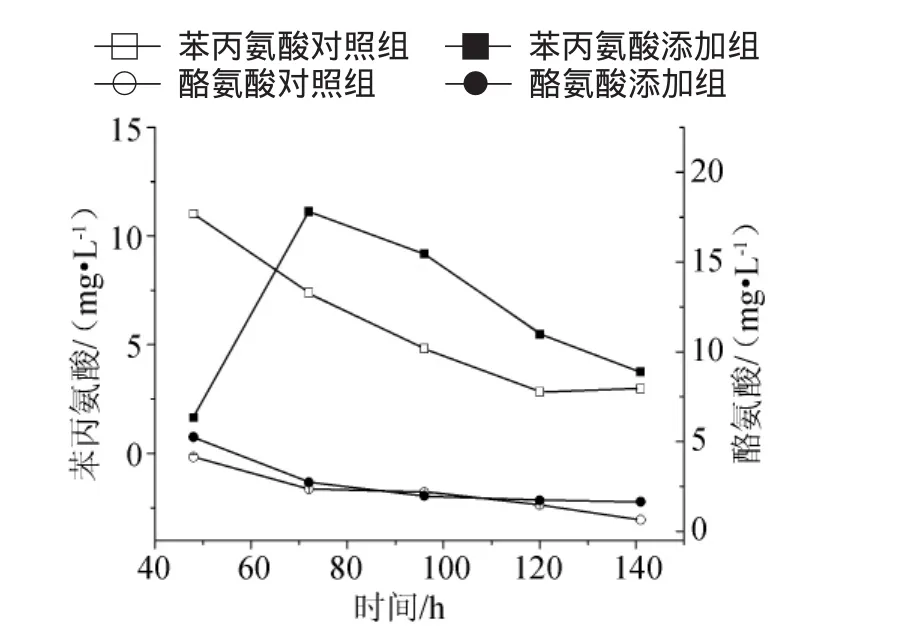
图5 10L罐培养添加0.75mg/L锌离子对苯丙氨酸和酪氨酸合成的影响Fig.5 Effect of Zn2+addition(0.75mg/L)on Pheand Tyr in a 10L bioreactor
由图4可知,96h~141h胞外谷氨酸浓度为12.59mg/L~948.12mg/L时,比对照提高7.62%~162.59%,尤其是在96h达到了927.30mg/L,是对照的2.63倍;赖氨酸浓度为20.97mg/L~26.23mg/L时,比对照提高1.99%~43.10%,尤其是在96h时,赖氨酸浓度为24.16mg/L,是对照组的1.22倍。这证实了之前的分析:锌离子抑制了丙氨酸脱氢酶活性,Ala合成效率下降,从而使丙酮酸向Ala的转化量减少而积累,这会引起三羧酸循环的碳流增大。由于谷氨酸(Glu)和赖氨酸(Lys)为三羧酸循环中间产物-酮戊二酸和草酰乙酸衍生,因此,三羧酸上游碳通量增大促进了其合成效率。
72h~141h胞外苯丙氨酸(Phe)和酪氨酸(Tyr)浓度趋势见图5。胞外酪氨酸浓度(72h~120h)与对照差异不大,但是,141h时酪氨酸浓度是1.65mg/L,是对照组的2.56倍;胞外苯丙氨酸浓度为1.64mg/L~11.13mg/L,比对照提高25.84%~92.89%。120h时Phe浓度5.48mg/L,是对照组的1.93倍。表明锌离子除了使丙氨酸脱氢酶的活性下降引起Ala浓度减少、丙酮酸积累和促进三羧酸循环碳代谢以外,丙酮酸的积累还通过反馈抑制作用在发酵中后期促进了葡萄糖-6-磷酸流入磷酸戊糖途径,从而使由磷酸烯醇式丙酮酸和4-磷酸-赤藓糖衍生的芳环氨基酸(如Phe)浓度在发酵中后期浓度高于对照组。但是3-脱氧-阿拉伯庚酮糖酸-磷酸(DAHP)合成酶是莽草酸途径的第一个酶,其受到芳香族氨基酸的协同反馈抑制作用[4]。而利福霉素SV的芳环发色前体(AHBA)是由于莽草酸途径平行的代谢途径合成的[14],并受到芳环氨基酸的协同抑制作用[4-5]。图5证实了Phe在发酵中后期明显积累,这可能就是发酵后期利福霉素SV效价增加乏力的原因。
3 结论
钱世钧等[15]曾报道丙氨酸虽不是谷氨酰胺代谢的直接产物,但其对GS表现了强烈的抑制作用。同样的结果在许多来源的GS中都能发现[5]。本文研究发现锌离子抑制了丙氨酸脱氢酶活性,Ala合成效率下降,引起丙酮酸向Ala的转化量减少,使其得到了积累。同时引起三羧酸循环的碳流增大,并引起由-酮戊二酸衍生的Glu合成量增大。倪榴英等[15]曾研究GS的活力与利福霉素SV的产量间有正的相关性,而谷氨酰胺是Glu由谷氨酰胺合成酶(GS)催化生成,谷氨酰胺的酰胺氮又是3-氨基-5-羟基苯甲酸(AHBA)直接供体[16-17],这样就促进了利福霉素SV的合成。但是丙酮酸的积累同样在发酵后期促进了磷酸戊糖途径碳流量增大,从而使芳环氨基酸(如Tyr、Phe)浓度在发酵中后期浓度高于对照组。但是利福霉素SV的芳环前体AHBA是由于莽草酸途径平行的代谢途径合成的[14],因此,AHBA的合成势必会受到芳环氨基酸的协同抑制作用。Phe在发酵中后期明显积累,这可能就是发酵后期利福霉素SV效价增加乏力的原因,这为下一步的研究确定了方向。
[1]BUJNOWSKI K,SYNORADZKI L,DNJUS E,et al.Rifamycin antibiotics new compounds and synthetic methods.Part 1:Study of the reaction of 3-formyl rifamycin SV with primary alkylamines or ammonia[J].Tetrahedron,2003,59:1885-1893.
[2]GHISALBA O,NUESCH J.A genetic approaeh to the biosynthesis of the rifamycin chromophoreinNocardia mediterranei.Ⅰisolation and charaetcrization of a pentose excreting auxotrophic mutant ofNocardia mediterraneiwith drastically reduced rifamycin production[J].J Antibiot,1978,31(3):202-214.
[3]HATANO K,AKIYAMA S,ASAI M,et al.Biosynthetic origin of aminobenzenoid nucleus(C7N-unit)of ansamitocin,a group of novel maytansinoid antibiotics[J].J Antibiot,1982,35(10):1415-1417.
[4]顾薇玲,夏天辉,焦瑞身.芳香途径终产物和中间体对力复霉素SV生物合成的调节作用[J].微生物学报,1988,28(1):56-61.
[5]STADTMAN ER,HUBBARD JS.Regulation of glutamine synthetase[J].J Bacteriol,1967,93:1045-1055.
[6]CHIAO J S,倪榴英.利福霉素SV生物合成的代谢调节的研究[J].国外医药杭生素分册,1990,11(2):92-96.
[7]倪榴英,焦瑞身.几种氮化合物对地中海诺卡氏菌U-32氨同化酶的影响[J].抗生素杂志,1984,9(4):301-306.
[8]OKAMI Y.Biology of Actinomycetes 88[M].Tokyo:Japan Scientific Societits Press,1988.
[9]陈天寿,严德喜,李根生等.微生物培养基的制造和应用[M].北京:中国农业出版社,1995.
[10]张嗣良,储 炬.多尺度微生物过程优化[M].北京:化学工业出版社,2003.
[11]商纯良.利福霉素SV发酵培养基优化和代谢初步分析[D].武汉:湖北工业大学硕士论文,2011.
[12]张 健.赤霞珠无醇干红葡萄酒的香气成分分析[J].中国酿造,2007,26(8):65-67.
[13]杜 曦,周锡兰,余 录,等.葡萄及葡萄酒中有机酸测定的衍生化气相色谱法[J].酿酒,2008,35(3):82-84.
[14]JS CHIAO,倪榴英.利福霉素SV生物合成的代谢调节的研究[J].国外医药抗生素分册,1990,11(2):92-96.
[15]钱世钧,孟广震,郝凤兮,等.北京棒状杆菌AS1.299谷氨酰胺合成酶活力调节的研究[J].生物化学杂志,1986,2(2):85-88.
[16]倪榴英,刘慈俊,金志坤,等.力复霉素与谷氨酰胺合成酶活力的正相关性[J].微生物学报,1984,24(3):217-223.
[17]焦瑞身,刘慈俊,金志坤,等.力复霉素生物合成中氮原子的参入途径[J].中国科学,1983(12):1097-1104.
