在线衍生-高效液相色谱法同时测定血浆中的色氨酸及其代谢物
2013-07-13冯成亚高洁莹甄乾娜樊子勉朱明松杨香春丁敏
冯成亚,高洁莹,甄乾娜,樊子勉,朱明松,杨香春,丁敏*
(1.重庆医科大学检验医学院,临床检验诊断学教育部重点实验室,重庆 400016;2.重庆医科大学附属第一医院内分泌内科,重庆 400016)
色氨酸(tryptophan,Trp)作为人体内的一种必需氨基酸,不仅可合成蛋白质,还能在不同组织中代谢为多种生物活性分子。在脑中Trp 主要通过色氨酸羟化酶(TPH)的作用生成5-羟色胺,5-羟色胺在单胺氧化酶的作用下转化为5-羟吲哚乙酸(5-hydroxyindole acetic acid,5-Hiaa);在脑外Trp 主要经色氨酸-2,3-双加氧酶(TDO)或吲哚胺-2,3-双加氧酶(IDO)的作用生成甲酰犬尿氨酸,甲酰犬尿氨酸经犬尿氨酸甲酰胺酶代谢为犬尿氨酸(kynurenine,Kyn),Kyn 通过犬尿氨酸氨基转移酶的作用代谢为犬尿喹啉酸(kynurenic acid,Kyna)[1]。肿瘤、肾衰竭、感染性疾病、神经性疾病等均存在色氨酸代谢紊乱[2-7]。Kyn/Trp 可间接反映IDO 活性和细胞免疫状态[8]。色氨酸及其代谢物的分析方法常用高效液相色谱法(HPLC):其中Trp和Kyn 采用紫外检测[9-12],Kyna 采用荧光检测[13,14],而5-Hiaa则用荧光或电化学检测[15-17]。目前尚未检索到同时测定血浆Trp、Kyn、Kyna和5-Hiaa的方法。本研究采用醋酸锌在线衍生及程序波长的高效液相色谱技术同时分离和测定Trp 及其3种代谢物,利用3-硝基酪氨酸(3-nitrotyrosine,3-N-Tyr)为内标(IS)定量,提高了分析的可靠性和准确性。该方法操作简便,快速,灵敏,成功应用于孕妇血浆中Trp的代谢分析。
1 实验部分
1.1 仪器与试剂
Agilent 1100型高效液相色谱仪(配有G1314A型紫外检测器及G1321A 型荧光检测器)购自美国Agilent 公司;HIMAC-cf 15低温台式离心机(日立工机株式会社);ShimaduLBRORAEL-200天平(日本岛津公司);Millipore 超纯水过滤装置及Millipore真空泵(美国Millipore 公司);SB-3200超声波清洗器(上海必能信超声有限公司)。
Trp、Kyn、5-Hiaa、Kyna和3-N-Tyr均购于美国Sigma 公司;甲醇、乙腈为色谱纯,购于美国Tedia 公司;醋酸锌、醋酸均为国产分析纯;实验用水经Millipore 系统纯化。
标准溶液的配制:分别称取一定量的Trp、Kyn、5-Hiaa、Kyna和3-N-Tyr 标准品,配制为浓度分别为20.0、9.60、5.23、5.81和12.8 mmol/L的标准储备液,分装后置于-20℃下保存备用。使用前取标准储备液稀释至所需浓度标准工作液。
1.2 样品采集与预处理
样本采集:30例正常孕妇的血浆样本取自重庆医科大学附属第一医院,平均年龄(26±2)岁,无肝、肾、肺、血液等系统疾病。28例健康女性标本取自重庆医科大学附属第一医院健康志愿者,其年龄与孕妇组相匹配。所有受试者于清晨空腹抽取前肘静脉血2 mL,低速离心留血浆置于-20℃保存。
样本预处理:取EDTA 抗凝血浆100μL,加入10μL 内标(IS)溶液(3-N-Tyr,640 nmol/L)和10μL 35%高氯酸溶液,涡旋混匀1 min,室温静置10 min 后,于4℃、13000 g 离心力下离心10 min 以沉淀血浆中的蛋白质,取上清液50μL 进样分析。
1.3 HPLC 条件
色谱柱为Hypersil C-18柱(250 mm ×4.0 mm,5μm);流动相:250 mmol/L 醋酸锌溶液(pH 5.5)-乙腈(95∶5,v/v),醋酸锌溶液使用前经0.22μm的滤膜过滤及超声脱气;柱温30℃;流速0.8 mL/min;进样量:50μL;紫外检测波长程序:0~13 min,360 nm;13.01~17 min,302 nm。荧光检测波长程序:0~10 min,激发光波长(λex)和发射光波长(λem)分别为278 nm和343 nm;10.01~14.30 min,λex和λem分别为244 nm和400 nm;14.31~17 min,λex和λem分别为302 nm和400 nm。
2 结果与讨论
2.1 HPLC 条件的确定
2.1.1 检测波长的确定
固定色谱分离条件,对待测物进行光谱扫描。Kyn、IS和Trp 选用紫外检测,使用Agilent 色谱工作站,分别对其紫外光谱进行扫描:Kyn 在225、258、360 nm 有吸收峰,由于Kyn 最先被洗脱出,此时检测波长过低易受血浆内源性物质的干扰,而在360 nm 处大多数干扰物质无吸收,且IS 在Kyn 后流出,其在360 nm 处有吸收,因此选择360 nm 作为Kyn和IS的检测波长;Trp 具有吲哚环,可发出自然荧光,但采用荧光检测时与血中内源性物质有少许交叉,分离度小于1.5,而采用紫外检测则能达到基线分离,Trp的最大吸收波长为278 nm,但此波长下Trp与Kyn的峰面积相差较大,而在302 nm 处Trp有吸收且其峰面积与Kyn 相近,利于内标量的确定从而达到准确定量,因此选择302 nm 为Trp的检测波长。5-Hiaa和Kyna 在血液中的含量较低,需用荧光检测。使用Agilent 色谱工作站,对其荧光光谱进行扫描,得到最大激发光波长(λex)分别为:λex,5-Hiaa=278 nm和λex,Kyna=244 nm;最大发射光波长(λem)分别为:λem,5-Hiaa=343 nm和λem,Kyna=400 nm,将各自最大的λex和λem作为检测波长。本方法采用程序检测波长可实现血浆中色氨酸及其3种代谢物的同时检测。
2.1.2 醋酸锌浓度的选择
5-Hiaa和Kyna 在血液中的浓度很低,需经醋酸锌在线衍生才能达到分析要求。配制不同浓度(10、100、150、200、250、300 mmol/L)的醋酸锌溶液(pH 为5.5)为流动相,对混合标准液进行分析,其中Kyna和5-Hiaa 用荧光检测,Trp和Kyn 用紫外检测,结果见图1。这4种待测物经醋酸锌在线衍生后峰面积均有所增大,这是由于4种待测物的官能团如-COOH、-NH2中的N、O 等原子可提供孤对电子与Zn2+配位,使其形成配合物,从而响应增强。当醋酸锌浓度低于200 mmol/L 时,这4种待测物的峰面积随醋酸锌浓度的增大而增加;当醋酸锌浓度大于200 mmol/L 时,随醋酸锌浓度的增大,Trp和Kyn的峰面积基本不变,5-Hiaa的峰面积约有下降,而Kyna的峰面积则持续增加。因血浆中Kyna 浓度较5-Hiaa 低,响应信号较弱,当醋酸锌浓度达到250 mmol/L 时才能满足分析要求,但醋酸锌浓度过高易形成结晶堵塞色谱柱及其他仪器部件。本文选择醋酸锌浓度为250 mmol/L,此条件下柱压为13.2 MPa。
2.1.3 流动相pH 对保留时间和峰面积的影响
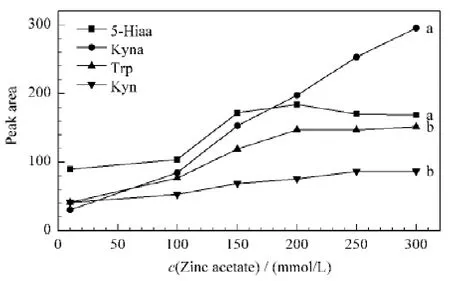
图1 流动相中醋酸锌浓度对分析物峰面积的影响Fig.1 Effect of concentration of zinc acetate in mobile phase on peak areas of analytes
配制250 mmol/L 醋酸锌溶液,并用醋酸调至不同pH 值(4.5、5.0、5.5、5.7、6.0),对混合标准液进行分析,结果见图2。pH 值对4种待测物的保留行为有较大的影响,pH 值为5.0左右时,Kyna和Trp,5-Hiaa和Kyn的保留时间很接近;而pH 值为6.0左右时,Kyna和Kyn的保留时间相近(图2b)。随着pH 值的降低,5-Hiaa和Kyn的峰面积基本不变,Trp和Kyna的峰面积降低(图2a),这是由于随着酸度增加,更多的H+与流动相中的Zn2+竞争官能团上的配位点,使Zn2+衍生效率降低。综合考虑,选用流动相的pH 值为5.5,此时4种待测物彼此能较好分离,且有利于衍生。
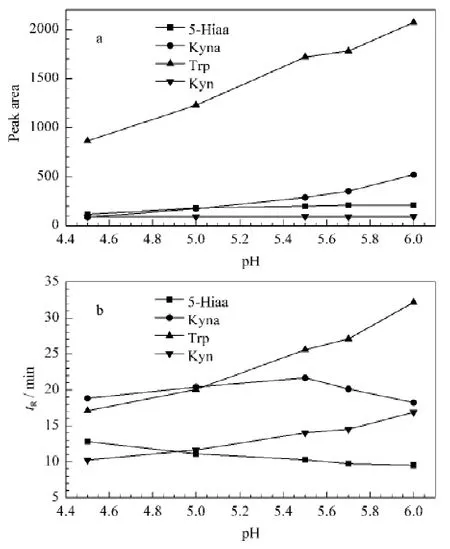
图2 流动相pH 值对(a)峰面积和(b)保留时间的影响Fig.2 Effects of pH of mobile phase on(a)peak area and(b)retention time
2.2 方法学评价
2.2.1 标准曲线及检出限
配制含有内标的系列标准液,各取10μL 加入90μL 混合血浆中,按1.2节中“样本预处理”项操作,以血浆中加入待测物的浓度为横坐标,血浆中待测物峰面积与内标峰面积的比值减去空白血浆中待测物峰面积与内标峰面积的比值为纵坐标,绘制标准曲线。以S/N=3为方法的检出限(LOD),S/N=10为方法的定量限。结果见表1。
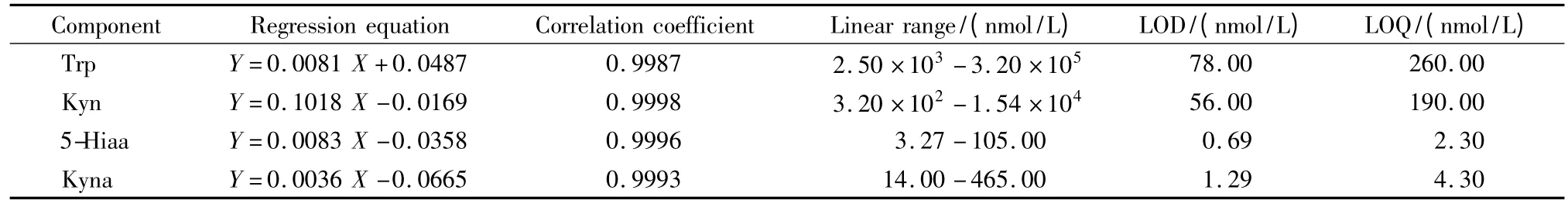
表1 Trp,Kyn,5-Hiaa和Kyna的线性关系、检出限(LODs,S/N=3)及定量限(LOQs,S/N=10)Table 1 Linear relationships,limits of detection(LODs,S/N=3)and limits of quantification(LOQs,S/N=10)of Trp,Kyn,5-Hiaa,and Kyna
2.2.2 精密度和回收率
分别取含高、中、低浓度待测物的血浆样本进行精密度测定,按1.2节中“样本预处理”项操作。日内每个浓度水平重复测定5次,连续测定5天。日内相对标准偏差(RSD)在1.02%~4.08%之间,日间RSD 在1.38%~3.95%之间,结果见表2。在90μL 健康人混合血浆中加入10μL 高、中、低3个浓度水平的混合标准液,按1.2节中“样品预处理”项操作进行回收率测定。4种待测物的回收率在91.62%~114.17%之间。
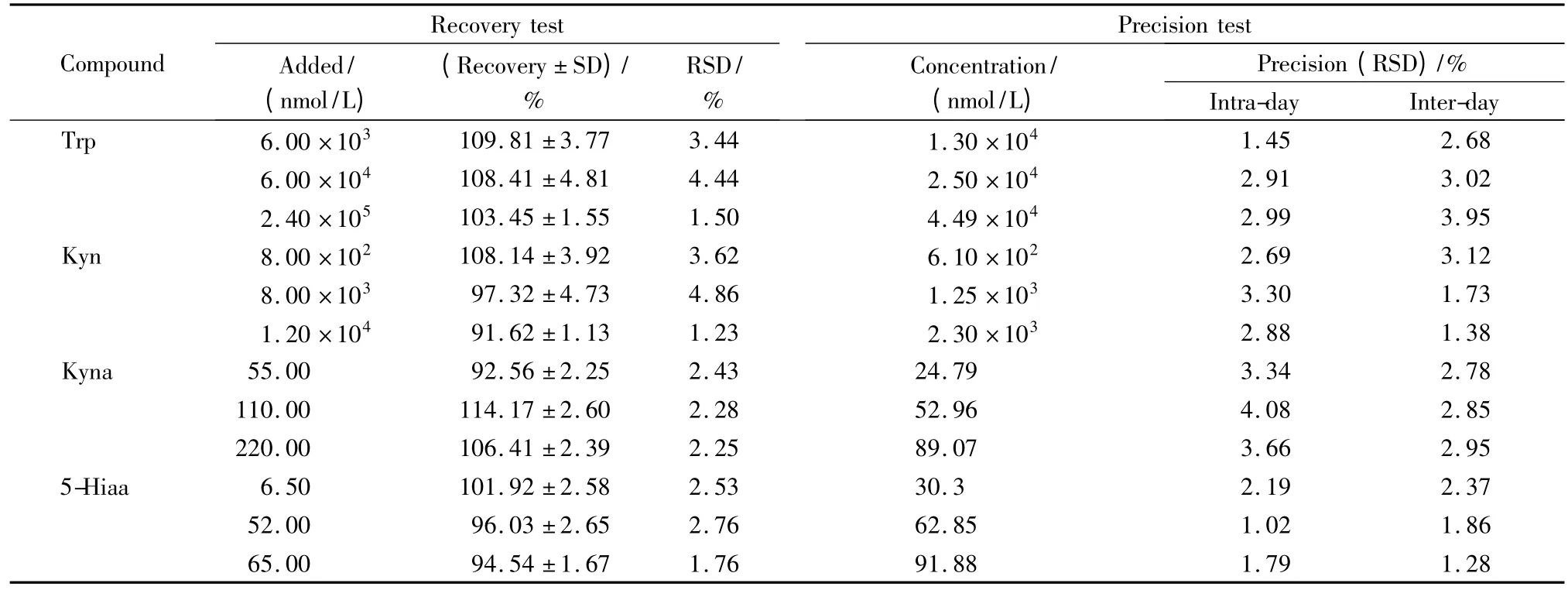
表2 Trp、Kyn、5-Hiaa 及Kyna的回收率和精密度(n=5)Table 2 Recoveries and precisions of Trp,Kyn,5-Hiaa and Kyna(n=5)
2.3 干扰试验
根据美国国家临床实验室标准委员会(NCCLS)制订的关于干扰试验的评价方案进行。考察胆红素和溶血对测定Trp、Kyn、Kyna和5-Hiaa的影响。将胆红素标准品冻干粉用甲醇溶解,配成浓度分别为5.6、2.8、1.4、0.70 mmol/L的标准液,取健康人混合血浆90μL,加入10μL 上述不同浓度的胆红素标准液,按1.2节中“样品预处理”项操作。分别测定未加(X0)和加入(X)胆红素标准液时血浆Trp,Kyn,Kyna和5-Hiaa的浓度,按照本研究所建立方法的SD 计算,干扰值=X -X0在对照组1.96s(95%置信区间)范围内为无显著干扰。结果表明,血浆胆红素浓度达到0.56 mmol/L(正常人为2~20μmol/L)时对测定结果也无影响。
取正常人EDTA 抗凝全血分成两份,一份在4℃、2000 g 离心力下离心,分离血浆;另一份在-80℃和37℃间反复冻融直至全部溶血。用血浆配制成5%、10%、15%、30%、50%的溶血标本,按1.2节“样品预处理”项操作,每一浓度样品重复测定3次。结果显示,10%的溶血即对这4种物质的测定有影响,其中随着溶血程度的增加,Trp、Kyn和Kyna均显著性降低,5-Hiaa 显著性增加,这可能是因为溶血过程中血小板释放出来大量5-Hiaa。
2.4 实际样品测定
用该方法分别测定正常孕妇和对照组血浆中Trp、Kyn、Kyna和5-Hiaa的浓度,结果见表3;其中一位健康女性血浆的色谱图如图3所示。结果显示:除5-Hiaa 浓度和Kyn/Trp 比值外,正常孕妇组Trp,Kyn,Kyna均显著低于对照组,经t 检验,两者之间的差异具有统计学意义(P<0.01)。正常孕妇Trp 经Kyn 途径(与免疫功能有关)代谢异常,而Trp经5-Hiaa 代谢则与对照组无显著差异,表明正常孕妇免疫功能发生改变。
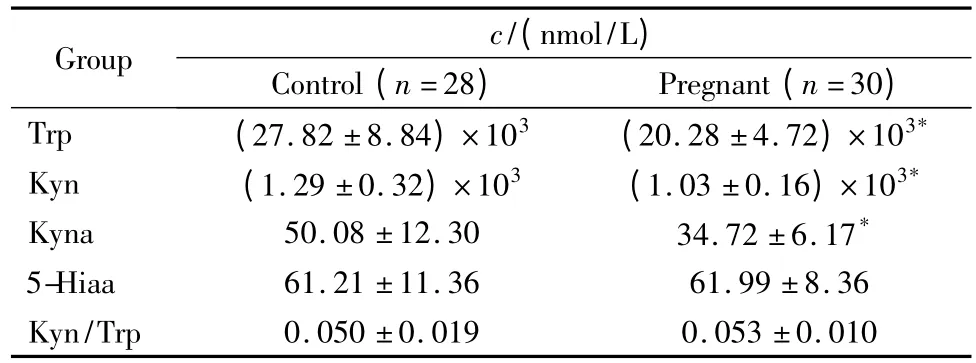
表3 孕妇组与对照组血浆中Trp,Kyn,5-Hiaa,Kyna含量及Kyn/Trp 比值Table 3 Concentrations of Trp,Kyn,5-Hiaa Kyna and the ratio of Kyn/Trp in plasma in pregnant and control group
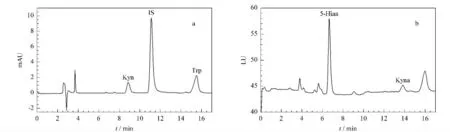
图3 一名健康女性血浆的色谱图Fig.3 Chromatograms of the plasma of a healthy control
3 结论
建立了高效液相色谱法同时测定血浆Trp、Kyn、5-Hiaa、Kyna的方法,利用醋酸锌在线衍生及程序波长的高效液相色谱技术,采用内标法定量,线性相关性好,操作简便,内源性物质干扰小,灵敏度高,适合于临床与科研。
[1]de Jong W H A,Smit R,Bakker S J L,et al.J Chromatogr B,2009,877(7):603
[2]Platten M,Weller M,Wick W.CNS Oncol,2012,1(1):99
[3]Pawlak D,Tankiewicz A,Mysliwiec P,et al.Nephron,2002,90(3):328
[4]De Jong R A,Nijman H W,Boezen H M,et al.Int J Gynecol Cancer,2011,21(7):1320
[5]Lögters T T,Laryea M D,Altrichter J,et al.Shock,2009,32(1):29
[6]Kurz K,Schroecksnadel S,Weiss G,et al.Curr Opin Clin Nutr Metab Care,2011,14(1):49
[7]Laviano A,Meguid M M,Cascino A,et al.Curr Opin Clin Nutr Metab Care,2009,12(4):392
[8]Maes M,Ombelet W,Verkerk R,et al.Psychol Med,2001,31(5):847
[9]Zhen Q N,Huang X L,Zhang X Q,et al.Chinese Journal of Chromatography(甄乾娜,黄小兰,张晓清,等.色谱),2011,29(5):435
[10]Krcmova L,Solichova D,Melichar B,et al.Talanta,2011,85(3):1466
[11]Zhang X Q,He Y,Ding M.J Chromatogr B,2009,877(16/17):1678
[12]Ma L,Xu B,Wang W J,et al.Clin Chim Acta,2009,405(1/2):94
[13]Xiao L D,Tang A G,Mo X M,et al.Chinese Journal of Chromatography(肖乐东,唐爱国,莫喜明,等.色谱),2009,27(2):220
[14]Fukushima T,Mitsuhashi S,Tomiya M,et al.Clin Chim Acta,2007,377(1/2):174
[15]Bearcroft C P,Farthing M J G,Perrett D.Biomed Chromatogr,1995,9(1):23
[16]Christofides J,Bridel M,Egerton M,et al.J Neurochem,2006,97(4):1078
[17]Manickum T.J Chromatogr B,2009,877(32):4140
