一步法和两步法毛细管等电聚焦测定蛋白质和多肽等电点的比较
2013-07-13高培峰赵新颖贺木易刘庆生屈锋
高培峰,赵新颖,2,贺木易,刘庆生,屈锋*
(1.北京理工大学生命学院,北京 100081;2.北京市理化分析测试中心,北京 100089;3.中国农业科学院饲料研究所,北京 100081)
蛋白质和多肽是两性分子,与其他非两性生物小分子和生物大分子的显著区别是它们具有等电点(pI)的特性。除相对分子质量外,pI 不仅是蛋白质和多肽的重要理化性质之一,也是可用于表征不同蛋白质和多肽之间性质差异的重要参数之一。等电聚焦是测定蛋白质和多肽的pI 值的主要方法。毛细管等电聚焦(cIEF)是基于毛细管电泳技术,根据两性物质的等电点差异进行分离分析的特有方法,最早由Hjerten 等[1,2]提出,现已广泛应用于蛋白质[3-7]、多肽[8-12]、微生物颗粒(如病毒[13]、真菌[14,15]和细菌[16-18])以及细胞器[19]等两性生物微粒的分离分析。与毛细管区带电泳、胶束电动色谱以及毛细管亲和电泳等模式相比,cIEF 可对两性物质特有的pI 进行测定。但cIEF的分离过程比较复杂,实验操作步骤多,影响因素也多,重复性较难控制,因而也是毛细管电泳多种分析模式中技术水平要求最高、难度最大的一种分析模式。
cIEF 实验中首先需将待测组分、两性电解质和辅助介质在内的混合物溶液注入毛细管,因两性电解质在外加直流电场中自动形成稳定的、连续的、线性的pH 梯度,故待测组分会自动聚焦,移至与自身pI 对应的pH 处形成狭窄的聚焦区带。该待测组分的聚焦区带与阳极端的距离和毛细管的pH 梯度呈线性关系,因此,根据聚焦区带的位置可计算出其pI 值。cIEF 分为进样、聚焦和迁移3个步骤。当聚焦和迁移同步进行时称为一步法,其具有体系简单、分离速度快的优势。当聚焦和迁移分两步进行时为两步法,其具有很好的稳定性,可准确测定样品的pI 值,是更有效和常用的方法。
本文建立了一步法和两步法分离5种蛋白质和6种合成标准肽段(8~14个氨基酸残基)的条件及其pI 测定的方法,并对这两种方法的分析结果进行了讨论和比较。尽管cIEF 有关的分析报道较多,但针对上述混合蛋白质和肽段进行分离分析以及条件优化的研究还没有报道,针对一步法和两步法进行效果对比的研究也没有报道。本工作对于蛋白质和多肽的pI 测定具有实际指导意义和应用价值。
1 实验部分
1.1 试剂和材料
细胞色素C(Cyt C)、转铁蛋白(Trf)、血红蛋白(Hb)、肌红蛋白(Mb)和牛血清白蛋白(BSA),pI markers(pI 10.3/7.6/5.5/4.0)和羟丙甲基纤维素(HPMC)购自Sigma 公司。腾冲嗜热菌合成标准肽段由北京蛋白质组研究中心张养军老师提供,编号和氨基酸序列分别为188778(LADLFYQSK)、188756(GFVIYHCAVK)、188782(TAYFAELNSYK)、188784(TATVDDIDNIYR)、188765(FWGFGSDGTVGANK)、188766(AGYTAIVSHR)。载体两性电解质Pharmalyte(pH 范围分别为3~10/5~8/4~6.5)购自GE Healthcare 公司,精氨酸(Arg)购自北京拜尔迪生物科技有限公司,亚氨基二乙酸(IDA)购自梯希爱(上海)化成工业发展有限公司,NaOH、H3PO4、Na2HPO4、NaH2PO4、乙酸和尿素均为分析纯,购自北京化工厂。实验用水均为蒸馏水。
1.2 等电聚焦溶液配制
一步法需要载体两性电解质(pH 3~10)4μL,20 mmol/L PBS 缓冲液(pH 7.0)50μL;两步法需要载体两性电解质pH 3~10/4~6.5/5~8分别为4μL/1μL/1μL,4 g/L HPMC 50μL,500 mmol/L Arg 4μL,100 mmol/L IDA 4.5μL,各种蛋白质、多肽和pI marker 按需要量添加,样品溶液组成以100μL 计,其余体积用水补足。混合好的样品溶液在涡旋振荡器上混匀30 s,样品需新鲜制备。
1.3 毛细管电泳条件
Beckman P/ACETMMDQ 型毛细管电泳仪配备紫外(UV)检测器(Beckman,美国);7100毛细管电泳仪配备二极管阵列(DAD)检测器(Agilent,美国);检测波长280 nm,分离温度15℃。
一步法使用熔融石英毛细管(有效长度/总长:20 cm/30.2 cm,内径75μm),购自凯利奥拉色谱分析(邯郸)有限公司。新毛细管在使用前分别用20 mmol/L NaOH和H2O 各冲洗10 min;每两次进样间和实验结束后,用H2O 冲洗5 min。聚焦分离时,阳极和阴极所用电极液分别为200 mmol/L的H3PO4和NaOH,分离电压20 kV,分离时间10 min。
两步法采用涂层石英毛细管(有效长度/总长:20 cm/30.2 cm,内径75μm),购自奥泰克生物科技有限公司(河北,中国)。新毛细管在使用前分别用20 mmol/L H3PO4和H2O 各冲洗10 min;每两次进样间和实验结束后,依次用4 mol/L 尿素、20 mmol/L H3PO4和H2O 冲洗5 min。实验结束后毛细管两端用水封后于4℃保存。实验采用172.37 kPa 气压进样1 min;聚焦时,阳极和阴极的电极液分别为200 mmol/L H3PO4和300 mmol/L NaOH,聚焦电压10 kV,聚焦时间5 min;分离时,阳极和阴极的电极液分别为200 mmol/L H3PO4和350 mmol/L乙酸,分离电压为15 kV,同时加正向0.69 kPa 气压,分离时间15 min。
2 结果与讨论
2.1 一步法分离蛋白质和多肽混合物
一步法也称为动态聚焦法(tcIEF),是利用pH梯度和电渗流的共同作用,使样品区带在聚焦过程中迁移或者在迁移过程中聚焦。如果不采用封堵剂(如:阴极封堵剂N,N,N',N'-四甲基二乙胺(N,N,N',N'-tetramethylethylenediamine,TEMED)),其和普通CZE 十分相似,迁移不受限制,即为自由迁移法。利用一步法,对pI 7.6 marker和BSA 进行聚焦分离(见图1a),6次重复实验测定的pI 7.6 marker和BSA的迁移时间的RSD 分别为4.7%和4.2%。利用单点法进行测算,得到BSA的pI 为4.4。利用一步法分离BSA、Hb、Mb、Cyt C和Trf 混合蛋白质时,BSA、Hb和Mb 3种蛋白质能得到快速分离,但峰形对称性较差,而Cyt C和Trf 在该条件下未能检出(见图1b);利用一步法分离6种混合多肽时,多肽188765不能检出(图1c)。说明一步法可以对单种蛋白质或多肽的pI 进行粗略测定,简单、快速,但是对混合组分pI的测定较难实现。
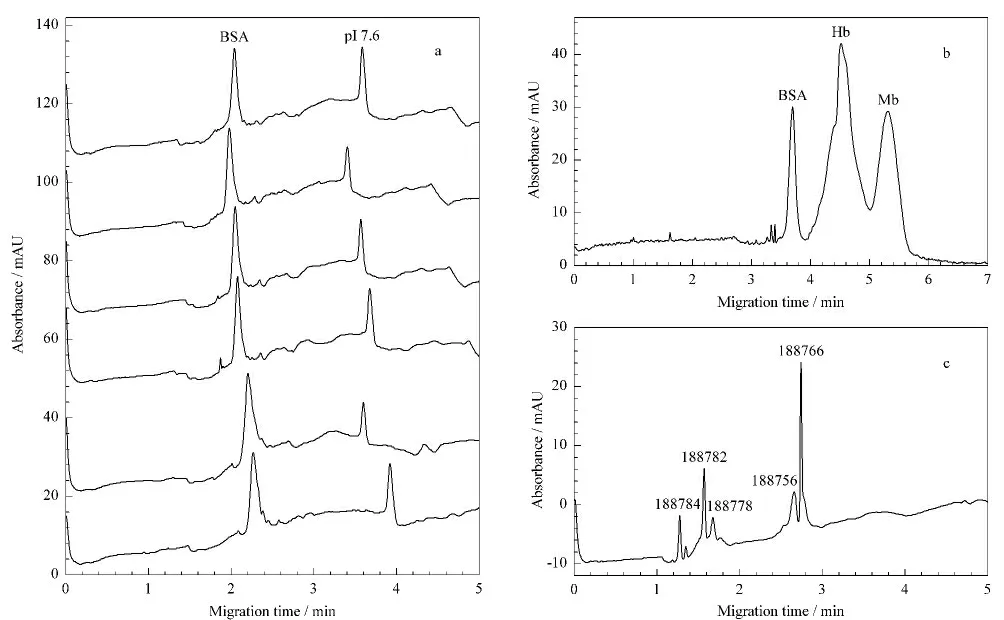
图1 一步法分离蛋白质和多肽混合物的电泳图Fig.1 Electropherograms of mixtures of proteins and polypeptides separated by one-step cIEF
2.2 两步法分离蛋白质和多肽混合物
两步法是将样品聚焦和迁移检测过程分为两步进行,减少聚焦和分离协同作用因素的干扰,增加过程的可控性,是目前主要采用的方法。两步法中的聚焦过程是决定pI 测定结果准确与否的最主要因素,因此需根据预测的样品的pI 范围选用合适pH范围的载体两性电解质,并确保聚焦过程中形成稳定的pH 梯度。此外,聚焦溶液中载体物质和封堵剂的种类及其组成比例也会影响聚焦实验的重复性。而聚焦电压和聚焦时间则是确保聚焦完全的两个重要因素。聚焦结束后,还需控制分离条件以确保聚焦形成的样品区带能够快速、完全地通过检测器。上述因素均影响检测结果的准确性和重现性,因而需对其进行优化。
2.2.1 聚焦溶液和体积
聚焦溶液中包括载体两性电解质、动态涂层剂、封堵剂和溶剂,其比例条件决定聚焦过程能否顺利进行[20]。同时,利用相关软件通过毛细管长度和内径、进样压力和时间4个已知参数可以计算进样体积,以确保样品充满毛细管。实验对上述因素进行了选择和优化,在1.3节中所列条件下BSA、Hb、Mb、Cyt C和Trf 5种蛋白质和6种多肽可以实现完全聚焦及分离。
2.2.2 聚焦电压和时间
聚焦电压和时间影响聚焦过程中两性电解质形成pH 梯度的速度,也影响待测样品在毛细管内聚焦的速度,同时还影响聚焦过程中毛细管内电流和焦耳热的大小[20]。本实验以pI 7.6 marker 为例,对5~20 kV的聚焦电压和时间进行了考察。结果表明:随着电压的增加,迁移时间变短,聚焦电流迅速增大,二者间基本呈线性变化(见图2);当聚焦电压为10 kV,聚焦5 min 时,电流明显降低且保持稳定(约5μA),表示聚焦完成。
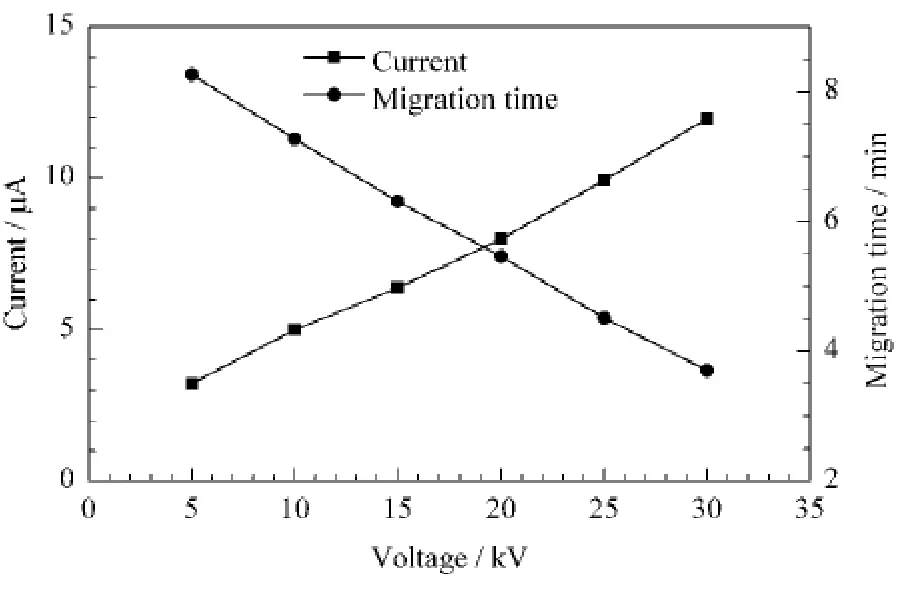
图2 两步法分离时聚焦电压对电流和pI 7.6 marker的迁移时间的影响Fig.2 Effects of focusing voltage on current and migration time of pI 7.6 marker
2.2.3 分离条件
为减轻气压驱动后因层流导致的区带展宽,可采用微弱的分离气压并维持一定低分离电压的方法[20]进行分离。本实验中,以吸附性较强的Cyt C为例,对分离电压和分离气压进行了比较和优化。在2.2.2节中优化的聚焦条件下,分离气压为0.69 kPa 时,待测组分能够获得较好的分离;随着分离气压由0.69 kPa 增加到2.07 kPa,样品组分出峰时间提前,但分离度减小直至丧失(图3a)。由于仪器所提供的最小压力为0.69 kPa,此时也可适度增加分离电压,使待测组分的迁移加快,出峰时间提前,峰形变尖锐,且分离度却保持不变(图3b)。综合考虑分离时间和电泳效果,实验中采用了15 kV 分离电压和0.69 kPa 分离气压。
2.2.4 方法的重复性
5种蛋白质中,Trf 呈现出两个峰,可以测定出两个pI 值,说明其组成相对复杂。因此以Trf和肽段188766为例,考察方法的重复性(见图4)。测得pI7.6marker、Trf和肽段188766迁移时间的RSD均小于1.0%(n=6),表明所建立的方法重复性好。
2.2.5 两步法分离混合蛋白质和混合多肽
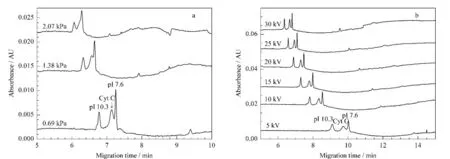
图3 两步法分离Cyt C 时(a)分离气压和(b)分离电压对分离效果的影响Fig.3 Effects of(a)driving pressure and(b)driving voltage on Cyt C separation by two-step cIEF
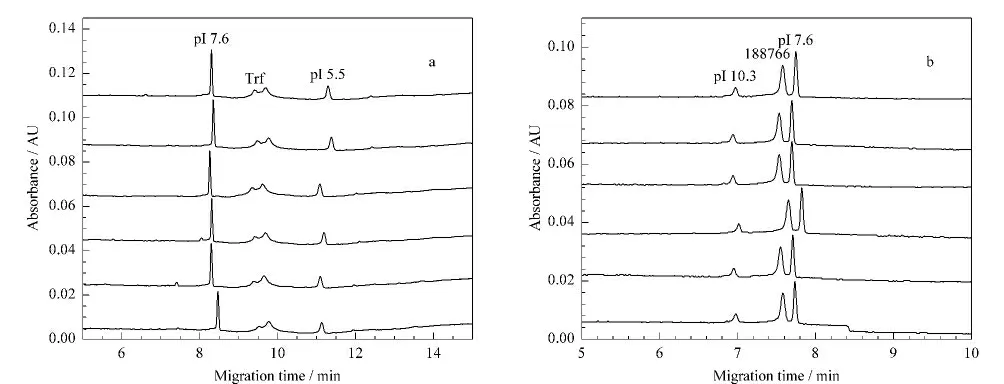
图4 两步法分离(a)Trf和(b)肽段188766的重复性Fig.4 Repeatabilities of(a)Trf and(b)peptide 188766 separations by two-step cIEF
将优化的两步法条件用于单一组分的5种蛋白质和肽段的pI 测定时,可得到准确的pI。用于蛋白质混合物和肽段混合物的pI 测定时,应先分析4种pI marker和每种单一组分的出峰时间,再分离pI marker与5种蛋白或6种肽段的混合组分,以确定每种组分的出峰位置,其分离色谱图见图5a和b。对pI marker的pI 值与其迁移时间进行二次曲线拟合(图5c和d),根据二次曲线计算所测5种蛋白质和6种多肽的pI 值,结果与单组分测定时相近(见表1)。其中,结果差异较大的是蛋白质Cyt C和多肽188778、188765,三者的pI 值均有0.2个pH 单位的差值。对6种混合肽段进行检测时,多肽188756不能检出,但对其进行单独进样时,其出峰位置紧邻pI 7.6 marker(图5b 中*处),说明其等电点应与7.6相近,其峰可能被pI 7.6 marker 掩盖,二者相互干扰。
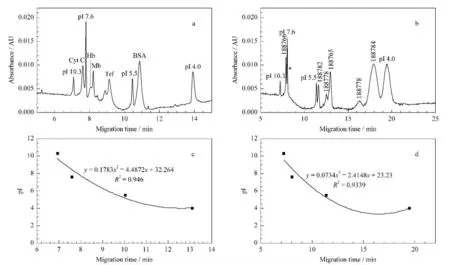
图5 两步法分离(a)混合蛋白质和(b)混合肽段的色谱图及(c和d)对应的pI marker的pI 值和迁移时间的曲线关系Fig.5 Chromatograms of mixtures of(a)proteins and(b)polypeptides by two-step cIEF and(c and d)curvilinear relationships between pI and migration time of the pI markers respectively
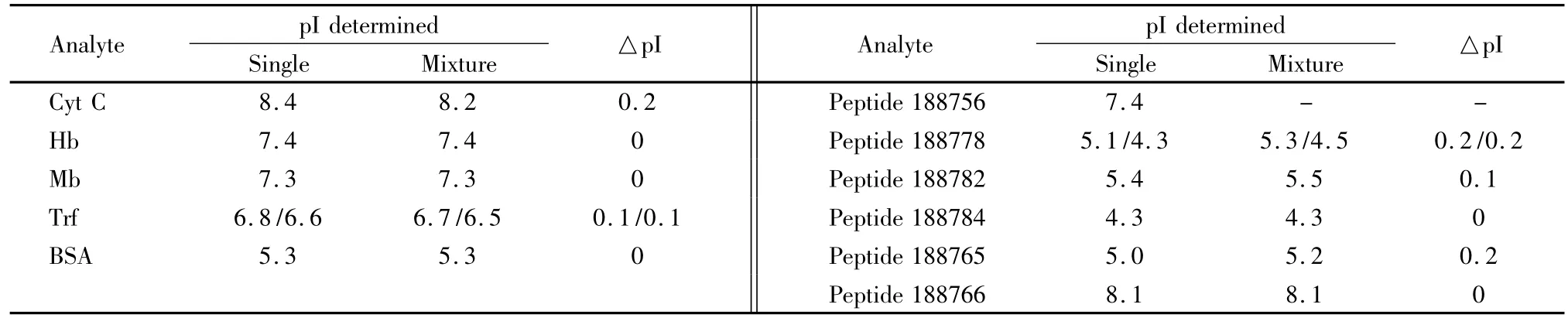
表1 单一组分蛋白质和多肽与混合样品采用两步法测定的pI 值比较Table 1 Comparison of pI determined for single protein/polypeptide and mixtures by two-step cIEF
2.3 一步法与两步法比较
以BSA 为例,其等电点的报道值在4.6~5.8之间。本实验中,采用一步法测定时,BSA的迁移时间约为2 min,pI 值为4.4;采用两步法测定时其迁移时间约为10.5 min,pI 值为5.3。一步法虽然简单,比两步法分离速度快,但测定结果不如两步法精确。
一步法分离在速度上具有明显优势,5 min 之内即能完成聚焦分离全过程,可以实现对单一组分的分析,重现性好,所测pI 结果比较准确。但对多种蛋白质或者多肽的混合样品则分离度不够,不能准确测定pI。如果在实际样品分析时,经区带电泳表征后发现样品组分单一,纯度较高,可以首选一步法进行测定。但因一步法分离过程受到电渗流的影响,pI与迁移距离的线性关系范围处在很狭窄的区间,因此要求pI 准确测定时,建议使用一步法并需两步法进行校正。
两步法的分离体系较前者复杂,且分离时间长,但所得各组分的峰具有良好的分离度,且各组分的出峰时间与梯度pH 相对应,可进行pI的准确测定。如果是未知生物样品,需先进行毛细管区带电泳表征,确定其是否为多组分混合体系,以及确定其基本组成。再采用两步法进行样品分离的条件优化,选择优化条件进行pI 测定。两步法用于pI 测定时,结果的准确性高于一步法。
3 结论
毛细管电泳具有高效、快速、低成本优势,适合用于快速表征蛋白质和多肽的性质;cIEF 更是蛋白质和多肽等电点测定的有效方法和手段,简便的一步法可与准确的两步法相互结合,互为补充,可实现对单一组分和多组分样品pI的准确测定,具有十分广泛的应用。蛋白质或多肽由于糖基化、磷酸化等修饰,或由于暴露在不同的理化环境中而导致的结构改变,以及某些蛋白质不同亚型之间存在的精细结构差异,往往使其pI 值发生改变。因此,毛细管等电聚焦不仅可准确测定蛋白质的pI 值,也能够通过pI 值变化的测定为蛋白质的结构研究提供参考。
[1]Hjerten S,Zhu M D.J Chromatogr,1985,346:265
[2]Hjertén S,Elenbring K,Kilar F,et al.J Chromatogr A,1987,403:47
[3]Fonslow B R,Kang S A,Gestaut D R,et al.Anal Chem,2010,82(15):6643
[4]Ren D Y,Zhang J,Pritchett R,et al.J Chromatogr B,2011,879(27):2877
[5]Koval D,Kasicka V,Cottet H.Anal Biochem,2011,413(1):8
[6]Croset A,Delafosse L,Gaudry J P,et al.J Biotech,2012,161(3):336
[7]Li X,Gao X D,Tian H,et al.Chinese Journal of Biologicals(李响,高向东,田宏,等.中国生物制品学杂志),2012,25(4):483
[8]Wei J,Gu X,Wang Y,et al.Chinese Journal of Analytical Chemistry(魏娟,谷雪,王彦,等.分析化学),2011,39(2):188
[9]Zhang Z C,Wang J H,Hui L M,et al.J Chromatogr A,2011,1218(31):5336
[10]Zhang Z C,Wang J H,Hui L M,et al.Electrophoresis,2012,33(4):661
[11]Chingin K,Astorga-Wells J,Najafabadi M P,et al.Anal Chem,2012,84(15):6856
[12]Shimura K,Hoshino M,Kamiya K,et al.Anal Chem,2013,85(3):1705
[13]Horká M,Kubícek O,Kubesoví A,et al.Electrophoresis,2010,31(2):331
[14]Horká M,Horky J,Kubesová A,et al.Anal Bioanal Chem,2011,400(9):3133
[15]Horká M,Kubesová A,Salplachta J,et al.Anal Chim Acta,2012,716:155
[16]Horká M,Horky J,Matousková H,et al.J Chromatogr A,2009,1216(6):1019
[17]Süle S,Horká M,Matousková H,et al.Eur J Plant Pathol,2012,132(1):81
[18]Salplachta J,Kubesova A,Moravcova D,et al.Anal Bioanal Chem,2013,405(10):3165
[19]Wolken G G,Kostal V,Arriage E A.Anal Chem,2011,83(2):612
[20]Rodriguez-Diaz R,Wehr T,Zhu M D.Electrophoresis,1997,18(12/13):2134
