动物组织中苯并咪唑类药物多残留ELISA方法的建立
2013-04-23万宇平刘春雪
陈 飞,万宇平 *,冯 静,刘春雪
(1.山东春雪食品有限公司,山东 莱阳 265200;2.北京勤邦生物技术有限公司,北京 102206)
苯并咪唑类药物(Benzimidazoles)具有广泛的生物活性,对于动物体内各种寄生线虫、绦虫具有很强的驱杀作用,目前在兽医临床上应用广泛。常用的苯并咪唑类药物包括阿苯达唑、奥芬达唑、芬苯达唑、氟苯咪唑、甲苯咪唑、噻苯咪唑和丙氧苯咪唑[1-2]。但由于苯并咪唑类药物在实验动物显示致畸和致突变作用,且在人体内转化的代谢产物亦有毒理作用,是食品残留中重要的监控对象。中国、美国、欧盟、日本等国家或地区将苯并咪唑类药物列入限制使用的药物和动物源性食品残留检测的监控对象,并制订了各种苯并咪唑类药物(包括其某些代谢物)在不同动物体内(包括肌肉、组织等)的最大残留限量(maximum residue limit,MRL),在不同的动物和不同的组织中最大残留限量从10μg/kg~5mg/kg不等[3-4]。
目前对于苯并咪唑类药物的分析方法较多,主要有气相色谱-质谱法(gas chromatography-mass spectrometry,GC-MS)、高效液相色谱法(high performance liquid chromatography,HPLC)、高效液相色谱串联质谱法(high performance liquid chromatography tandem mass spectrometr,HPLC-MS/MS)、酶联免疫吸附法(enzyme-linked immunosorbentassay,ELISA)及高效毛细管电泳法(highperformance capillary electrophoresis,HPCE)等[4-12]。气-质联用法需要衍生化后测定,液-质联用仪设备较昂贵,反相高效液相色谱法则作为主要的分析技术,然而理化方法存在复杂、繁琐、需要专业技术人员和专业技能、检测成本高等问题,不能实现大批量样品的快速检测分析;ELISA以其灵敏度高、特异性好、操作简便、成本低等优点适合于大量样品的快速筛选。本研究基于酶联免疫吸附技术建立一种灵敏、快速检测动物组织中苯并咪唑类药物的多残留检测方法。
1 材料与方法
1.1 材料与试剂
氟苯咪唑、丙氧咪唑、甲苯咪唑、阿苯达唑、奥芬达唑、丙硫咪唑亚砜、芬苯达唑、多菌灵药物标准品:购自美国Sigma公司;乙酸乙酯、甲醇及其他常规化学试剂均为分析纯:购自北京化学试剂公司;包被原(苯并咪唑类药物半抗原-卵清蛋白偶联物)、单克隆抗体杂交瘤细胞株为北京勒邦生物技术有限公司制备保存。
1.2 仪器与设备
8010S匀浆机:上海斯伯明仪器设备有限公司;2000SBL电子天平:美国Setra公司;QL-901漩涡混合器:海门市其林贝尔仪器制造有限公司;Anke TDL-40B低速离心机:上海安亭科学仪器有限公司;DSY-Ⅲ氮吹仪:北京金科精华苑科技有限公司;微量移液器(单道20μL~200μL、100μL~1000μL,多道250μL):美国Thermo公司;DHP-600生化培养箱:天津市中环实验电炉有限公司;MK3酶标仪:美国Thermo公司。
1.3 方法
1.3.1 ELISA检测条件的优化
采用方阵滴定法,确定抗原、抗体最佳工作浓度,为保证达到最佳检测条件,对包被时间、封闭时间、竞争反应时间、显色温度时间等条件进行筛选优化[13]。
1.3.2 酶标抗体的合成
采用过碘酸钠氧化法[14]用辣根过氧化物酶标记单克隆抗体,合成酶标抗体。
1.3.3 ELISA标准曲线的建立
通过优化以上ELISA检测条件,对不同浓度标准品曲线进行回归分析,建立竞争ELISA方法的标准曲线。
1.3.4 样本前处理方法
优化不同的试剂及提取时间,建立回收率最好的动物组织样本前处理方法。
1.3.5 ELISA检测方法结果分析
采用竞争ELISA方法建立标准曲线,分别选择氟苯咪唑标准品质量浓度为0μg/L、0.5μg/L、1.0μg/L、2.0μg/L、4.0μg/L、8.0μg/L,以质量浓度为0μg/L时的OD值为B0值,其他质量浓度的OD值为B值,以百分吸光率B/B0为纵坐标,标准品质量浓度为横坐标,绘制ELISA标准曲线。用同样的办法计算样本溶液的百分吸光率,将样本的百分吸光率代入标准曲线中,从标准曲线上读出样本所对应的质量浓度,乘以其对应的稀释倍数即为样本中苯并咪唑类药物的质量浓度。
1.3.6 特异性试验
将8种苯并咪唑类药物标准品用0.02mol/L的PBS溶解,均配制出各系列浓度的标准溶液,进行ELISA测定。按下列公式计算交叉反应率:
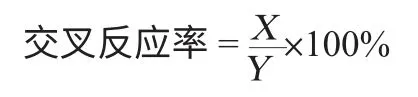
式中:X为引起50%抑制的氟苯咪唑浓度,μg/L;Y为引起50%抑制的其他苯并咪唑类药物浓度,μg/L。
1.3.7 灵敏度试验
用IC50值和检测限来评价方法的灵敏度。分别测定20次标准曲线的IC50,统计其平均值和浮动范围;并测定20个空白样本,求出其B/B0在标准曲线上对应的浓度的平均值()和标准差(s),方法检测限(method detection limit,MDL)即为MDL=()+3s。
1.3.8 添加回收试验
分别取空白鸡肉、猪肉、牛肉样本,以8μg/kg、16μg/kg、32μg/kg 3个质量浓度的氟苯咪唑药物对其进行添加回收试验,将样本前处理后进行ELISA测定,每个样品做5个平行,计算添加回收率和变异系数。
1.3.9 稳定性试验
将足量的ELISA方法涉及到的各种试剂及酶标板保存于37℃环境中,每隔1d取出适量,分别测定零标准品的OD值、IC50,及按1.3.8所述方法进行添加回收试验所测得的回收率,直到试剂盒的灵敏度和回收率开始下降为止,根据实验结果判断试剂盒的稳定性。
2 结果与分析
2.1 ELISA检测方法的建立
2.1.1 酶标板的制备
通过实验筛选,用包被缓冲液将包被原稀释每孔加入100μL,37℃避光孵育2h,倾去孔中液体,用洗涤液洗涤1次,每次30s,拍干,然后在每孔中加入150μL封闭液,37℃避光孵育2h,倾去孔内液体拍干,干燥后用铝膜真空密封保存。
2.1.2 样本前处理方法的建立
鸡肉、猪肉样本的前处理:称取(1.0±0.05)g均质物至50mL 聚苯乙烯离心管中,加入7.7mL 乙酸乙酯和0.3mL甲醇,用涡旋仪涡动至混匀;3000×g以上、室温(20℃~25℃)离心5min;移取1mL 上层有机相至10mL干净玻璃试管中,于50℃~60℃水浴氮气/空气流下吹干;加入2mL 复溶工作液涡动30s,取50μL用于分析。
牛肉样本前处理方法:称取(1.0±0.05)g用均质器均质的样本至50mL聚苯乙烯离心管中;加入7.3mL乙酸乙酯和0.7mL甲醇,用涡旋仪涡动至均匀。3000×g以上、室温(20℃~25℃)离心5min;移取1mL上层有机相至10mL 干净玻璃试管中,于50℃~60℃水浴氮气/空气流下吹干;加入2mL复溶工作液,涡动30s;取50μL用于分析。
2.1.3 ELISA标准方法的建立
通过实验筛选,建立ELISA检测步骤绘制标准曲线。向制备好的酶标板中加入系列浓度的氟苯咪唑标准溶液50μL/孔,再加入酶标抗体50μL/孔,25℃避光反应30min;洗涤4~5次后加入底物液A液(过氧化脲)50μL/孔,再加入底物液B液(四甲基联苯胺)50μL/孔,25℃显色15min加入2mol/L H2SO4终止液,50μL/孔,设定酶标仪于波长450nm处测定每孔吸光度值(OD值)。
2.1.4 ELISA标准曲线的建立
根据竞争ELISA方法,选择标准品质量浓度0μg/L、0.5μg/L、1.0μg/L、2.0μg/L、4.0μg/L、8.0μg/L,以百分吸光率(B/B0)为纵坐标(y),标准品质量浓度为横坐标(x)绘制标准曲线,结果见图1。以lg(B/B0)为纵坐标,标准品质量浓度的对数值为横坐标,将图1转换后可知,在0.5μg/L~8.0μg/L质量浓度范围内,lg(B/B0)与标准品质量浓度对数呈现良好的线性关系(图2),得回归方程y=-2.769x+0.539,R2=0.9980,IC50为1.5μg/L。
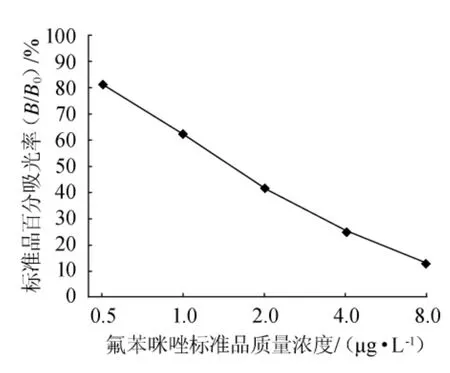
图1 苯并咪唑类药物标准曲线Fig.1 Calibration curve of benzimidazoles
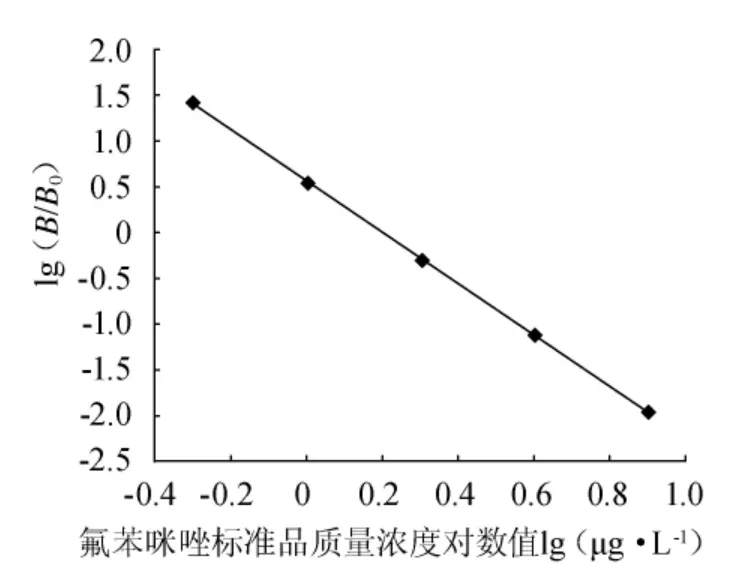
图2 苯并咪唑类药物竞争ELISA的标准曲线Fig.2 Calibration curve for detection of by ELISA
2.2 ELISA检测方法的评价
2.2.1 特异性
交叉反应率测定结果见表1。从表1可知,选用的单克隆抗体对苯并咪唑类药物中的氟苯咪唑、丙氧咪唑、甲苯咪唑、阿苯达唑、奥芬达唑均有50%以上的交叉反应率,采用此单克隆抗体建立的ELISA方法可以用于动物组织中的苯并咪唑类药物的多残留检测。
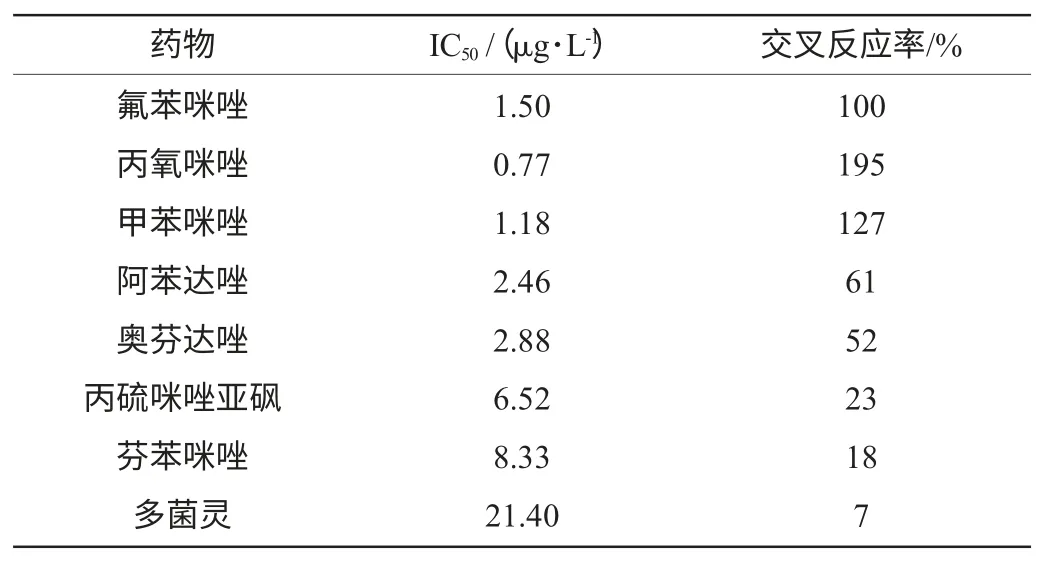
表1 苯并咪唑类药物的交叉反应率Table 1 Cross-reactivity of benzimidazoles
2.2.2 灵敏度试验
统计20次标准曲线的IC50平均值为1.2μg/L,浮动范围为0.9μg/L~1.5μg/L;20个空白样本的B/B0在标准曲线上对应的浓度的平均值()和标准差(s)见表2。综合考虑几种样本的检测限数据,得本方法对动物组织中苯并咪唑类药物的检测限为8μg/kg。
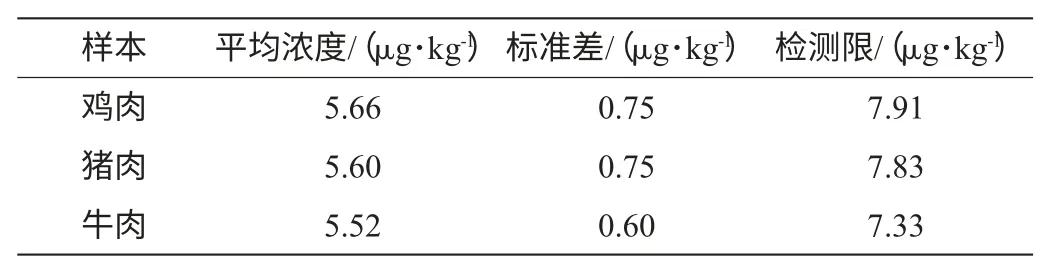
表2 方法检测限(n=20)Table 2 Detection limits of ELISA method(n=20)
2.2.3 添加回收试验
ELISA 测定的准确度用回收率表示,精密度用变异系数(coefficient of variation,CV)表示。以空白鸡肉、猪肉、牛肉样本为试验材料,向其中分别添加氟苯咪唑药物标准品,添加质量浓度为8μg/kg、16μg/kg、32μg/kg,检测结果见表3。
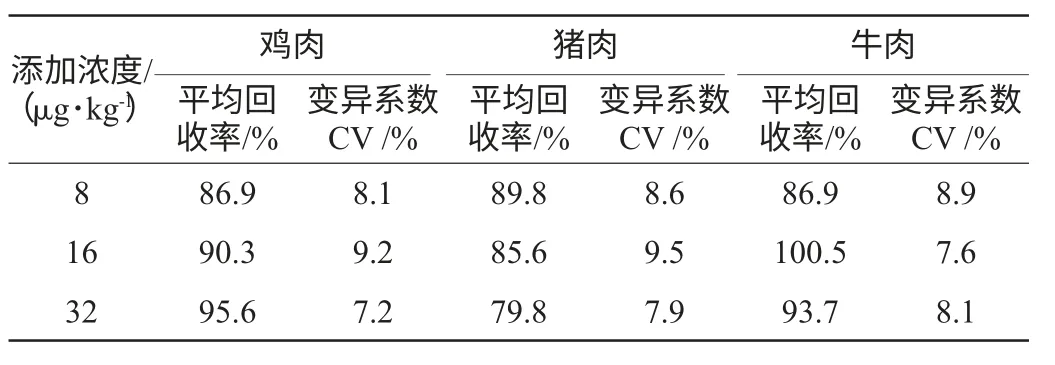
表3 ELISA方法的精密度和准确度Table 3 Precision and accuracy test of the ELISA
结果表明,动物组织中氟苯咪唑药物回收率范围为79.8%~100.5%,说明方法准确性较高;变异系数范围为7.2%~9.5%,均小于15%,说明方法精密度(重复性)较好。
2.2.4 稳定性试验
将ELISA方法涉及到的各种试剂放置于37℃保存15d,每隔1d取出,测定灵敏度和回收率等参数。经测定,涉及到的各种试剂能在37℃条件下稳定保存测定值均在正常范围之内。一般来讲,在37℃每稳定1d,可相当于4℃~10℃保存一个半月[15],在实际应用中,试剂盒一般存放在2℃~8℃冰箱,所以对于整体试剂盒的稳定性评判,还需要进行2℃~8℃放置保存试验,从而进一步验证试剂盒的稳定性。
3 结论
酶联免疫法因灵敏度高、特异性好、操作简便、检测成本低、一次性检测样本量大等特点,能够更好地满足我国畜禽养殖户、食品企业、政府监管部门等开展检测工作。本研究以实验室自制的单克隆抗体为基础,初步建立了动物组织中苯并咪唑类药物多残留检测的酶联免疫吸附法。该方法的IC50浮动范围为0.9μg/L~1.5μg/L,动物组织样本的检测限为8μg/kg;样本添加回收率为79.8%~100.5%,变异系数为7.2%~9.5%;可用于检测多种苯并咪唑类药物,并且样本前处理简单、仪器设备投资少、检测成本低,适合于大批量样本中苯并咪唑类药物残留检测的快速筛选。
[1]张璐珊,刘云飞,张新忠,等.苯并咪唑类兽药残留分析研究进展[J].中国畜牧兽医,2009,36(3):84-88.
[2]毛郑州,汪朝阳,侯晓娜,等.苯并咪唑类化合物的合成研究进展[J].有机化学,2008,28(3):542-547.
[3]农业部畜牧兽医局.农业部发布动物性食品中兽药最高残留限量(续)[J].中国兽药杂志,2003,37(3):5-11.
[4]林海丹,林 峰,张美金,等.高效液相色谱法同时测定动物组织中16种苯并咪唑类药物残留[J].食品科学,2011,32(2):231-236.
[5]李俊锁,邱月明,王 超.兽药残留分析[M].上海:海科学技术出版社,2002.
[6]曹艳兵,严 寒,尹德凤,等.乳及乳制品中苯并咪唑类药物多残留检测方法的研究[J].农产品质量与安全,2010(4):39-41.
[7]郭 强,常孝勇.动物组织中苯并咪唑类药物检测的LC-MS/MS 法研究[J].河南农业科学,2012,41(2):152-156.
[8]吴银良,皇甫伟国,杨 挺.液相色谱串联质谱法同时测定饲料中8种苯并咪唑类药物[J].分析测试学报,2010,29(12):1200-1204.
[9]张素霞,沈建忠,丁双阳,等.牛肝中苯并咪唑类药物残留的高效液相色谱检测方法[J].中国兽药杂志,2005,39(6):18-21.
[10]陈毓芳,彭肖颜.反相高效液相色谱法同时测定动物组织中苯并咪唑类兽药残留量[J].光谱实验室,2001,18(5):563-567.
[11]张素霞,李俊锁,钱传范.牛肌肉组织中苯并咪唑类药物的基质固相分散-高效液相色谱多残留分析法[J].中国兽医学报,2000,20(6):569-571.
[12]刘 凌,裴志国,刘 准,等.微波辅助溶剂提取法对土壤中残留苯并咪唑类农药的测定[J].分析试验室,2004,23(4):34-37.
[13]赵春保,彭大鹏,陶燕飞,等.猪饲料中喹噁啉类药物酶联免疫检测方法的建立[J].中国农业科技导报,2008,10(S2):69-75.
[14]伊伯元,王仁芝,李振甲,等.标记免疫学[M].北京:原子能出版社,1998.
[15]唐伟国.医学检验诊断试剂的制备与应用[M].上海:上海科学技术文献出版社,1996.
