甘蔗不同组织丝氨酸/苏氨酸蛋白激酶基因家族的表达分析
2013-04-23叶冰莹张积森陈由强
叶冰莹,薛 婷,陈 玲,张积森,陈由强*
(1.福建师范大 学生命科学学院,福建 福州 350108;2.福建发育与神经生物学重点实验室,福建 福州 350108;3.农业部福建甘蔗生物学与遗传育种重点实验室,福建 福州 350108)
甘蔗(Saccharum officinarumL.)是热带与亚热带地区重要的糖料作物,是人类最早利用C4光合途径的高光效禾本科甘蔗属单子叶植物(禾本科是一类具有重要经济价值的种子植物家族),生物产量高,收益大,且在世界食糖总产量中,蔗糖占65%左右,我国则占80%以上。甘蔗理想的生物学特征,使其被视为具有巨大开发潜力的能源作物。许多研究表明甘蔗蔗糖积累机制、糖代谢过程及其相关调控机制的研究能为甘蔗育种提供重要的理论基础[3]。植物细胞的丝氨酸/苏氨酸蛋白激酶(serine/threonine kinase,STK)几乎参与所有的生理及病理过程(如糖代谢、细胞周期、细胞生长及基因表达等[4])。研究甘蔗蛋白激酶中的丝氨酸苏氨酸激酶基因可对甘蔗的代谢和发育信号转导路径有较大的贡献作用。
本研究基于比较基因组的生物信息学预测,从甘蔗中克隆获得STK基因家族的cDNA片段及其对应的基因组片段,通过实时荧光定量PCR技术对甘蔗STK基因家族的组织表达差异性进行分析,了解该家族中具体参与糖代谢调控影响较为重要的基因,初步研究探讨STK在信号转导中的作用,尤其是STK在蔗糖代谢中的作用。
1 材料与试剂
1.1 植物材料与菌株
甘蔗(Saccharumsp.cultivar.FN41)品种由农业部福建甘蔗生物学与遗传育种重点实验室提供。大肠杆菌菌株DH5α由农业部福建甘蔗生物学与遗传育种重点实验室保存。
1.2 主要试剂
Trizol购自Invitrogen公司,焦碳酸二乙酯(DEPC)购自美国Sigma公司,植物基因组DNA提取试剂盒、DNA Ladder购自天根生化科技有限公司,pMD 19-T 载体、Ex Taq酶、rTaq酶、EcoRⅠ限制性内切酶、EASYDilution均购自TakaRa公 司,SV Gel and PCR Clean-Up System 购 自Promega,Amp购于上海生物工程公司,First strand cDNA Synthesis Kit、DNase Ⅰ购 自Fermentas 公 司,FS Universal SYBR Green Master(荧光定量试剂盒)购自Roche公司。其他生化试剂和常规试剂均为超纯或分析纯。
2 实验方法
2.1 基因组的生物信息学预测
将拟南芥信息资源网TAIR搜索获得的所有的丝氨酸/苏氨酸蛋白激酶的转录序列,编码域序列,基因位点序列与水稻基因组比对,获得水稻的STK基因组序列、蛋白质序列及完整的编码域序列;再将高粱数据库中的Sorbi1_GeneModels_Sbi1_4_aa.fasta protein 在BioEdit →Accesory Application→BLAST→Create a local protein database file→Local blast→将所有水稻STK蛋白序列上传→Do search,得到所有高粱STK蛋白质序列、转录序列。继而与甘蔗已表达序列标志(EST)数据库比对,后续实验依据高粱基因组与甘蔗ESTs设计引物,克隆出STK基因家族的编码域序列(coding domain sequence,CDS)与基因组序列片段,通过实时荧光PCR分析STK家族组织表达差异性。
2.2 甘蔗光合参数的测定
通过乙烯利处理[5]九月龄甘蔗,利用光合测定仪(具体操作见说明书)测定光合速率、气孔导度、胞间CO2浓度、蒸腾速率的变化情况。
2.3 引物设计
本实验选择看家基因GAPDH为内参照基因。看家基因GAPDH用作内参基因来调整不同样品最初的模板量以及RNA反转录的不同效率。依据实时定量PCR引物设计原则[6],根据STK cDNA序列和GAPDH基因的mRNA序列,用Primer Premier5.0设计目标基因和内参基因的特异性引物,用Oligo 6.0检验其特异性。引物由上海生工合成,序列见表1。
2.4 实时荧光定量PCR引物的特异性检测
根据Trizol说明书提取蔗茎、蔗叶的总RNA,参照Prime ScriptTM 1st strand cDNA synthesis Kit试剂盒的方法进行反转录。使用引物OligdT 18,反转录条件为42℃、1h,70℃、5min,-80℃长期保持。
在进行实时荧光定量PCR之前,先用STK-F/STK-R进行常规PCR扩增,通过琼脂糖凝胶电泳和序列测定来检测引物的特异性。PCR扩增条件为:94℃变性5min后,按94℃变性30s,60℃退火30s,72℃延伸30s进行30轮循环,最后72℃延伸10min。10μL反应体系:10×PCR Buffer 2μL;dNTP Mixture(2.5mmol/Leach)1.6μL;上下游引物(均为10μmol/L)各0.4μL;模板cDNA 1μL;rTaq(5U/μL)0.2μL;ddH2O补足20μL。反应完成后,吸取3μL PCR扩增产物1%琼脂糖凝胶电泳检测。
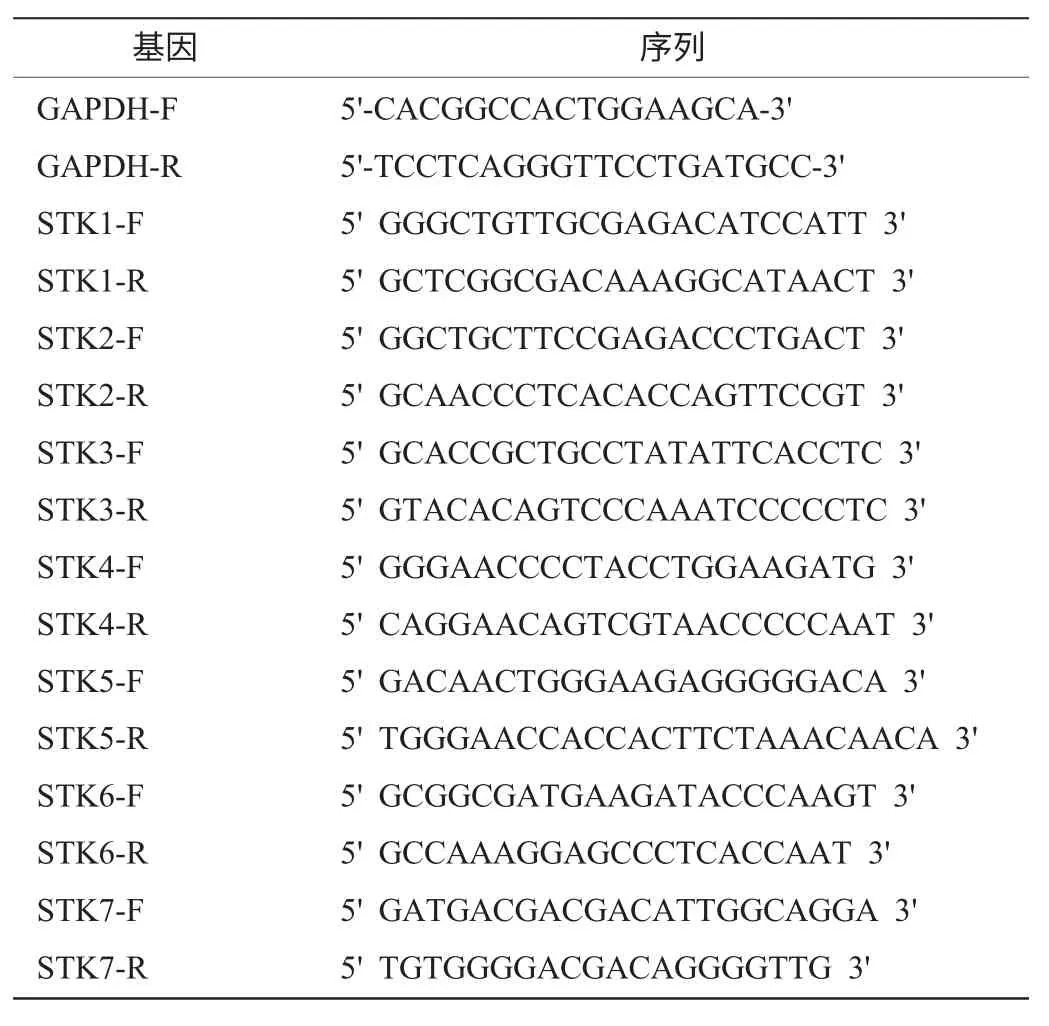
表1 STK和GAPDH实时荧光定量PCR引物Table 1 Specific primers to amplify STK and GAPDH genes for FQ-PCR
2.5 实时荧光PCR反应条件的优化
用EASY Dilution将反转录产物原液按4-1、4-2、4-3、4-4倍稀释。根据不同模板在60℃条件下的反应结果,确定PCR反应的最适模板量。PCR扩增实验结束后,选择Dissociation模式,设置在60℃~95℃每隔0.2℃采集荧光值生成溶解曲线,依据溶解曲线来判断最有反应条件。
2.6 GAPDH基因和甘蔗STK基因实时荧光PCR扩增
条件优化后可选择4-1倍稀释的反转录产物为模板,每个样品3个重复,共3个平行,对GAPDH基因、STK基因进行扩增。在冰上配制反应体系,且扩增反应在ABI 7300Fast Real-Time PCR System完成,扩增程序为95℃变性10min后,按95℃变性15s,60℃退火/延伸60s进行40轮循环。在退火/延伸时采集荧光,反应结束后选择Relative Quantification(ddCt)Study模式进行数据分析和修正。
2.7 甘蔗STK基因表达差异分析
以GAPDH基因为内参基因,福农41成熟功能叶为校准样本,2-△△Ct法[7]分析基因表达水平,比较不同组织STK基因表达差异。
3 结果与分析
3.1 基因组的生物信息学预测
本研究搜索到所有的拟南芥STK基因序列33条,水稻71条,高粱192条。对各物种的STK基因序列进行聚类分析,树形显示STK基因经历了广泛的分化,并有可能经历了基因的水平转移。通过以前实验克隆得到的甘蔗STK基因作为起始的源序列,Blast搜索高粱数据库,得到了13条高粱STK基因的亚家族序列。最终,经过结构域预测排除疑似STK基因而不具有STK激酶的保守结构域的序列,得到高粱STK亚家族的7条序列STK1-7(图1)。现STK6,7在分支图上亲源进化程度相比STK1,2,3,4,5较远(分支图上的序列从上之下依次为STK1-7)。将拟南芥、水稻、高粱STK基因家族的Groups和亚家族基因数总结为表2。继而与甘蔗EST(Expressed Sequence Tag)数据库比对,可用于后续实验高粱基因组与甘蔗ESTs设计引物,克隆出STK基因家族的CDS(coding domain sequence)与基因组序列片段,通过实时荧光PCR分析STK家族组织表达差异性。

图1 真正的高粱STK亚家族聚类分析Fig.1 The cluster analysis of true Sorghum STK Sub-family

表2 拟南芥、水稻、高粱STK基因家族的组和亚家族基因数Table 2 The Groups and sub-family genes inArabidopsis,Oryza Sativa andSorghum STK
3.2 甘蔗光合参数的测定
利用光合测定仪(ABI6400)测定乙烯利处理九月龄甘蔗的光合参数的变化见图2。在乙烯利的处理条件下,光合速率下调,气孔导度上调,胞间CO2上调,蒸腾速率下调,但是变化幅度不大。
3.3 甘蔗不同组织总RNA的提取及检测
从图3可以看出,甘蔗不同组织总RNA的电泳条带清晰,28S带明显亮于18S带,且无拖带现象,表明提取的总RNA完整性较好,部分组织存在介于5S和18S之间的1~2条条带,经紫外分光光度计检测,A260/A230大于2,A260/A280为1.8~2.0,表明RNA中的蛋白质和多糖含量较少,具有较高的纯度,符合合成cDNA的要求。
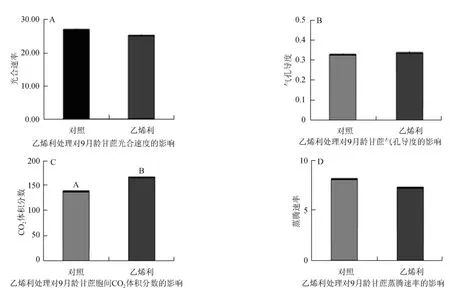
图2 乙烯利影响甘蔗光合参数的变化Fig.2 Ethephon influence sugarcane photosynthetic parameters change
3.4 实时荧光定量PCR引物的特异性检测
为验证反转录效果,在进行定量PCR之前,采用GAPDH引物进行常规PCR扩增。取1μL扩增产物用3%琼脂糖凝胶电泳检测,扩增产物条带明显,单一,无杂带,亮度一致,且产物的大小与理论相符(图4)。选择STK6进行不同组织的常规PCR,结果见图5。1~6分别为根、老茎、嫩茎、嫩叶、鞘、芽,大小约200bp,条带单一,较清晰,表明反转录效果良好,引物特异性好,可用于后续的实时荧光定量PCR。
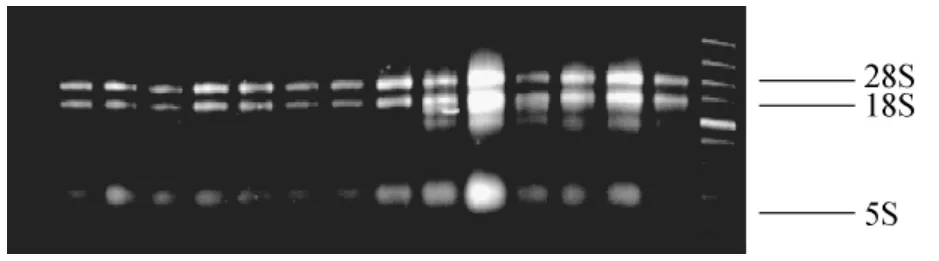
图3 Trizol试剂提取总RNA的电泳图Fig.3 The agarose gel electrophoresisdetection of total RNA extracted by Trizol method
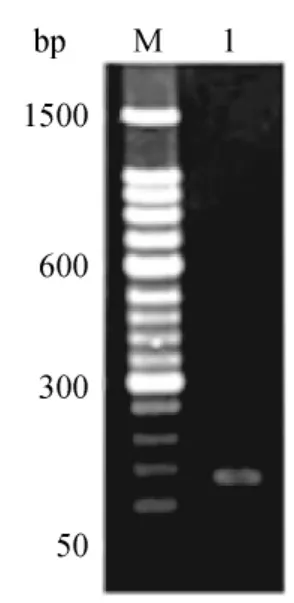
图4 甘蔗GAPDH基因PCR产物Fig.4 PCR products of GAPDH gene from sugarcane
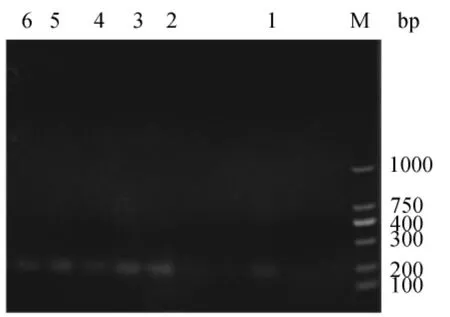
图5 STK6不同组织常规PCRFig.5 STK6 conventional PCR in different organizations
3.5 实时荧光PCR反应条件的优化
分别选取稀释不同倍数的不同基因的反转录产物作为模板,在预设条件温度下进行扩增反应,选取GAPDH的扩增曲线(图6)来判断最优稀释倍数,4-0和4-1倍稀释的反转录产物都可用于PCR扩增反应,为了节省样品量,本实验选择4-1倍稀释的反转录产物作为后续实时荧光定量PCR反应的模板,60℃为最适退火/延伸温度。
3.6 甘蔗STK家族基因不同组织表达差异分析
经过荧光定量PCR扩增之后,收集退火/延伸时期的荧光参数,以根组织为参照,得到STK基因家族在不同组织的相对表达量的变化情况(图7、图8)。STK1:鞘>老茎>老叶>嫩叶>嫩茎>芽>根,STK2:嫩茎>老茎>鞘>老叶>嫩叶>芽>根,STK3:老叶>鞘>嫩茎>嫩叶>老茎>根>芽,STK4:鞘>老茎>老叶>嫩茎>嫩叶>根>芽,STK5:嫩叶>鞘>老叶>芽>嫩茎>根>老茎,STK6:鞘>老叶>嫩叶>嫩茎>芽>根>老茎,STK7:嫩茎>老茎>芽>嫩叶>鞘>根>老叶。该家族中各基因在各个组织中的表达情况是不同的,但多数基因是在鞘和嫩叶、嫩茎中表达量较高。STK2、STK7在茎中表达量高,STK3在老叶中表达量高,STK5的嫩叶表达量高,但与叶鞘和老叶差异不大。为了显示STK基因家族在甘蔗各组织的表达情况,本实验采用SYBR Green Ⅰ染料法定量分析该基因家族各基因的表达情况。同一时间段同一植株取各组织样品,且取3个平行植株,并混合所有样品,以排除单株之间的差异。每次实验每个样品做3个重复,对偏离比较严重的ΔCt值除去,然后取剩余2个的平均值,以排除在加样过程中存在的偏差。另外,做3次独立重复的实验,对比3次实验结果后发现,基因表达量的差异小,由此证明实验数据可靠。
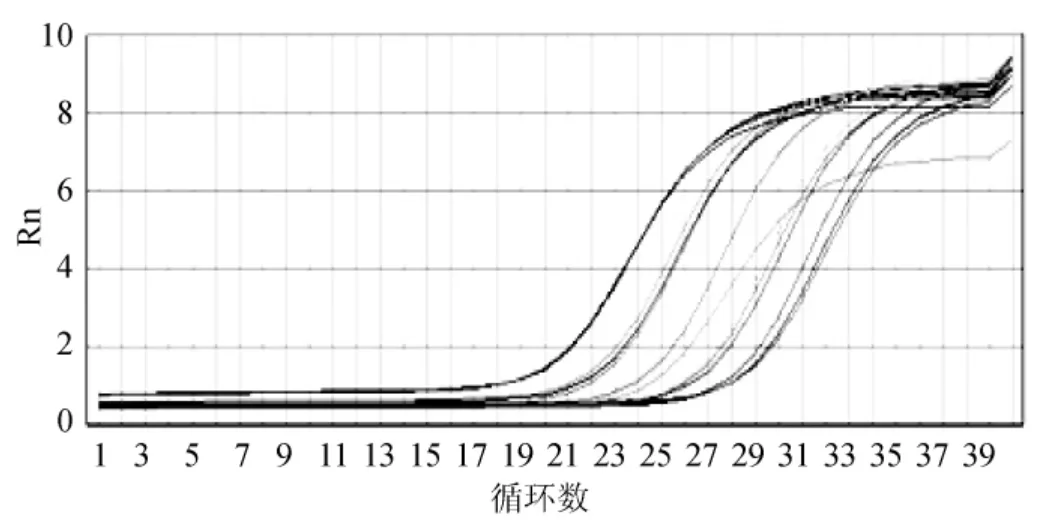
图6 GAPDH不同稀释倍数的扩增曲线图Fig.6 GAPDH amplification plot of different dilution
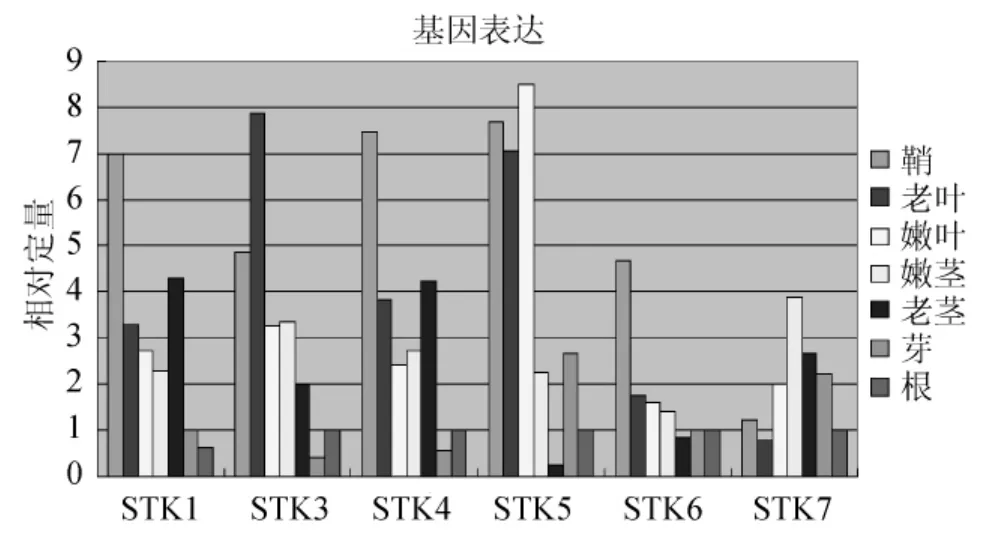
图7 STK家族基因实时荧光定量PCRFig.7 STK family gene real-time fluorescence quantitative PCR
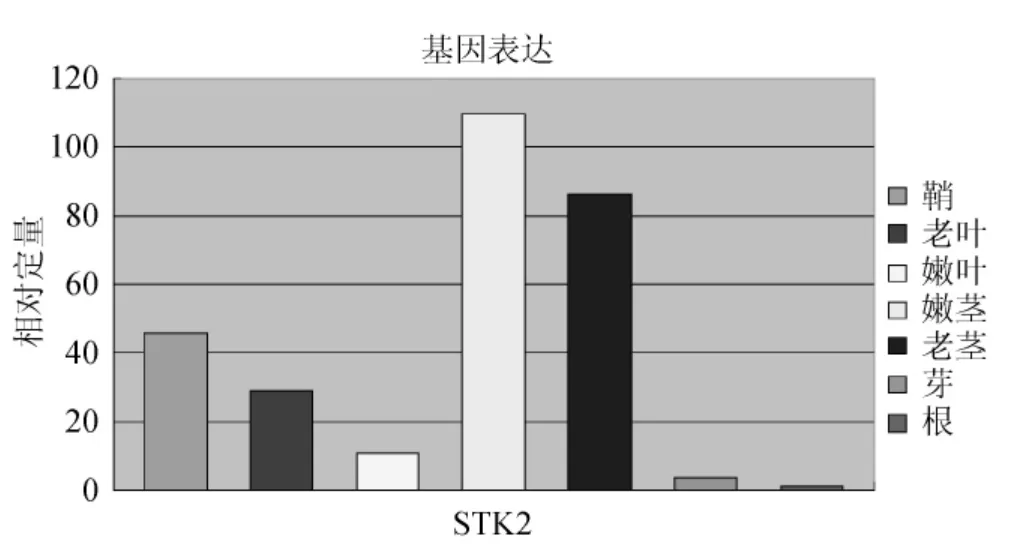
图8 STK2基因实时荧光定量PCRFig.8 STK 2 gene real-time fluorescence quantitative PCR
4 结论与讨论
光合作用是植物体内最为重要的同化过程,光合速率的测量是研究植物光合性能、诊断植物的光合机构的运转、研究环境因素对光合作用的影响的重要方法[8]。本实验的九月龄甘蔗在乙烯利的处理下,光合速率下调,气孔导度上调,胞间CO2上调,蒸腾速率下调,但是变化幅度不大,即乙烯利对光合作用影响不大,对光合产物的积累和转化,糖代谢的信号调控的影响微弱。同时,在基因表达的分析中,RNA转录的稳态水平是检测细胞和组织的基因表达活性的最方便的参数之一[9-10]。实时荧光定量PCR技术,既能定性又能定量的优势使其成为基因转录水平研究的良好手段,其精确、快速的特点则使其目前在分子遗传学领域得到广泛应用[11-14]。本实验提取的甘蔗各组织RNA,通过分析STK基因家族在甘蔗各组织中的组织表达差异时发现,该家族中各基因在各个组织中特异表达的基因是不同的,但多数基因是在鞘和嫩叶、嫩茎中表达量较高。STK2、STK7在茎中表达量高,可能是参与茎中蔗糖贮存的主要STK基因;STK3在老叶中表达量高,STK5的嫩叶表达量高,但与叶鞘和老叶差异不大,这2个基因可能是参与叶中蔗糖转化的主要STK基因。该4个基因可能在甘蔗糖代谢的信号调控中起主要作用。
本研究目的是通过光合参数测定来研究植物光合性能、诊断植物的光合机构的运转、研究环境因素对光合作用的影响。通过测定STK基因在不同组织表达情况,分析甘蔗STK基因家族的组织表达差异。即使对于甘蔗STK基因的调控机制不是完全清楚,但是,甘蔗的生长发育过程中,在以碳水化合物收支平衡的基础上,与蔗糖合成代谢相关酶,如蔗糖合成酶(SS)[15]、蔗糖磷酸合成酶(SPS)和转化酶(Inv),这些酶基因都受到转录调控系统的支配,STK调控的信号转录系统可能调控着蔗糖合成代谢途径。
[1]黄东杰,张树珍,范海阔,等.甘蔗的蔗糖代谢[J].植物生理学通讯,2006,42(4):755-760.
[2]胡 巍,张积森,叶冰莹.甘蔗蔗糖磷酸合成酶磷酸化位点的突变及相应表达载体的构建[J].亚热带农业研究,2010,6(4):280-283.
[3]陈 玲,叶冰莹,黄贞杰,等.甘蔗丝氨酸/苏氨酸激酶基因的克隆及序列分析[J].亚热带农业研究,2012(3):194-198.
[4]蔡 冲,吕均良,陈昆松.蛋白激酶的研究(综述)[J].亚热带植物科学,2002,31(1):63-67.
[5]蔡新民,邵春喜,黄文兴.乙烯利对玉米生产性能影响的试验[J].玉米科学,1998(S1):88-89..
[6]Kenneth J.Livak and Thomas D.Schmittgen.利用实时定量PCR 和2-△△Ct法分析基因相对表达量[J].方法,2001,25:402-408.
[7]唐兆前,李 力,张 玮,等.卵巢癌细胞卡铂耐药相关肿瘤抑制基因的表达变化及其启动子区甲基化观察[J].山东医药,2010(18):904-907.
[8]贾凌云,孙 坤,冯汉青,等.呼吸作用对叶片光合作用和异戊二烯释放的影响[J].植物科学学报,2012,30(2):193-197.
[9]卫赛赛,杨 敏,许正平.真核生物rRNA 基因的转录调节[J].中国生物化学与分子生物学报,2007(11):888-893.
[10]祁云霞,刘永斌,荣威恒.转录组研究新技术:RNA-Seq 及其应用[J].遗传,2011,33(11):1191-1202.
[11]白卫滨,黄亚东,柳忠玉.利用荧光定量PCR 技术快速检测转基因产品的研究[J].食品工业科技,2006(1):193-195.
[12]王式春,徐亚军,刘 渠.荧光定量PCR 在肺结核临床诊断及疗效评估中的应用[J].华南预防医学,2011(5):14-18.
[13]赵 丽,赵绪永,陈红英.PPV SYBR GreenⅠ实时荧光定量PCR 检测方法的建立及应用[J].西北农林科技大学学报:自然科学版,2012(5):27-31.
[14]袁 森,田明尧,崔鹤馨.人干扰素诱导跨膜蛋白基因实时荧光定量PCR 检测方法的建立[J].中国生物制品学杂志,2013(5):131-137.
[15]滕建北,万德光,蔡 毅.美花石斛蔗糖合成酶活性动态研究[J].安徽农业科学,2012,39(2):644-645.
