氯化锶对去透明带卵母细胞孤雌激活效果及孤雌胚胎体外发育体系的研究
2012-11-14邓玉金赵海龙李跃民
何 允,肖 雄,邓玉金,赵海龙,李跃民
(西南大学动物科技学院胚胎工程研究室,重庆 400715)
卵母细胞的激活是动物克隆技术中的关键步骤之一,应用于细胞核移植及孤雌胚胎干细胞分离培养等环节,可通过不同途径实现[1]。其中SrCl2作为一种常用激活剂,能够对MⅡ期卵母细胞进行化学激活[2]。在激活处理过程中,透明带不为胚胎活化发育所必须[3],且去透明带卵母细胞孤雌激活率高于全胚细胞直接激活率[4]。故本实验采用不同浓度SrCl2激活剂对去透明带卵母细胞进行激活,在最适作用时间条件下讨论浓度对激活效果及发育率的影响。此外本实验对孤雌胚胎体外条件培养体系进行了优化,将常规培养液培养发育效果与添加LIF因子培养液培养发育效果进行了比较。
1 材料与方法
1.1 实验动物及主要试剂
实验动物为6~8周龄性成熟昆明系小鼠,购自重庆市中药研究所。
主要试剂:孕马血清促性腺激素(PMSG)及人绒毛膜促性腺激素(hCG)为宁波第二激素厂生产,SrCl2、LIF因子及其他药品均购自Sigma公司。
1.2 MⅡ期卵母细胞的获取
雌性小鼠经腹腔注射PMSG10IU/只,48h后注射hCG 10IU/只。注射hCG18h后颈椎脱臼处死小鼠,常规外科方法无菌获取输卵管。所得输卵管以M2液漂洗3遍后,撕破膨大部收集卵丘-卵母细胞复合体,以0.1%透明质酸酶37℃处理3~5min获得卵母细胞。
1.3 卵母细胞去透明带处理
将上述卵母细胞以0.5%链霉蛋白酶37℃处理1min,待透明带分层膨胀后以内径略小于透明带的吸管轻轻吹打至透明带脱落,所得裸卵细胞经M2液洗涤后放入37℃、5%CO2培养箱中备用。
1.4 不同浓度氯化锶对去透明带卵母细胞的孤雌激活
以 5mmoL/L、10mmoL/L、20mmoL/LSrCl2激活处理去透明带卵母细胞6h。将激活后的卵母细胞移入DMEM培养液培养48h并记录发育情况。
1.5 LIF因子对孤雌胚胎体外成熟的影响
以适宜浓度的SrCl2激活液对去透明带卵母细胞激活处理6h,将激活的卵母细胞以DMEM培养液或添加10ng/mL LIF的DMEM培养液洗涤3遍,移入DMEM培养液或含LIF的DMEM液滴中培养48h并统计发育情况。
1.6 数据处理
试验数据以“平均数±标准差”表示,采用SPSS13.0软件进行单因素方差分析(One-Way-ANOVA)。
2 结果
2.1 不同浓度氯化锶对去透明带卵母细胞的激活效果
由表 1 可知,以5mmoL/L、10mmoL/L、20mmoL/LSrCl2对去透明带卵母细胞进行6h激活处理,激活率分别为40.38%、46.00%、24.62%。10mmoL/LSrCl2卵裂率与5mmoL/LSrCl2差异不显著(P>0.05),但发育到桑葚胚阶段的细胞比率显著高于5mmoL/L(44.00%vs28.85%,P<0.05);两组的卵母细胞卵裂率及桑葚胚率均显著高于20mmoL/L(P <0.05)。
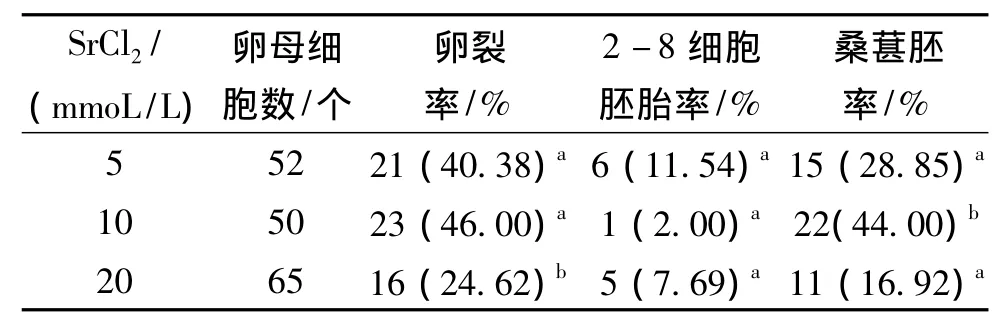
表1 不同浓度对小鼠去透明带卵母细胞孤雌激活的影响
2.2 LIF因子对孤雌胚胎体外培养效果的影响
以10mmoL/L激活6h的卵母细胞用不同培养液培养48h后得到表2所示结果。常规DMEM培养液中有43.40%活化胚胎发育到桑葚胚阶段,而在LIF+DMEM条件体系下达到了84.62%桑葚胚率,两组相比差异显著(P<0.05)。

表2 LIF因子对孤雌胚胎体外培养效果的影响
3 讨论
小鼠的卵母细胞透明带韧性较大,质膜脆弱,使用0.5%链霉蛋白酶去除透明带后能够提高化学激活剂效率[5],使SrCl2激活剂的Sr2+更容易通过细胞膜上Ca2+通道进入细胞;Sr2+进入细胞后经磷酸肌醇途径置换内源性Ca2+,使细胞内游离Ca2+浓度上升,从而诱导人工激活卵母细胞[6]。SrCl2的激活效果受浓度与作用时间因素影响[7],本实验结果表明:经10mmoL/LSrCl2处理的卵母细胞发育更易发育至桑葚胚,效果优于5mmoL/L及20mmoL/L实验组。
LIF因子通常由成纤维细胞(MEF)饲养层分泌,且其分泌量随MEF细胞传代数增加而减少[8]。6代以后的MEF细胞几乎不再分泌LIF,杂质细胞数量增加。MⅡ期卵母细胞经孤雌激活后不依靠饲养层就可进行体外培养,直接向DMEM培养液添加母源性LIF因子能够显著提高胚胎发育率,并强化其活性[9]。有研究表明,卵母细胞在2~10ng/L浓度LIF最适作用于其体外成熟率[10]。在本实验中,去透明带卵母细胞经SrCl2激活剂作用后,以LIF+DMEM培养48h能够达到84.62%桑葚胚发育率。
[1]李永强,武建中,王建华,等.小鼠卵母细胞孤雌激活及孤雌胚体外培养研究[J].畜牧兽医科技信息,2008,27(12):24 -26.
[2]Meo S C. Activation and early parthenogenesis of bovineoocytes treated with ethanol and strontium [J]. AnimalReproduction Science,2004,81 ( 9) : 35 - 46.
[3]刘胜根,刘军,孙健红,等.小鼠无透明带胚胎培养方法的优化[J].农业生物技术学报,2008,16(2):270-275.
[4]邵华,茫烈,其木格,等.去除卵丘细胞的小鼠卵母细胞体外成熟过程中的超微结构变化[J].畜牧与饲料科学,2006,27(2):17 -19.
[5]Bronson R A,Cooper G. W,Rosenfeld D L. et al. Theeffect of an IgA1 protease on immunoglobulin bound to thesperm surface and sperm cervical mucus penetrating ability[J]. Fertil Steril,1987,47( 6) : 985 - 991.
[6]Ma S F. Parthenogenesis activation of mouse oocytes bystrontium chloride: A search for the best conditions [J].Theriogeology,2005,64: 1142 - 1157.
[7]孟庆刚,朱士恩,常影,等.小鼠卵母细胞氯化锶激活条件[J].中国兽医学报,2002,22(4):321-324.
[8]Lavranos T C. Trophic effects of myeloid leukemia inhibitoryfactor ( LIF) on mouse embryos[J]. Reprod Fertil,1995,105: 331 - 338.
[9]周敏敏,丁海雷,钱红娟,等.LIF对小鼠卵母细胞体外成熟和体外受精效果的影响[J].上海畜牧兽医通讯,2008(3):38-39.
[10]张炜,周剑萍,张俊慧,等.LIF对体外培养小鼠孕早期胚胎发育及ICAM-1表达的影响[J].上海医科大学学报,1999,26(4):255 -257.
