鸭肠炎病毒gL蛋白在鸡胚成纤维细胞中动态表达的检测
2012-09-11李慧昕韩宗玺邵昱昊刘小丽孔宪刚
李 冰,李慧昕,王 钰,韩宗玺,邵昱昊,刘小丽,孔宪刚
(中国农业科学院哈尔滨兽医研究所禽传染病研究室/兽医生物技术国家重点实验室,黑龙江哈尔滨150001)
鸭病毒性肠炎(Duck viral enteritis,DVE)是由鸭肠炎病毒(DEV)引起的鸭、鹅及多种雁型目禽类的一种急性、败血性传染病。该病于1923年首次在荷兰报道[1],后陆续在多个国家均有报道,1967年至1995年间,美国多个州爆发鸭病毒性肠炎疫情[2]。我国于1957年由黄引贤首次报道该病[3],该病多发生于养鸭业较发达的地区,给养鸭业造成重大的经济损失[4]。
DEV为疱疹病毒科成员[5],基因组为双股线性DNA。DEV粒子具有疱疹病毒的典型特征[6],其囊膜糖蛋白主要包括 gB、gC、gD、gE、gH、gI、gK、gL、gM、gN和gJ。目前已知疱疹病毒侵入细胞至少需要4种糖蛋白的参与,即gB、gD、gH及gL。首先,gD作为受体结合蛋白,与宿主细胞膜上的受体相结合,激活膜融合系统,随后由gB和gH/gL二聚体执行膜融合功能[7]。gL蛋白必须与gH蛋白形成二聚体才能发挥其膜融合功能,在病毒的入侵及细胞与细胞间感染中,gL蛋白能够促进gH蛋白在感染细胞内进行正确折叠并转运至细胞膜表面[8]。有研究表明,这两种蛋白的共表达能够刺激机体产生中和抗体[9],在诱导机体产生免疫应答作为保护性免疫方面也起到重要作用[10]。
本研究对DEV gL蛋白进行原核表达并制备抗血清,检测gL蛋白在病毒复制过程中的动态表达情况,为其生物学功能的研究奠定基础,同时也为进一步研究gL蛋白在DEV侵染过程中的功能提供依据。
1 材料和方法
1.1 主要实验材料 DEV Clone-03株和293T细胞由本研究室保存;E.coli感受态细胞TG1、BL21(DE3)及鸡胚成纤维原代细胞(CEF)由本研究室制备;pMD18-T购自TaKaRa公司,pET-30a和pcDNA3.1(+)购自Novagen公司。
1.2 酶类及主要生化试剂 T4DNA连接酶、Ex Taq DNA聚合酶和各种限制性内切酶购于TaKaRa公司;基因组DNA提取试剂盒、质粒提取试剂盒及胶回收试剂盒购于Axygen公司;ProBondTMPurification System纯化试剂盒购自Invitrogen公司;转染试剂Fermentas TurboFect购于MBI公司;羊抗鼠IgG-HRP、羊抗鼠IgG-FITC及弗氏佐剂购于Sigma公司。
1.3 实验动物 9日龄SPF鸡胚和8周龄雌性BALB/c小鼠由中国农业科学院哈尔滨兽医研究所实验动物中心提供。
1.4 引物设计 根据GenBank中登录的DEV Clone-03UL1基因序列(NC_013036)设计引物。原核表达引物,L1t:5'-GGATCCGAAACTTCCTGTAGT TACCC-3'(Bam HⅠ)和 L2:5'-CACCATGGCCGACG ATAGGAATTC-3'(EcoRⅠ)。真核表达引物L1:5'-GGATCCATGGGTTCCAGATGGAAG-3'(Bam HⅠ)和L2:5'-CACCATGGCCGACGATAGGAATTC-3'(EcoRⅠ)。引物由上海生工生物工程技术服务有限公司合成。
1.5 目的基因的扩增及重组质粒的构建 以DEV Clone-03基因组DNA为模板,用引物L1t和L2扩增gLt(181bp~711bp)基因片段;以引物L1和L2扩增gL(1bp~711bp)基因片段。PCR反应程序为:95℃ 5m in;95℃ 50s、55℃ 50s、72℃ 1m in,30个循环;72℃7min。切胶回收目的片段,将目的片段分别克隆至pMD18-T载体,转化至感受态细胞TG1。经PCR和序列测定鉴定,通过Bam HⅠ和EcoRⅠ对其进行双酶切,分别亚克隆至以相同酶切处理的原核pET-30a和真核pcDNA3.1(+)表达载体中,转化至TG 1感受态细胞中。提取重组质粒,经酶切鉴定及序列测定,重组质粒分别命名为pET-gLt和 pcDNA-gL。
1.6 gLt重组蛋白的表达及纯化 pET-gLt转化至BL21(DE3)感受态细胞,经终浓度为0.6mM的IPTG诱导培养4h,经12%SDS-PAGE电泳分析表达情况。重组菌以7M盐酸胍进行裂解,经超声破碎后离心收集上清。应用ProBondTMPurification System纯化系统进行蛋白纯化(按照说明书操作)。采用0.01M PB缓冲液对纯化后的gLt重组蛋白进行透析及PEG6000对重组蛋白进行浓缩,紫外吸收法测定蛋白浓度。
1.7 鼠抗gLt抗体的制备 将重组蛋白免疫8周龄BALB/c小鼠进行抗体制备,免疫剂量为100μg/只。首次免疫使用弗氏完全佐剂,加强免疫使用弗氏不完全佐剂,每两周加强免疫一次,共免疫3次。末次免疫后7d,对小鼠进行眼球采血,分离抗gLt血清。
1.8 gL蛋白的真核表达检测 采用Fermentas TurboFect转染试剂,将pcDNA-gL转染至单层的293T细胞(按说明书操作)。收集转染后6h~72h的293T细胞,进行western blot检测[11]。以制备的鼠抗gLt抗体为一抗(1:300),以羊抗鼠IgG-HRP(1:5000)为二抗,通过3,3'-二胺基联苯胺(DAB)显色进行western blot检测。
1.9 gL在病毒感染CEF中表达的检测
1.9.1gL表达的间接免疫荧光(IFA)检测以0.001MOIDEV接种CEF单层,在感染后6h~72h进行检测。将感染DEV的CEF用4%多聚甲醛固定,以制备的鼠抗 gLt抗体(1∶300)为一抗,以羊抗鼠IgG-FITC(1∶80)为二抗,荧光显微镜观察结果。
1.9.2gL表达的western blot检测以0.001MOI DEV接种CEF单层,在感染后6h~72h收集细胞,同时设未感染DEV的CEF作为阴性对照。以制备的鼠抗 gLt抗体为一抗(1∶300),以羊抗鼠IgG-HRP(1∶5000)为二抗,通过DAB显色。
2 结果
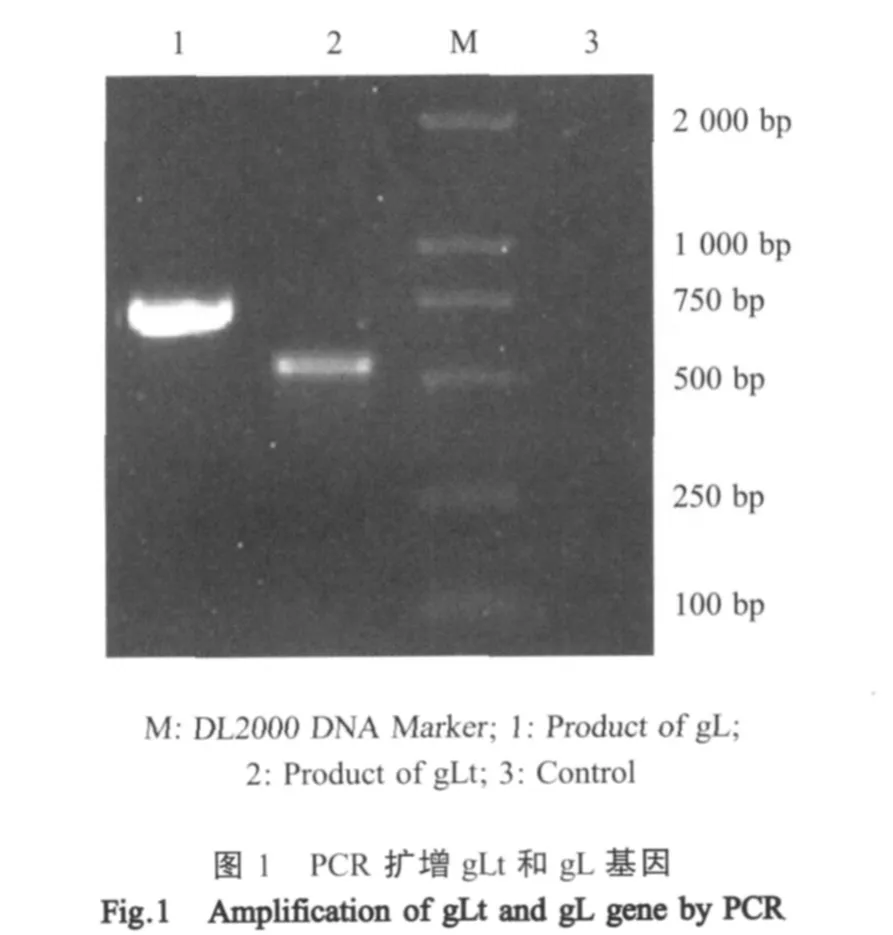
2.1 目的基因的PCR扩增结果 以DEV Clone-03基因组为模板,用引物L1t和L2、L1和L2分别扩增出约500bp和700bp左右的片段,序列测定结果表明,gLt基因片段为543bp,gL基因为711bp(图1)。
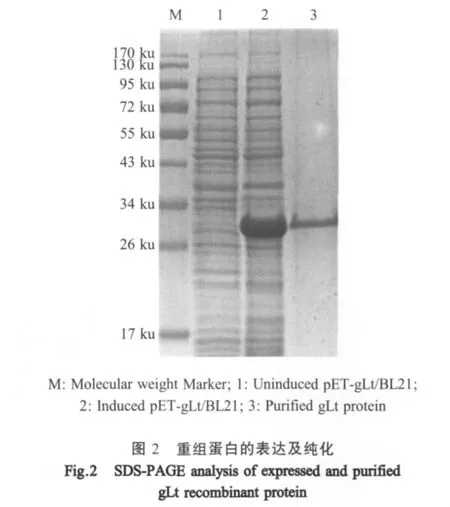
2.2 gLt重组蛋白的表达及纯化 将构建的重组质粒pET-gLt转化BL21(DE3)感受态细胞,经0.6mM IPTG诱导4h。经SDS-PAGE检测结果表明,gLt重组蛋白获得了大量表达,其分子量约为27ku,而未诱导重组菌无明显的目的蛋白条带。纯化并复性后的重组蛋白经SDS-PAGE电泳分析,结果显示为一条单一的蛋白条带(图2)。
2.3 gL蛋白真核表达检测 将pcDNA-gL转染293T细胞,经western blot检测结果显示,转染后12h能够检测到gL蛋白少量表达,转染后24h检测到gL蛋白明显表达,随着转染时间增加gL表达量增加,转染后72h gL蛋白表达量最高。检测的gL蛋白大小约为20ku。而转染空载体的293T细胞以及未转染的293T细胞则未检测到相应的蛋白条带(图 3)。

2.4在DEV复制过程中gL蛋白表达检测 将DEV感染CEF,IFA检测结果表明,其感染后6h和12h时未检测到gL蛋白的表达,在24h时可在CEF中检测到gL蛋白的表达,48h和72h能够检测到gL蛋白的明显表达,随着时间的增长gL蛋白的表达量增加(图4)。
Western blot检测结果显示,DEV感染6h、12h和24h后,均未检测到gL蛋白的表达;直到48h开始检测到gL蛋白明显的表达,在感染后72h,gL表达量增加;gL蛋白分子量大小约为20ku,与gL在真核表达中检测到的蛋白条带大小相符(图5)。

4 讨论
DEV gL蛋白由UL1基因编码,ORF全长711个核苷酸,编码由236个氨基酸残基组成[11],其非糖基化状态分子质量约为26.22ku。在疱疹病毒成员中,UL1基因的编码的氨基酸序列相对保守,但在核苷酸序列上差异较大[12]。目前,以HSV-1各蛋白功能研究较为深入,已有报道,HSV-1gL蛋白与gH蛋白以异源二聚体的形式发挥功能,成熟的gL蛋白没有跨膜区,但具有可裂解的信号肽。gL蛋白是一种I型糖蛋白,与gH蛋白共表达并锚定于细胞膜上;而且,gH需要gL辅助进行正确加工、折叠及转运到内质网膜上[13]。
本研究曾试图对DEV gL基因全长进行原核表达,但是未获得成功。利用Signal P 3.0在线分析软件分析DEV gL蛋白,结果表明gL蛋白是膜锚定蛋白,Cys64-Ser65位氨基酸是其信号肽裂解位点,因此本研究在对gL蛋白进行原核表达时将gL蛋白N末端60个氨基酸截掉,获得了分子量约为27ku的重组蛋白,这与预期大小为20ku蛋白有些差异,分析出现差异的原因可能为原核表达载体pET-30a携带6His-tag。已有研究表明,组蛋白含量多的肽链具有异常高的正电荷,在进行SDS-PAGE时,组蛋白所带的正电荷不能被结合的SDS所带的负电荷覆盖,导致其迁移率变慢,从而使其表观分子质量大于实际分子质量[14]。
为了探讨gL蛋白在病毒复制过程中表达情况,本研究利用制备的鼠抗gL蛋白抗体检测DEV感染CEF后gL蛋白的表达情况。在DEV感染的早期即感染后6h和12h均未能够检测到gL蛋白的表达,在DEV感染后24h,应用IFA方法检测到了该蛋白的表达,由于此时gL蛋白表达量较小,western blot未检测到其表达。将gL转染293T细胞后12h,western blot即检测到gL蛋白的表达,而DEV感染CEF后48h才能检测到gL蛋白的表达,表明编码gL蛋白基因可能是病毒复制的晚期表达基因,其表达受病毒其它基因的调控,这有待于进一步研究。Western blot检测病毒感染细胞后表达成熟的gL蛋白分子量大小约为20ku,与预期的26ku不符。由于DEV gL蛋白在Cys64-Ser65位氨基酸有裂解位点,成熟的gL其N末端的膜锚定序列被剪切掉形成成熟的蛋白,因此出现与预期大小有差异,这与HSV-1及PRV中的gL蛋白相似[15-16]。
本研究通过制备鼠抗gLt抗血清对gL蛋白在感染DEV的CEF中动态表达情况进行检测,为进一步研究gL蛋白在DEV侵染及复制中的功能及其与gH蛋白之间的相互作用奠定基础。
[1]Baudet A E.Mortality in ducks in the Netherlands caused by a filtrable virus fow l plague[J].Tijdschr Diergeneeskd,1923,50:455-459.
[2]黄引贤.拟鸭瘟的研究[J].华南农学院学报,1959,1:1-12.
[3]黄引贤,欧守抒,邝荣禄,等.鸭瘟病毒的研究[J].华南农学院学报,1980,1(1):21-36.
[4]李雅林,牛钟相.鸭瘟的诊断及防治措施研究进展[J].中国动物检疫,2001,18(6):41-42.
[5]Fauquet C M,Mayo M A,Maniloff J,et al.Virus taxonomy:Eighth report of the international comm ittee on taxonomy of viruses[M].Elsevier Academ ic Press,2005.
[6]Spear P G,Roizman B.Proteins specified by herpes simplex virus.V.Purification and structural proteins of the herpesvirion[J].JVirol,1972,9(1):143-159.
[7]Harman A,Browne B,M inson T.The transmembrane domain and cytoplasm ic tail of herpes simplex virus type 1glycoprotein H Play a role in membrane fusion[J].J Virol,2002,76(21):10708-10716.
[8]Atanasiu D,Saw W T,Cohen G H,et al.Cascade of events governing cell-cell fusion induced by herpes simplex virus glycoproteins gD,gH/gL,and gB [J].J Virol,2010,84(23):12292-12299.
[9]Westra D F,Verjans G M,Osterhaus A D,et al.Natural infection w ith herpes simplex virus type 1(HSV-1)induces humoral and T cell responses to the HSV-1glycoprotein H:L complex[J].JGen Virol,2000,81(Pt8):2011-2015.
[10]Forrester A J,Sullivan V,Simmons A,et al.Induction of protective immunity with antibody to herpes simplex virus type 1glycoprotein H(gH)and analysis of the immune response to gH expressed in recombinant vaccinia virus[J].JGen Virol,1991,72(Pt2):369-375.
[11]Towbin H,Staehellin T,Gordon J.Electrophoretic transfer of proteins from polyacrylam ide gels to nitrocellulose sheets:procedure and some applications[J].Biotechnology,1992,24:145-9.
[12]Li,Hui-xin,Liu,Sheng-wang,Han,Zong-xi,et al.Comparative analysis of the genes UL1through UL7of the duck enteritis virus and other herpes viruses of the subfamily alphaherpesvirinae[J].Genet Mol Biol,2009,32(1):121-128.
[13]Dubin G,Jiang Hong-bin.Expression of herpes simplex virus type 1glycoprotein L(gL)in transfected mammalian cells:evidence that gL is not independently anchored to cell membranes[J].JVirol,1995,69(7):4564-4568.
[14]唐威华,张景六,王宗阳,等.SDS-PAGE法测定His-tag融合蛋白分子量产生偏差的原因[J].植物生理学报,2000,26(1):64-68.
[15]Peng Tao,Ponce-de-leon M,Jiang Hong-bin,et al.The gH-gL complex of herpes simplex virus(HSV)stimulates neutralizing antibody and protectsm ice against HSV type 1challenge[J].J Virol,1998,72(1):65-72.
[16]Klupp B G,Baumeister J,Karger A,et al.Identification and characterization of a novel structural glycoprotein in pseudorabies virus gL[J].JVirol,1994,68(6):3868-3878.
