Runx2和Ezrin基因在骨肉瘤组织中的表达及其临床意义
2012-08-14闵大六沈赞林峰徐晓丽黄文涛姚阳
闵大六 沈赞 林峰 徐晓丽 黄文涛 姚阳
1. 上海交通大学附属第六人民医院肿瘤内科,△病理科,上海 200233;2. 复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032
骨肉瘤是儿童和青少年最常见的原发性骨恶性肿瘤,其发病原因目前仍不清楚。Runx2是在骨母细胞分化和骨形成中起重要作用的基因,其在骨肉瘤中的作用还不甚清楚。Ezrin是细胞骨架连接膜蛋白,与多种恶性肿瘤如乳腺癌、结直肠癌等的浸润转移有关。本研究拟通过检测骨肉瘤组织中Runx2和Ezrin的表达,探讨二者表达的相关性及其与临床生物学行为之间的关系。
1 资料和方法
1.1 临床资料
收集上海交通大学附属第六人民医院肿瘤内科2002年1月—2008年5月间临床资料完整的骨肉瘤穿刺活检组织石蜡样本82例。术前均未作过任何化疗或放疗。所有病例均有完整的随访记录,随访时间为3~88个月,中位随访时间为42个月。
1.2 主要试剂及方法
鼠抗人Runx2单克隆抗体购自 Abnova公司,兔抗人Ezrin单克隆抗体购自Dako公司。所有组织均为10%甲醛溶液固定,常规脱钙,石蜡包埋,4 μm连续切片,免疫组化采用SP法,按试剂盒说明操作。以随试剂盒提供的已知阳性切片作为阳性对照,以PBS代替一抗作为阴性对照。
1.3 免疫组化结果判定
以细胞核或细胞质中出现棕黄色颗粒为阳性。每张切片随机选择10个高倍视野,以阳性细胞计数占同类细胞的百分数作为计数点,取其平均值为该病例的细胞阳性率,并据此对染色结果进行评分:阳性细胞率<10%为0分;阳性细胞率11%~25%为1分;阳性细胞率26%~50%为2分;阳性细胞率>5 0%为3分。同时根据染色强度加以评分,无着色为0分;浅黄色为1分;棕黄色为2分;棕褐色为3分。最后根据阳性细胞率与染色强度评分的乘积进行最后评分,0分为阴性,≥1分为阳性。
1.4 统计学处理
应用SPSS 18.0统计学软件进行分析。计数资料采用χ2检验与Fisher确切概率检验;相关性采用Pearson相关分析。生存分析采用Kaplan-Meier方法,Log-rank检验。P<0.05为差异有统计学意义。
2 结 果
2.1 骨肉瘤样本资料的临床特征
本研究82例骨肉瘤患者中,男性44例、女性38例。年龄7~62岁,其中20岁以上为26例,中位年龄19岁。病变发生于肢体61例,其中股骨35例、胫骨18例、肱骨6例,腓骨2例;发生于躯干21例,其中骨盆10例,上颌骨4例,跟骨4例,椎体2例,肋骨1例。组织类型为普通型75例,其中骨母细胞性骨肉瘤27例,软骨母细胞性骨肉瘤23例,纤维母细胞性骨肉瘤17例,其他亚型8例;非普通型7例,其中血管扩张性骨肉瘤3例,去分化骨旁骨肉瘤2例,小细胞骨肉瘤2例。按照Eneeking分期,Ⅱ期55例,Ⅲ期(均合并肺转移)27例。碱性磷酸酶(ALP)正常50例,ALP升高32例。
2.2 骨肉瘤组织中Runx2蛋白表达与临床参数之间的关系
本研究82例骨肉瘤组织中Runx2阳性表达54例,阳性率为65.9%。Runx2阳性表达定位于细胞核(图1A)。分析Runx2与骨肉瘤临床参数关系显示,Runx2阳性表达与年龄、性别、部位、组织类型、ALP水平无关(P>0.05),而与临床分期相关,Eneeking分期为Ⅲ期(有肺转移)的患者Runx2蛋白阳性表达率为100.0%,显著高于无肺转移者(49.1%,P<0.01,表1)。

图1 Runx2和Ezrin在骨肉瘤组织中的表达Fig.1 Runx2 (A) and Ezrin (B) expressions in osteosarcoma tissues(SP, ×200)

表1 骨肉瘤组织中Runx2表达与临床参数之间的关系Tab.1 The relationship between Runx2 expression and clinical factors in osteosarcoma
2.3 骨肉瘤组织中Ezrin蛋白表达与临床参数之间的关系
本研究82例骨肉瘤组织中,Ezrin阳性表达者49例,阳性率为59.8%。Ezrin阳性表达定位于细胞质(图1B)。Ezrin阳性表达同样与年龄、性别、部位、组织类型、ALP水平无关(P>0.05),而与临床分期相关,Eneeking分期为Ⅲ期(有肺转移)的患者Ezrin蛋白阳性表达率为96.3%,显著高于无肺转移者(41.8%,P<0.01,表2)。
2.4 骨肉瘤组织中Runx2和Ezrin表达的相关性
82例骨肉瘤组织中Runx2与Ezrin均呈阳性表达者为48例,占所有病例的58.5%。Pearson相关分析显示,Runx2与Ezrin的表达呈显著正相关(r=0.825,P<0.001,表3)。
2.5 Runx2和Ezrin表达与骨肉瘤生存期之间的关系
Runx2阳性表达者总生存期平均为(22.57±1.47)个月,中位总生存期为24个月,3年总生存率为13.7%;而Runx2阴性表达者总生存期平均为(41.41±3.21)个月,中位总生存期为46个月,3年总生存率为64.3%。Ezrin阳性表达者总生存期平均为(22.24±1.35)个月,中位总生存期为23个月,3年总生存率为12.5%;而Ezrin阴性表达者总生存期平均为(41.71±4.08)个月,中位总生存期为42个月,3年总生存率为67.7%。结果显示,Runx2和Ezrin阳性表达者生存期显著短于阴性表达者(P<0.001,图2)。
表2 骨肉瘤组织中Ezrin表达与临床参数之间的关系Tab.2 Relationship between Ezrin expression and clinical factors in osteosarcoma

表3 骨肉瘤组织中Runx2和Ezrin表达的相关性Tab.3 Relationship between Runx2 and Ezrin expression in osteosarcoma
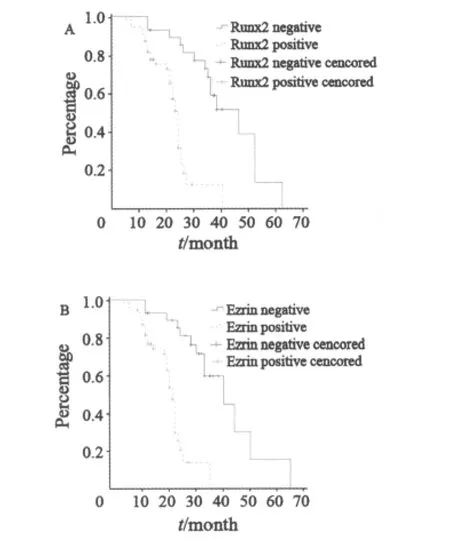
图2 Runx2和Ezrin表达对骨肉瘤患者总生存的影响Fig.2 Overall survival according to the expressions of Runx2 (A)and Ezrin (B) gene
3 讨 论
骨肉瘤是儿童和青少年最常见的原发性骨恶性肿瘤,其恶性程度高,在局部呈侵袭性生长且易发生血行性肺转移[1-2]。尽管近年来骨肉瘤的治疗采用了手术联合化疗的多学科综合治疗,患者的预后有了明显的改善,但5年总生存率仍只有60%[3]。近半数的骨肉瘤患者最终死于肿瘤的复发与转移[4-5]。
肺脏是骨肉瘤发生远处转移最常见的部位,约占骨肉瘤远处转移的90%[4]。骨肉瘤存在转移器官和组织的特异性,但其确切机制目前还不甚清楚。肺转移途径是通过肿瘤细胞血管侵犯、转移、定植形成的。近年研究发现,在机体中可能存在肿瘤细胞与转移器官微环境之间的相互作用,并涉及到宿主细胞释放的趋化因子、细胞外基质、细胞分裂因子和生长因子等因素的参与[6]。
Runx2是转录因子Runx家族成员之一,为骨母细胞特异性转录因子,在骨母细胞的发育、分化和骨形成过程中起着重要的作用[7]。本研究中,Runx2蛋白表达的阳性率为65.9%。进一步分析显示,Runx2阳性表达与患者的年龄、性别、肿瘤原发部位、组织学类型、ALP水平均无关,而与临床分期相关,有肺转移者(Ⅲ期)Runx2阳性表达率显著高于无肺转移者(Ⅱ期),提示Runx2蛋白可能参与了骨肉瘤的肺转移过程。另外,本研究结果还显示Runx2蛋白表达水平阴性与预后相关,Runx2阳性表达者的中位生存时间显著短于Runx2阴性表达者。
Runx2参与骨肉瘤肺转移形成的机制还不清楚。Pratap等[8]的研究显示,在乳腺癌和前列腺癌骨转移的癌细胞中Runx2激活了整合素,而后者是转移途径中重 要的因子之一。Zelzer等[9]研究显示Runx2可能通过激活和调节VEGF参与肿瘤早期的血管形成,后者是血行性肺转移的重要因子之一。Sun等[10]研究显示Runx2影响骨髓内皮细胞的迁移,激活MMPs、膜蛋白以及血管生成因子的表达,促进骨黏附,从而调节血管再生和肿瘤的生长。Won等[11]在一组48例骨肉瘤样本中也显示Runx2的高表达和骨肉瘤的转移有关,与本研究结果相似。Runx2在肺转移中的分子作用机制还需进一步深入研究。
Ezrin为细胞骨架连接膜蛋白,是ERM家族成员之一,生理状态下参与细胞的运动、迁移、黏附和有丝分裂等过程。研究显示Ezrin基因与多种恶性肿瘤的浸润转移有关[12]。Ezrin的过度表达及活化可导致细胞间信号传递异常,促进肿瘤细胞转移,从而在肿瘤浸润转移过程中起作用。如Ezrin蛋白可以直接与细胞基质透明质酸受体CD44分子的胞质部分发生作用,从而促进肿瘤细胞转移;Ezrin还参与了MAPK和Akt信号通路来促进肿瘤的转移。
本研究先前的研究发现Ezrin蛋白表达与骨肉瘤患者肺转移密切相关[13]。本研究中,Ezrin蛋白表达阳性率为59.8%。其阳性表达与年龄、性别、部位、组织类型、ALP水平无关,而仍与骨肉瘤肺转移有关,且与Runx2表达呈显著正相关,提示在骨肉瘤中Runx2和Ezrin可能存在相互协同作用,共同促进骨肉瘤肺转移的发生。Runx2和Ezrin之间相互作用的具体机制还有待进一步深入研究。本研究结果还提示,Runx2和Ezrin蛋白表达水平可以作为骨肉瘤的预后因子,从而指导临床预后的判断。
[1] WHELAN J, SEDDON B, PERISOGLOU M. Management of osteosarcoma [J]. Curr Treatment Opt Oncol, 2006, 7: 444-455.
[2] 姚阳, 林峰, 汤丽娜, 等. ⅡB期肢体骨肉瘤综合治疗的临床疗效分析[J]. 中国癌症杂志, 2008, 18(4): 286-290.
[3] 牛晓辉, 徐海荣, 张清. 骨肉瘤的综合治疗[J]. 中国骨肿瘤骨病, 2008,1(7): 36-39.
[4] 林峰, 汤丽娜, 姚阳. 骨肉瘤肺转移71例生存分析[J]. 肿瘤, 2009, 29(5): 471-474.
[5] TSUNEM I T, NAGOYA S, KAYA M, et al. Postoperative progression of pulmonary metastasis in osteosarcoma[J].Clin Orthop Relat Res, 2003, 407: 159-166.
[6] DUPRE’S A, REDELMANB D, HUNTER K W. Microenvironment of the murine mammary carcinoma 4T1:Endogenous IFN-γ affects tumor phenotype, growth, and metastasis [J]. Exp Mol Pathol, 2008, 85(3): 174-188.
[7] SUDHAKAR S, KATZ M S, ELANGOL N, et al. Analysis of Type-I and Type-II Runx2 Protein Expression in Osteoblasts[J]. Biochem Biophys Res Commun, 2001, 286: 74-79.
[8] PRATAP J, LIAN J B, JAVED A, et al. Regulatory roles of Runx2 in metastatic tumor and cancer cell interactions with bone [J]. Cancer Metastasis Rev, 2006, 25: 589-600.
[9] ZELZER E, GLOTZER D J, HARTMANN C, et al. Tissue specific regulation of VEGF expression during bone development requires Cbfa1/Runx2 [J]. Mech Dev, 2001,106: 97-106.
[10] SUN L, VITOLO M, PASSANITI A. Runt-related gene 2 in endothelial cells: Inducible expression and specific regulation of cell migration and invasion [J]. Cancer Res, 2001, 61:4994-5001.
[11] WON K Y, PARK H R, PARK Y K. Prognostic implication of immunohistochemical Runx2 expression in osteosarcoma[J]. Tumori, 2009, 95(3): 311-316.
[12] HUNTER K W. Ezrin, a key component in tumor metastasis[J]. Trends Mol Med, 2004, 10:201-204.
[13] XU-DONG S, ZAN S, SHUI-ER Z, et al. Expression of ezrin correlates with lung metastasis in Chinese patients with osteosarcoma [J]. Clin Invest Med, 2009, 32: 180-188.
