15例腺泡状软组织肉瘤的临床特点及预后分析
2012-08-14孙馨郭卫杨荣利唐顺董森
孙馨 郭卫 杨荣利 唐顺 董森
北京大学人民医院骨与软组织肿瘤治疗中心,北京 100044
腺泡状软组织肉瘤(alveolar soft part sarcoma,ASPS)是一种组织来源不明的恶性软组织肿瘤,多数发生于青年,免疫组化诊断结果显示,ASPS表达肌源性和神经源性标志物。在2002年的WHO软组织肿瘤分类中,仍被划归为组织来源不明恶性软组织肿瘤[1]。
ASPS是一种罕见的软组织肉瘤,发病率低,占全部软组织肉瘤的0.5%~1.0%[2]。ASPS好发年龄是15~30岁,可发生在身体任何部位,成年人好发于四肢,青少年好发于头颈部软组织[3]。临床上常表现为无痛性深部软组织肿块。特点是生长缓慢,但易复发(局部复发率高达20%)[4]。转移发生早,播散快。最常见的是肺转移,其次是脑、骨转移等[5]。文献报道其预后并不乐观,未发生转移的患者5年生存率为60%~71%,但是有远处转移的患者5年生存率仅为10%[4,6]。由于ASPS发病率低,鲜有相关报道。本研究回顾性分析了北京大学人民医院骨与软组织肿瘤治疗中心以往收治的15例ASPS患者的临床特征、治疗效果及预后,以期能制定更好的治疗方案,改善患者生活质量并延长生存时间。
1 资料和方法
1.1 临床资料
收集2003年1月—2008年12月就诊于北京大学人民医院骨与软组织肿瘤治疗中心的15例ASPS患者的临床资料。患者全部为初诊病例。其中女性9例,男性6例,平均年龄29.3岁(15~63岁)。15例患者中,12例以不同部位深部软组织肿块为首发症状就诊,其中大腿5例(41.7%),臀部4例(26.7%),小腿2例(13.3%)及上臂1例(6.7%);其他3例为骨原发ASPS,且原发部位均为骨盆,累及髂骨翼2例,髋臼周围1例。原发肿瘤的大小为2.5~18 cm,平均为8 cm,其中4例直径≤5 cm,11例>5 cm。
15例患者中有9例发生了转移,其中5例就诊时即存在不同部位的转移,4例在随访期间发生了远处转移。9例患者出现肺、骨或脑转移。骨转移部位分布广泛,1例患者为原发大腿肿瘤转移至同侧耻骨,1例患者为原发髂骨转移至同侧肱骨及股骨干,还有1例为骨盆肿瘤转移至颈椎、腰椎和同侧股骨干等部位。只有2例患者接受单纯软组织肿瘤切除后发生局部复发,复发率为13.3%,骨原发肿瘤患者接受手术治疗后局部情况良好。
1.2 治疗方法
1.2.1 手术治疗
对于12例软组织原发ASPS,首选肿瘤广泛切除术,部分患者肿瘤邻近重要血管及神经,采取边缘切除术,但全部患者术后病理切缘均为阴性,未见肿瘤残存。其中1例原发于左大腿内侧及腹股沟,肿瘤累及股动脉血管,患者接受了股动脉人工血管置换术,术后恢复良好,未见局部复发。3例骨原发ASPS患者中,1例肿瘤累及左骨盆髋臼周围,行左骨盆肿瘤切除、可调式人工半骨盆置换术;1例原发右髂骨肿瘤,行右髂骨肿瘤切除术,术后2个月发现肿瘤转移至右股骨干及右肱骨,由于存在发生病理性骨折可能性(Mirels’评分),故行肿瘤刮除、骨水泥填充、钢板内固定术;另外1例就诊时即发生全身多发骨转移,右髂骨处肿瘤较大,且已突破骨皮质形成软组织包块,考虑为原发病灶,且症状较重,故行右髂骨肿瘤切除术。
1.2.2 放疗和化疗
鉴于ASPS是一种恶性程度较高的肿瘤,大多数患者术后均进行放疗及化疗等辅助治疗。放疗采用局部30 Gy以上剂量的常规分割放疗,共9例患者接受了放疗。化疗采用软组织肉瘤的化疗方案,即MAID方案:多柔比星、异环磷酰胺及氮唏米胺,共11例患者术后在本院或外院接受了化疗。
1.3 统计学处理
数据应用SPSS 18.0统计学软件进行分析。生存分析采用Kaplan-Meier方法,Log-rank检验。P<0.05为差异有统计学意义。
2 结 果
患者性别、年龄对预后的影响差异无统计学意义(P>0.05),肿瘤大小、部位及有无远处转移是影响预后的重要因素(P<0.05)。15例ASPS患者的随访时间为7~76个月,平均为26.3个月。3例骨原发ASPS患者术后未见局部肿瘤复发,但其中2例患者术后不久即发生骨转移及肺转移。12例软组织原发的ASPS患者中,有2例首次切除后局部肿瘤复发,复发率为13.3%,行再次扩大切除术,术后未见复发。
患者预后较差,其中无瘤生存6例,带瘤生存4例,死亡5例,中位生存期为42.0个月,2年生存率为62.5%,5年生存率为41.7%。12例软组织原发ASPS患者的中位生存期为49.9个月,2年生存率为67.7%,5年生存率为44.4%。3例骨原发ASPS的患者中,2例死亡,另1例随访时间较短,但术后迅速出现多处骨转移及肺转移。
发生肺转移或脑转移的患者预后极差,本组数据中死亡的5例患者均存在不同部位的转移。死亡患者的肿瘤转移情况见表1。全部15例患者总体生存情况见图1。
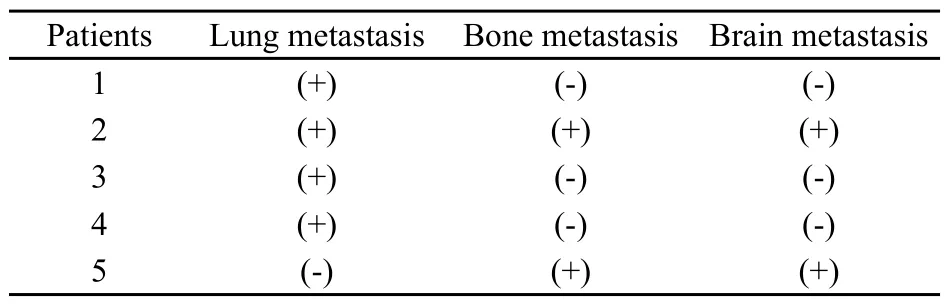
表1 5例ASPS死亡患者的转移情况Tab.1 Metastasis status of 5 died ASPS patients

图1 15例ASPS患者的生存情况Fig.1 Survival curves of 15 patients with ASPS
在接受放疗的患者中,仍有2例患者死于ASPS病情进展。4例死亡患者曾接受过化疗,还有2例患者在化疗过程中病情继续进展,出现多处转移。根据Kaplan-Meier和Log-rank对术后放疗及化疗因素进行生存分析和比较,发现患者并没有从辅助放疗及化疗中受益。
3 讨 论
ASPS是一种少见的软组织肉瘤,其组织来源至今尚不明确。有文献报道肿瘤好发于右侧肢体[7],但在本研究中未发现这种倾向。由于肿瘤生长缓慢,临床症状较少,ASPS多表现为无痛包块,容易漏诊或误诊[8]。
转移早,播散快是ASPS的特征之一,多数患者初次就诊时即存在转移,尤其是在骨原发肿瘤中最为常见。血行转移是常见的转移方式,本研究中的患者常见转移的部位分别为肺、骨及脑;Lieberman等[9]研究发现,7%的肿瘤通过淋巴途径转移,但本研究没有发现类似病例。就长期随访结果来看,很多学者认为ASPS是一种恶性程度较高的致死性疾病[10]。
本研究通过回顾临床资料,分析可能影响其预后的因素,以期指导临床治疗。但是由于样本量有限,且随访时间较短,未能通过统计学处理得出有效的影响预后的因素,只能通过大体趋势研究判断。
Lieberman等[10]研究认为,性别及肿瘤的原发部位对预后有一定影响,但本研究结果显示,性别与预后无明显相关,但原发于骨的ASPS预后明显较差,3例患者都迅速出现其他部位的转移,且系统性治疗亦不能阻止疾病进展。一般认为,ASPS的发病高峰在30岁以下[10]。本研究的研究结果显示,越年轻的患者预后越差,转移率及转移速度都要高于年长的患者。肿瘤越大,说明发病时间越长,肿瘤血供越丰富,恶性程度越高;肿瘤的大小与局部复发、转移及整体预后相关。Evans等[11]研究发现,直径>5 cm肿瘤的预后较差。本研究结果显示,ASPS的预后与肿瘤的部位、大小及手术是否彻底切除相关。对于发生在重要组织(如股血管、坐骨神经等)附近的肿瘤,由于要考虑保肢、术后功能等,即使肿瘤较小,也应尽可能采取边缘切除甚至瘤内切除的手术方式。但该方式不能达到广泛的切除边界,而肿瘤的局部彻底切除是防止复发和转移最重要的因素,这一矛盾始终困扰着临床医生。
有文献报道,发生转移的患者中位生存时间为2年[10]。本研究的分析结果显示,4例发生转移的患者仍存活,但随着随访时间延长,结果并不乐观,多数患者死于转移的并发症,尤其是发生肺转移及脑转移的患者。由于1/3的ASPS患者在初次就诊时即发现其他部位转移,因此建议,初诊时考虑为ASPS可能的患者,术前应完善胸部平片或CT、头颅CT及全身骨扫描等检查,尽早评估病情,制定合适的治疗方案;对于没有转移的患者,应尽可能采取原发部位的广泛切除,以降低转移及复发风险,以期获得良好的预后。
很多学者认为,预防性放疗和化疗对ASPS患者有一定的疗效,但是挽救性的系统治疗效果并不显著[8,12]。本研究的结果没有显示预防性治疗的效果,共3例单发肿瘤患者在接受放疗或化疗期间仍发生转移,1例患者发生局部复发;术后预防性化疗或放疗对局部复发和转移没有明显的控制作用。而对于挽救性治疗,有学者建议应切除单发转移灶[13]。本研究中的患者转移普遍发生较早,转移部位多、速度快,只能接受全身系统性治疗,但仍未获得良好的效果。由于本研究病例数较少,放化疗是否有效,还需进一步扩大样本量进行深入地研究。
[1] AUERBACH H E, BROOKS J J. Alveolar soft part sarcoma.A clinicopathologic and immunohistochemical study[J].Cancer, 1987, 60: 66-73.
[2] WEISS S W, GOLDBLUM J R. Enzinger and Weiss’s soft tissue tumors[M]. 4th edition, Mosby, St. Louis, 2001.
[3] OLGA G, GIDEON R, ARNON N, et al. Myofibroblasts in pulmonary and brain metastases of alveolar soft-part sarcoma:A novel target for treatment? [J]. Neoplasia, 2008, 10(9):940-948.
[4] AZIZI A A, HABERLER C, GUPPER A, et al. Vascularendothelial-growth-factor (VEGF) expression and possible response to angiogenesis inhibitor bevacizumab in metastatic alveolar soft part sarcoma[J]. Lancet Oncol, 2006, 7: 521-523.
[5] ENZINGER F M. Soft tissue tumors, In: Alveolar soft part sarcoma[M]. 4th Edition, USA: Moby Press, 2002.
[6] BENETOS I S, MAVROGENIS A F, SOULTANIS K C H,et al. Alveolar soft part sarcoma of the forearm: a case report[J]. J Surg Orthop Adv, 2006, 15: 209-213.
[7] ORDONEZ N G. Alveolar soft part sarcoma: a review and update[J]. Adv Anat Pathol, 1999, 6: 125-139.
[8] VAN RUTH S, VAN COEVORDEN F, PETERSE J L, et al.Alveolar soft part sarcoma: a report of 15 cases[J]. Euro J Cancer, 2002, 38(10): 1324-1328.
[9] LIEBERMAN P H, FOOTE F W Jr, STEWART F W, et al.Alveolar soft-part sarcoma[J]. JAMA, 1966, 1989(10):1047-1051.
[10] LIEBERMAN P H, BRENNAN M F, KIMMEL M, et al.Alveolar soft-part sarcoma. A clinicopathologic study of half a century[J]. Cancer, 1989, 63(1): 1-13.
[11] EVANS H L. Alveolar soft-part sarcoma. A study of 13 typical examples and one with a histologically atypical component[J]. Cancer, 1985, 55(4): 912-917.
[12] SHERMAN N, VAVILALA M, POLLOCK R, et al. Radiation therapy for alveolar soft-part sarcoma[J]. Med Pediatr Oncol, 1994, 22(6): 380-383.
[13] DAIGELER A, KUHNEN C, HAUSER J, et al. Alveolar soft part sarcoma: clinicopathological in a series of 11 cases[J].World J Surg Oncol, 2008, 6: 71.
