热灌注化疗联合TAE治疗肝癌的临床应用
2012-07-02何忠明王祁陈文华陆一峰王草叶
何忠明 王祁 陈文华 陆一峰 王草叶
肝癌包括原发性肝癌及转移性肝癌,是我国常见恶性肿瘤之一。经导管动脉栓塞术(transcatheter arterial embolization,TAE)已成为治疗肝癌的重要治疗手段。热灌注化疗:一定温度的药物直接到达肿瘤组织,具有以下优点:⑴局部药物浓度高,治疗效果好;⑵造成肿瘤细胞的热损伤,直接杀伤肿瘤细胞;⑶与化疗药物起到协同作用,提高治疗效果;⑷提高免疫力,动员患者自身免疫系统杀灭肿瘤细胞[1]。本研究通过热灌注化疗联合TAE治疗肝癌取得了一定得效果,现报道如下。
1 资料与方法
1.1 临床资料 2008年5月~2010年5月192例肝脏恶性肿瘤患者纳入本研究,其中原发性肝癌151例,转移性肝癌41例,所有患者均经AFP,影像学资料,血管造影检查或手术病理证实。其中男146例,女46例,年龄32~86岁,平均年龄55.4岁。41例转移性肝癌来源分别为肠癌16例,胃癌12例,胰腺癌8例,鼻咽癌4例,下咽癌1例。根据条件相仿原则随机分为治疗组和对照组,两组间性别、年龄、病理、分期差异无统计学意义。纳入标准:有TACE治疗适应证,且无重要器官的功能障碍,血常规、肝肾功能及心脏功能基本正常,预计生存期3个月以上。排除标准:肝功能Child-Pugh分级C级者;有TACE适应证者;合并其他心脑肺肾严重器质性疾病者。
1.2 治疗方法 治疗组:采用Seldinger技术,经股动脉途径穿刺插管至腹腔干及肠系膜上动脉后造影,明确肿瘤供血动脉后超选择性插管至肿瘤供血动脉,将导管与肿瘤介入热疗机系统相接,将所选化疗药物如方克、奥铂和吡喃阿霉素等分别加入0.9%的生理盐水或5%的葡萄糖水250mL中稀释,通过肿瘤介入热疗机将化疗药物加热至50℃~51℃,注射速率20~30mL/min,确保进入体内温度控制在41℃~43℃。然后栓塞表柔比星15mg+超液化碘油配置的乳剂4~15mL。
对照组:于肿瘤供血动脉直接灌注常温化疗药物,其它步骤同治疗组。
术后注意水化,密切观察可能出现的不良反应:血常规、肝肾功能、电解质及小便量,并给予预处理可能出现的恶心呕吐等消化道反应。
1.3 疗效评价 实体瘤缓解评估标准(RECIST):完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),以(CR+PR)/总体为有效率(RR),(CR+PR+SD)/总体为疾病控制率(DCR)。生活质量(QOL)参考KPS评分变化,以治疗后KPS增加≥10分为改善,变化<10分为稳定,减少≥10分为降低。不良反应观察指标:发热、恶心呕吐。
1.4 统计学方法 采用SPSS13.0软件包进行分析,非计量资料数据比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 疗效 治疗组和对照组术后3个月均无CR患者,治疗组术后3个月PR、SD、PD分别为34、47和15例,对照组术后3个月PR、SD、PD分别为25、43和28例,治疗组和对照组RR分别为35.4%和26.0%,DCR分别为84.4%和70.8%,两组近期有效率及疾病控制率的差异均有统计学意义(P=0.032,0.043)。
2.2 QOL评价 术后3个月治疗组的KPS评分改善、稳定和下降者分别为27、53和16例,对照组分别为11、55和30例,两组改善率+稳定率分别为:83.3%(80/96)和68.8%(66/96),差异有统计学意义(P=0.036)(见表1)。
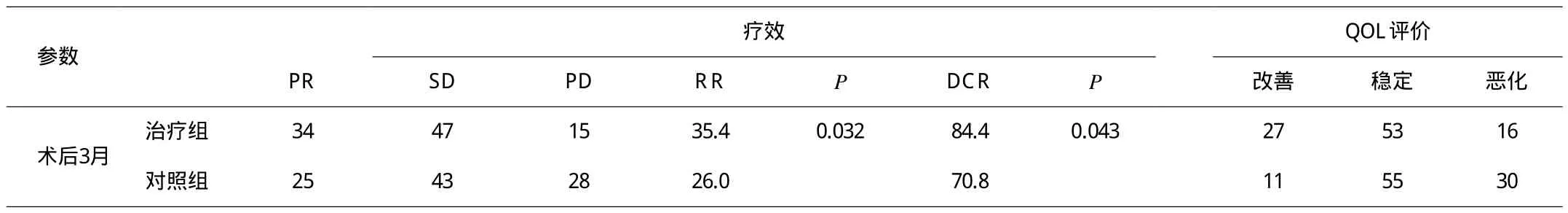
表1 两组术后3个月CR、PR、SD、PD(例),RR、DCR(%)
2.3 不良反应 热灌注过程中治疗组患者均有上腹部热胀感,部分患者出汗、心律增加,但均能耐受,治疗组74例患者出现不同程度的恶心呕吐,胸闷不适;54例患者出现术后低热。对照组69例患者出现不同程度的恶心呕吐,胸闷不适;60例患者出现术后低热,两组差异均无统计学意义(P>0.05)。
3 讨论
肝脏恶性肿瘤在我国是最常见的恶性肿瘤之一,大多数病例在确诊时已属于中晚期,未经治疗的中晚期肝脏恶性肿瘤患者的自然存生期为1~4个月[2]。中晚期肝脏恶性肿瘤的治疗手段颇多,但都有一定的局限性[3]。
热灌注化疗是选择性地使肿瘤组织内的温度升高,利用简单的物理学热效应而发挥治疗肿瘤的作用。肿瘤局部的低血流量、低流速和肿瘤本身的低氧、低pH值状态决定了其对温热的耐受性下降,肿瘤细胞容易被温热杀灭[4]。研究证明:原发性肝癌的血供90%~95%来自肝动脉,肝动脉栓塞后正常肝脏组织的血供不受影响,这是TACE治疗原发性肝癌的理论基础。由于肿瘤细胞对化疗药可产生耐药性,故TACE的疗效会随时间的延长而减弱。Urano等[5]研究发现:肿瘤组织细胞具有热敏感性,肿瘤组织细胞在43℃即出现不可逆损害,且化疗药物与热疗具有协同作用。热能够促进化疗药物与癌靶细胞结合,并使其活性增强,可以改变癌细胞的通透性,有利于化疗药物渗入肿瘤细胞内,增强对癌细胞的杀伤作用,同时热还可以抑制化疗后肿瘤细胞的复活。肝动脉热灌注化疗是将热疗及化疗通过导管技术有机结合的一项新的治疗肝癌的技术,它将温热的抗癌药物直接注入到肿瘤的供血动脉,通过“血管池”的蓄积作用与虹吸作用使热的抗癌药物作用于肿瘤组织,既发挥药物毒性作用又利用热效应直接杀灭瘤细胞。
研究证实:温度维持在41℃~45℃,对肿瘤细胞能够起到杀伤作用,同时肝脏正常细胞也能够耐受此温度[6],同时在此温度,化疗药物与热疗的协同作用较理想[7]。本研究选择41℃~43℃下持续灌注化疗药物,以起到杀伤肿瘤细胞的同时最大可能的保护正常肝细胞不受损伤。文献报道[8]:热灌注注射速率20~40mL/min较为合适,否则热疗副作用较大,患者难以忍受,本研究注射速率采用20~30mL/min,患者均能耐受,无明显副作用。
本研究中,治疗组和对照组术后3个月均无CR患者,治疗组与对照组术后3个月PR、SD、PD分别为34、47、15例和25、43、28例,治疗组和对照组RR分别为35.4%和26.0%,DCR分别为84.4%和70.8%,两组近期有效率及疾病控制率的差异均有统计学意义(P=0.032,0.043)。术后3个月治疗组与对照组的KPS评分改善、稳定和下降者分别为27、53、16例和11、55、30例,两组改善率+稳定率分别为:83.3%(80/96)和68.8%(66/96),差异有统计学意义(P=0.036)。初步证实:热灌注化疗明显改善患者生活质量,提高治疗有效率及疾病控制率,且副作用小,安全性好,与文献报道相似[5]。
不足之处:⑴本研究为回顾性分析,在研究对象的入组方面未进行随机对照分组,存在一定得不足;⑵随访时间较短,长期疗效需进行更长期的疗效观察。
总之,热灌注化疗联合TAE是集热疗、化疗、栓塞于一体的治疗方法,是一种安全、有效的治疗肝癌的方法,研究结果显示其近期疗效尚可,能够有效的改善患者生活质量,提高治疗有效率及疾病控制率,值得临床上进一步推广应用,远期疗效有待进一步观察。
[1]邹劲林,吕宝军,杨光伟,等.介入热灌注化疗中晚期肝癌患者免疫功能的影响[J].中国实用医药,2009,4(35):19-20.
[2]曹玮,王执民,梁志会,等.动脉灌注化疗治疗晚期肝癌的疗效评价[J].临床放射性杂志,2001,20(7):530-531.
[3]Li GF,Xie SB,Sun H,et al.An investigation of intra-arterial chemotherapy infusion and embolization combined with abdominal chemotherapy for advanced gastric cancer [J]. World J Gastroentro,1998,3(Suppl 2):71-72.
[4]Babbs CF,Dewitt DP.Physical principles of local heat therapy for cancer [J].Med Instrum,1981,15(6): 367-373.
[5]Urano M,Kuroda M,Nishimura Y.For the clinical application of the chemotherapy given at mild temperatures[J].Int J Hyerthermia,1999,15(2):97-107.
[6]Dewhirst MW,Prosnitz L,Donald T,et al.Hyperthermai treatment of malignant diseases: current status and a view toward the future[J].Seminars Oncol,1997,24(6):616-625.
[7]王执民,曹玮.介入性热化疗治疗肝癌的研究现状[J].中国微创外科杂志,2007,7(7):666-667.
[8]贾朝江,杨建,李志光,等.热化疗栓塞术治疗中晚期原发性肝癌的疗效观察[J].实用放射学杂志,2008,24(1):93-96.
