银杏叶提取物EGb761抗大鼠脑缺血损伤的作用机制研究*
2012-06-13于永娟牟芳芳张泽安
于永娟 牟芳芳 张泽安△
(1.上海中医药大学药物安全性评价中心,上海 201203;2.上海中医药大学解剖教研室,上海201203)
脑缺血缺氧性疾病是老年人多发和常见的一种疾病,由于脑缺血缺氧引起的细胞损伤涉及了多种信号通路异常,目前尚无特效药物用于临床。本文旨在通过观察EGb761对脑缺血大鼠脑细胞中P38/MAPK和MEK/ERK的影响,从形态学和分子水平阐述EGb761的药理作用机制。
1 材料与方法
1.1 动物 SD雄性大鼠(300±10)g,购自上海斯莱克实验动物有限责任公司,合格证号2007000511866。
1.2 试剂 银杏叶提取物(金纳多片,20 mg/片,德国威玛舒培博士药厂)。10%水合氯醛溶液:上海国药集团。TTC(2,3,5-氯化三苯基四氮唑):上海国药集团。Western blot相关试剂盒:购自碧云天,β-Actin: signaling technology company, Cat: #4967。P38:购自武汉博士德生物科技有限公司,BA1325。P-P38:Cell signaling technology company,Cat:#4631。 MEK: Cell signaling technology company,Cat:#9122。 P-MEK: Cell signaling technology company,Cat:#2338。 ERK: Cell signaling technology company,Cat:#4695。 P-ERK: Cell signaling technology company,Cat:#9106。 生物素化二抗:Vector,Cat:BA-1000。ABC: Vector,Cat: PK-6100。 DAB: Vector, Cat: SK-4100。
1.3 分组与给药 大鼠随机分为空白对照组9只,假手术组10只,模型组15只,EGb761低剂量(50 mg/kg)组15只和EGb761高剂量(100 mg/kg)组15只。每日1次口服给药,连续10 d。金纳多片用0.5%CMC配成混悬液,现配现用。假手术组给予0.5%CMC。
1.4 模型制备 给药第11日,制备大脑中动脉线栓(MCAO)脑缺血模型,使用内径约0.26 mm的尼龙线顺着颈内动脉到达大脑中动脉,阻塞血流实现栓塞模型。栓塞60 min后,轻轻抽出线头约2 cm,实现血流再灌注。造模前后脑血流减少>75%认为造模成功,脑血流减少<75%的动物剔除。再灌24 h后,处死动物,取脑,检测相关指标。
1.5 标本采集与检测
1.5.1 TTC 染色[1]动物麻醉后腹主动脉放血,立刻取脑,切成厚约2~3 mm的薄片,浸入1%TTC中,37℃染色30 min,观察脑组织梗死面积。
1.5.2 免疫组化检测 脑组织固定于 10%甲醛中,24 h后脱水,常规方法制作切片。切片脱蜡,进行热抗原修复(柠檬酸缓冲液,pH=6.0,沸水中15 min),山羊正常血清封闭,一抗冰箱过夜,之后加入HRP标记的二抗,DAB显色。拍照,每张切片选取3个视野拍照,照片使用Nikon BR3.5图像分析软件分析定量。
1.5.3 Western blot检测 动物处死后立即取脑,加入蛋白酶抑制剂,磷酸酶抑制剂和裂解液匀浆,冰上裂解30 min。Bradford法进行蛋白定量,然后取70 μg蛋白上样,聚丙烯酰胺凝胶电泳,转膜仪转膜。5%脱脂奶粉室温封闭1 h,一抗4℃过夜,PBS清洗后滴加羊抗兔二抗,室温孵育2 h,PBS清洗,加入ECL后使用TANON4500凝胶成像系统检测蛋白表达。蛋白条带使用Quantityone软件进行定量。
1.6 统计学处理 应用SigmaSTAT4.0统计软件。 数据以(±s)表示,采用单因素方差分析Dunnett法统计。P<0.05为差异有统计学意义。
2 结 果
2.1 EGb761对大鼠脑组织梗死体积的影响 见图1。染成红色部分为未缺血组织,白色部分为梗死组织。从结果可见,EGb761可剂量依赖性地减少大鼠脑组织梗死面积。

图1 大鼠脑TTC染色
2.2 EGb761对大鼠脑缺血性组织Caspase-9和Caspase-3的影响 见图2。与假手术组相比,不论皮质部位,还是海马部位,模型组动物Caspase-9和Caspase-3阳性细胞数显著性增多。EGb761各组Caspase-9/3阳性细胞较模型组明显减少(P<0.05)。给予EGb761后,阳性细胞数剂量依赖性减少,但是Caspase-3表达仅有高剂量组教模型组具有显著性减少(P<0.05),而Caspase-9的表达在EGb761-50和EGb761-100组均显著性减少(P<0.05),这些结果表明,EGb761可剂量依赖性抑制凋亡信号传递,减少细胞凋亡。

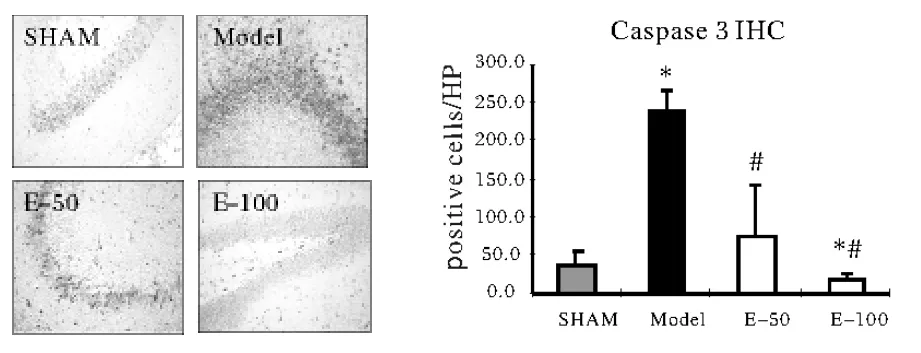
图2 大鼠脑Caspase-9和Caspase-3免疫组化结果
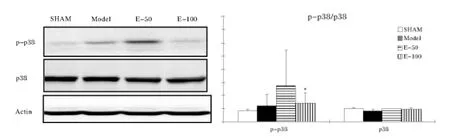
图3 大鼠脑皮质P38/P-P38蛋白表达变化
2.3 EGb761对缺血大鼠脑皮质P-P38水平的影响 与假手术组相比,模型组动物皮质,P-P38 的表达显著上升(P<0.05,图3),表明缺血性损伤时P38被激活了。EGb761给药后,P-P38的表达减少,与模型组相比,P-P38 的表达从模型组的(0.12±0.08)下降到给药 EGb761-100 后的(0.07±0.03),差异具有统计学意义(P< 0.05,图3)。 本实验结果表明,EGb761-100 mg/kg 给药显著性抑制了P38/MAPK信号分子在脑缺血大鼠脑皮质的激活。但是,EGb761组中P38蛋白与假手术组表达水平相似,无统计学差异 (P>0.05)。这些数据表明,缺血性损伤能够直接引起P38/MAPK的磷酸化,从而引发下游信号的传递。由此,笔者推测EGb761的神经保护作用与抑制P38/MAPK信号传导有关。
2.4 EGb761给药抑制了缺血大鼠脑组织中P-ERK,P-MEK的磷酸化水平 从图4可见,与假手术组相比,ERK和MEK的总的蛋白水平在模型组和EGb761给药组均未见明显变化 (P>0.05,图4),而P-ERK的表达在模型组显著高于假手术组(P<0.05),分别为(0.05±0.04)和(0.16±0.05)。与模型组相比,P-MEK水平在EGb761各用药组均有显著下降(P<0.05),但是P-ERK仅高剂量组相较模型组有显著下降(P <0.05),从模型组(0.16±0.05)下降至(0.10±0.05)。 P-MEK 的表达相较模型组,各用药组均显著性下降(P<0.05),分别从模型组(1.02±0.04)下降至低剂量组的(0.67±0.20)和高剂量组的(0.74±0.21)。 这些结果表明,脑缺血后,MEK和ERK均被激活,EGb761给药后,一定程度上抑制了这两个蛋白激酶的活化。
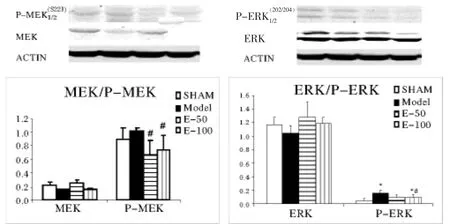
图4 大鼠脑皮质MEK/ERK蛋白表达变化
3 讨 论
启动细胞凋亡一般通过两条途径,一条是内源性凋亡信号系统,以Caspase-9的激活为标志,另一条外源性凋亡信号通过激活Caspase-8,最终二者均可引起Caspase-3激活,启动细胞的凋亡[2]。已有实验证明P38/MAPK途径的激活会诱导细胞凋亡[3-4]。P38MAPK被磷酸化激活后,可以进一步激活其下游的激酶或多种转录因子,如蛋白激酶MAPKAPK2,转录因子ATF2,Elk-1等,产生一系列细胞内效应,促进诱导型一氧化氮合酶、选择素、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β 等分子表达[5-6]。这些基因表达产物在脑缺血损伤时的神经细胞凋亡、炎性反应等过程中发挥着重要作用,。大量实验数据也表明使用P38/MAPK的抑制剂可以减少缺血后细胞的凋亡[7]。本研究发现在缺血60 min再灌24 h的大鼠脑缺血区,与假手术组相比,模型组动物P-P38和P-ERK均激活了,而EGb761给药后,P-P38的表达减少(P<0.05)。
Takagi等发现[8],局灶性脑缺血再灌注后 5 min,皮质及海马的神经元中P38MAPK,再灌注30 min达到高峰,而再灌注后72 h,上述激酶活性增强的区域中可发现凋亡的神经元。表明P38激活促进了凋亡途径引起损伤。Ma XL等[7]研究发现SB 203580组与对照组相比,可减少缺血引起的心肌细胞死亡,进一步表明缺血性损伤引起的P38激活促进了细胞损伤,而抑制P38活性具有细胞保护作用,但机制未明。Kevin等[9]在沙土鼠脑缺血模型发现,p38/MAPK及其底物ATF2均有变化,MAPKAP2在脑缺血后持续数天活化,缺血后3~4 d酶活性最高,同时海马区锥状神经元缺损最多,而JNK1和ERK的活化不明显。
实验研究发现在缺血性疾病中,MEK激活的ERK促进了细胞损伤,因为MEK选择性抑制剂SL327在缺血前15 min会减少64%梗死面积,同时,SL327减少了59%的IL-1β mRNA的表达,但是TNF-α不变。表明MEK抑制剂通过减少IL-1β而神经保护作用[10]。另外,在MCAO造模前30 min和造模后30 min使用ERK的特异性阻断剂UO126均可减少MCAO后的损伤面积,认为其保护作用是通过抑制了缺血引起的p-ERK1/2激活实现的[11],MEK/ERK的激活可以促进缺血后TNF-α的表达[12],这些实验表明,MEK/ERK通路在脑缺血时的激活促进了炎性因子释放,从而加重了细胞损伤。通过抑制MEK/ERK的激活,会缓解炎性因子对细胞的损伤,同时直接或间接抑制细胞凋亡,发挥缺血后的神经保护作用。
本实验中大鼠脑缺血后P-ERK表达明显增加,与QiaoH等[13-14]的结果相同,而EGB761用药后,与大鼠大脑中动脉栓塞再灌模型组相比,脑组织梗死面积减少,凋亡标记TUNEL染色阳性的细胞显著性减少,Caspase-3表达减少。Caspase-3是启动凋亡程序的重要的蛋白分子,Caspase-3阳性细胞数的减少充分论证了EGb761可以抑制细胞的凋亡,同时在大鼠缺血后皮质发现P-MEK和P-ERK在EGb761给药组显著下降(图4)。由此,笔者认为,EGb761通过抑制MEK/ERK的激活,阻断了内源性凋亡通路的激活,从而减少了细胞的凋亡。
本实验从形态学和蛋白表达水平研究了EGb761对脑缺血的神经保护作用及涉及的信号通路。从结果可知,EGb761可以通过抑制细胞凋亡发挥了缺血性损伤中的细胞保护作用,其作用机理涉及了凋亡通路,P38/MAPK和MEK/ERK信号通路。由于EGb761的多靶点药理作用和对细胞无毒性的特点,本研究认为其是一种可以有效预防和治疗脑缺血的中药,具有开发前景。
致谢:感谢上海中医药大学安评中心老师和同学们的无私帮助。
[1]Angéla Benedeka,Krisztina Móricza,Zsolt Jurányia,et al.Use of TTC-staining for the evaluation of tissue injury in the early phases of reperfusion after focal cerebral ischemia in rats[J].Brain Res,2006,1116(1):159-165.
[2]Catherine M Cowan,Jimmy Thai,Stanislaw,et al.Caspases 3 and 9 send a pro-apoptotic signal from synapse to cell body in olfactory receptor neurons[J].J Neurosci,2001,21(18):7099-7109.
[3]Moolman JA,Hartley S.Inhibition of myocardial apoptosis by ischaemic and beta-adrenergic preconditioning is dependent on p38 MAPK[J].Cardiovasc Drugs Ther,2006,20(1):13-25.
[4]Yasushi Takagi,Kazuhiko Nozaki,Toshiyuki Sugino,et al.Phosphorylation of c-jun NH2teminal kinase and p38 mitogen activated protein kinase after transient forebrain ischemia in mice[J].Neurosci Lett,2006,294(2):117-12.
[5]Maddahi A,Edvinsson L.Cerebral ischemia induces microvascular proinflammatory cytokine expression via the MEK/ERK pathway[J].J Neuroinflam,2010,26:7-14.
[6]Kevin MW,Richard D,Becky A,et al.Activation of p38 MAPK in microglia after ischemia[J].J Neurochem,2005,70(4):1764-1767.
[7]Ma XL,Kumar S,Gao F,et al.Inhibition of p38 mitogen-activated protein kinase decreases cardiomyocyte apoptosis and improves cardiac function after myocardial ischemia and reperfusion[J].Circulation,1999 ,99(13):1685-1691.
[8]Yasushi Takagi, Kazuhiko Nozaki,Toshiyuki Sugino,et al.Phosphorylation of c-jun NH2teminal kinase and p38 mitogen activated protein kinase after transient forebrain ischemia in mice[J].Neurosci Lett,2006,294(2):117-12.
[9]Kevin MW,Richard D,Becky A,et al.Activation of p38 MAPK in microglia after ischemia[J].J Neurochem,2005,70(4):1764-1767.
[10]Wang H,Xu L,Venkatachalam S,et al.Differential regulation of IL-1beta and TNF-alpha RNA expression by MEK1 inhibitor after focal cerebral ischemia in mice[J].Biochem Biophys Res Commun,2001,286(5):869-874.
[11]Farrokhnia N,Ericsson A,Terént A,et al.MEK-inhibitor U0126 in hyperglycaemic focal ischaemic brain injury in the rat[J].Eur J Clin Invest,2008,38(9):679-685.
[12]Maddahi A,Kruse LS,Chen QW,et al.The role of tumor necrosis factor-α and TNF-α receptors in cerebral arteries following cerebral ischemia in rat[J].J Neuroinflam,2011,28:98-107.
[13]Qiao H,Zhang X,Zhu C,et al.Luteolin downregulates TLR4,TLR5,NF-κB and p-p38MAPK expression,upregulates the p-ERK expression,and protects rat brains against focal ischemia [J].Brain Res,2012,11(1448):71-81.
[14]Kovalska M,Kovalska L,Pavlikova M,et al.Intracellular signaling MAPK pathway after cerebral ischemia-reperfusion injury [J].Neurochem Res,2012.
