烟草凝聚物对人正常支气管上皮细胞中ΔNp63α表达的影响
2012-05-02赵艳红丁文勇吴军兵王春仁
赵艳红,丁文勇,吴军兵,王春仁
(1.中国食品药品检定研究院医疗器械检定所生物材料和组织工程室,北京100050;2.国家食品药品监督管理局医疗器械技术审评中心,北京100044;3.大连医科大学生化教研室,辽宁大连116044;4.中国科学院生物物理学研究所,北京100101)
烟草凝聚物对人正常支气管上皮细胞中ΔNp63α表达的影响
赵艳红1,2,丁文勇3,吴军兵4,王春仁1
(1.中国食品药品检定研究院医疗器械检定所生物材料和组织工程室,北京100050;2.国家食品药品监督管理局医疗器械技术审评中心,北京100044;3.大连医科大学生化教研室,辽宁大连116044;4.中国科学院生物物理学研究所,北京100101)
[目的]探讨ΔNp63α与吸烟型肺癌发生的关系。[方法]用烟草凝聚物处理体外培养正常支气管上皮细胞HBE,并分别用Realtime PCR和Western blot检测其ΔNp63αmRNA和蛋白的表达。同时构建ΔNp63α的基因组启动子载体,利用荧光素酶分析烟草凝聚物对其转录活性的影响。[结果]烟草凝聚物处理后,HBE细胞中ΔNp63α mRNA和蛋白的表达明显增多,且具有剂量依赖性,以50 μg/mL浓度诱导效应最明显,mRNA和蛋白表达分别升高93%和311%。烟草凝聚物能够显著增强ΔNp63α启动子的转录活性,同样表现出剂量依赖性,50 μg/mL的诱导效应最明显,转录活性升高140%。[结论]烟草凝聚物能够通过增强ΔNp63α启动子的转录活性而诱导ΔNp63α的表达,说明ΔNp63α可能与吸烟导致的肺癌发生相关。
烟草凝聚物;肺癌;ΔNp63α
在20世纪50年代,Doll和Hill首次进行了吸烟与肺癌关系的流行病学研究。他们的回顾性研究发现,吸烟与肺癌的发生密切相关。吸烟时间越长,初始吸烟年龄越小的人越容易发生肺癌[1-2]。之后,吸烟与肺癌的研究一直方兴未艾,越来越多的研究证实了吸烟人群比非吸烟人群更容易罹患肺癌。
p63α是抑癌基因p53的同源基因,其在细胞分化、增殖、凋亡等多个细胞生命活动中发挥了重要的作用[3]。p63α包括全长型p63α(TAp63α)和截短型p63α(ΔNp63α)两个亚型,其中ΔNp63α表达增加与多种恶性肿瘤的发生相关[4]。已有研究表明,ΔNp63α在小细胞肺癌中处于高表达水平,说明ΔNp63α可能与肺癌的发生密切相关[5-6]。最新研究发现,烟草凝聚物处理非小细胞肺癌细胞后能够以ΔNp63α依赖方式诱导COX-2基因的表达[7]。为了进一步了解ΔNp63α在吸烟导致肺癌过程中的生物学作用,本研究利用烟草凝聚物处理正常人支气管上皮细胞系HBE,通过检测ΔNp63α表达来探讨ΔNp63α与吸烟型肺癌发生的关系。
1 材料和方法
1.1 实验材料
人正常支气管上皮细胞HBE为研究室保存。RPMI1640培养基和胎牛血清购自美国Invitrogen公司。Western blot试剂盒购自美国Pierce公司。所有抗体购自美国Santacruze公司。Realtime PCR试剂盒购自Takara公司。双荧光素酶报告系统购自美国 Promega公司。细胞转染试剂 Lipofactamine 2000购自美国Invitrogen公司。其它生化试剂购自美国Sigma公司。
1.2 细胞培养
正常支气管上皮细胞HBE常规培养在加有10%FBS、谷氨酰胺和青链霉素的RPMI1640培养基中,于37℃、5%CO2的孵箱培养。待细胞生长到融合度为80%~90%左右后,利用0.5%胰蛋白酶进行消化,重新接种培养。
1.3 烟草凝聚物
本研究使用的烟草凝聚物提取于13 mg焦油含量的红金龙牌香烟。具体制备过程如下:将15支香烟通过50 mL注射器与收集瓶相连。香烟点燃后,通过抽吸装置,将烟雾收集到收集瓶中。待液氮冷冻凝聚后,用10 mL DMSO将烟雾凝聚物溶解,最终将浓度调整为10 mg/mL。最后经过滤膜过滤后保存在-80℃冰箱中。采用不同浓度(0、5、10、25、50、100 μg/mL)的烟草凝聚物处理细胞,24 h后收集细胞进行后续实验。
1.4 Realtime PCR
利用Trizol试剂提取细胞总RNA,具体方法参见Invitrogen公司的说明书。采用 Takara公司的SYBR®Premix Ex TaqTMII(Perfect Real Time)试剂盒进行mRNA定量分析。引物序列如下:ΔNp63α (上游引物为5'-TGTACCTGGAAAACAATGCCC A-3',下游引物为5'-GACGAGGAGCCGTTCTGAATCT -3');18SRNA(上游引物为5'-ACATCCAAGGAAGGC AGCAG-3',下游引物为5'-TCGTCACTACCTCCCCGG-3')。18SRNA作为内参基因。PCR体系配制参照Takara公司说明书。目的基因相对表达水平采 用 2-△△CT方 法来 计 算。即 △△CT= (CT实验组目的基因-CT实验组内参基因) -(CT对照组目的基因-CT对照组内参基因),其中CT(Threshold cycle)为阈值循环数。为了更清晰表达各组之间表达水平的差异,将对照组的表达水平人为设定为100%。
1.5 Western blot
将待测细胞用PBS洗3次后,用细胞裂解液裂解细胞,冰上孵育30 min后,经过4℃,15000 RPM离心20 min后,收集上清,即细胞总蛋白。将蛋白定量后,取5 μg蛋白进行12%浓度的SDS-聚丙烯凝胶凝胶电泳。利用半干转印技术将蛋白转移到PVDF膜上。经过5%脱脂奶粉封闭1 h后,与抗ΔNp63α的羊源第一抗体(sc-8609,Santa Cruz Biotech)室温孵育2 h。然后与HRP标记的兔抗羊第二抗体孵育1 h,最后利用化学发光试剂盒(普利莱公司)检测荧光信号。利用Odyssey近红外双色激光成像系统采集信号。
1.6 细胞转染
转染前1天,接种细胞,保证转染时细胞融合度达到90%左右。用无血清培养基分别稀释转染试剂Lipofectamine 2000(Invitrogen)和质粒。然后将二者混合,加入到待转染的细胞中。4 h后,将培养基倒掉,加入新鲜的完全培养基。
1.7 ΔNp63α基因启动子构建
根据之前的研究报道[8],本研究从正常人角化细胞中分离了ΔNp63α基因组片段(-1584到+61)。此片段具有较强的ΔNp63α基因转录活性。本研究将此序列克隆到pGL3-basic载体中,此载体是Promega公司专门为检测基因转录活性而设计的。
1.8 启动子活性分析
采用Promega公司Dual-Luciferase Reporter Assay System双荧光素酶报告系统进行启动子转录活性分析。具体步骤如下:于 96孔板内用 Lipofectamine 2000瞬时转染细胞,48 h后,弃去培养基,用PBS洗3遍,加入PLB细胞裂解液,待细胞充分裂解后,加入LAR II检测液,充分混合后检测萤火虫荧光素酶活性,然后加入Stop&Glo检测液检测海肾荧光素酶活性。然后计算二者的比值,即为荧光素酶的相对活性RLA(relative luciferase activity)。
1.9 统计学方法
采用SPSS 16.0统计软件进行统计分析。Realtime PCR和启动子活性分析实验均重复3次,据此计算均数±标准差,实验组之间差异的统计学分析采用Student-T检验,P<0.05为差异具有统计学意义。
2 结果
2.1 烟草凝聚物对ΔNp63α mRNA表达的影响
Realtime PCR结果显示,烟草凝聚物能够诱导ΔNp63α mRNA的表达,并具有一定的剂量依赖性。10 μg/mL的烟草凝聚物就能够引起ΔNp63α mRNA表达水平升高22%。随着浓度的升高,ΔNp63α mRNA的表达水平也逐渐升高,50 μg/mL的烟草凝聚物的诱导效应最明显,表达水平升高93%。见图1。
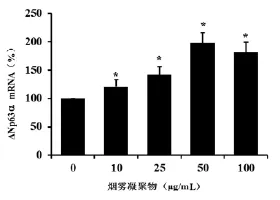
图1 烟雾凝聚物对ΔNp63α mRNA表达的影响Fig 1 The impact of cigarette smoke extracts on the expression of ΔNp63α mRNA
2.2 烟草凝聚物对ΔNp63α蛋白表达的影响
烟草凝聚物能够诱导ΔNp63α蛋白的表达,并且具有一定的剂量依赖性。10 μg/mL的烟草凝聚物就能够引起ΔNp63α蛋白表达水平升高,半定量分析表明表达水平升高68%。随着烟草凝聚物浓度的升高,ΔNp63α蛋白的表达水平也逐渐升高,50 μg/mL的烟草凝聚物的诱导效应最明显,表达水平升高311%。
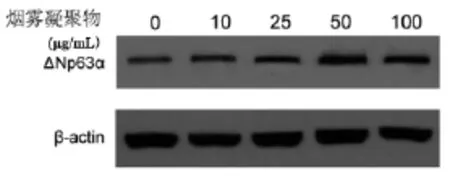
图2 烟雾凝聚物对ΔNp63α蛋白表达的影响Fig 2 The impact of cigarette smoke extracts on the expression of ΔNp63α protein
2.3 烟草凝聚物对ΔNp63α基因启动子转录活性的影响
烟草凝聚物能够增强ΔNp63α启动子的转录活性,具有一定的剂量依赖性。10 μg/mL的烟草凝聚物能够诱导转录活性增加48%。随着烟草凝聚物浓度的增加,转录活性也逐渐增强,50 μg/mL的烟草凝聚物表现出最大的诱导效应,启动子活性增加了140%。见图3。
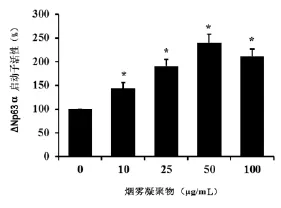
图3 烟雾凝聚物对ΔNp63α启动子活性的影响Fig 3 The impact of cigarette smoke extracts on the transcriptional activity of ΔNp63α promoter
3 讨论
目前的研究发现,烟草中含有超过4000种的化学成分,其中有近60种具有致癌风险,并且这些物质的致癌性已经被国际癌症研究机构确认[9]。这些致癌物被人体吸收后,其代谢产物能够诱发癌症的发生。烟草中的多种致癌物可以在细胞内诱导形成DNA加合物,后者能够干扰DNA的复制及转录过程[10]。二醇环氧化物即是一种典型的DNA加合诱导剂,它能够通过脱嘌呤作用诱导DNA加合物的形成[11]。DNA加合物形成后一般能够被细胞自有的修复机制所修复。如果修复失败,可能导致细胞生命活动的紊乱。尤其是当受累的DNA位于重要的癌基因序列内的时候,可能导致癌基因的激活,原癌基因Ras就是一个典型的例子。Ras是20世纪70年代发现的一个癌基因家族,其在细胞的信号传递和细胞增殖过程中发挥着关键作用[12-13]。Ras表达水平升高常见于多种恶性肿瘤中。人体的许多细胞增殖性疾病(如动脉粥样硬化等)的发病过程也与Ras表达失调相关。Ras激活主要通过突变来实现,几个位点的点突变即可以导致Ras的激活。最常见的Ras基因突变位点是第12、13、59或61位氨基酸密码子[14-15]。近期研究发现,一种烟草中的致癌物4-甲基亚硝胺基-1-3-吡啶基-1-丁酮(NNK)能够诱导Ras基因的DNA加合物形成,从而激活Ras,最终导致肺癌发生[16]。本研究发现了一个新的与吸烟相关的易感基因,即ΔNp63α。人类p63α基因作为p53家族的一员,具有p53家族成员的典型特征。p63α基因具有3个主要功能区,分别是影响反式激活的氨基末端区(TA)、与靶DNA结合的中心区(DBD)以及随机寡聚化区(OD)[3]。此外,其氨基末端还有一个SAM结构域(Sterile alpha motif,SAM),发挥类似随机寡聚区的作用[17]。p63α包括两种亚型,即全长型的TAp63α以及截短型的ΔNp63α。ΔNp63α缺乏反式激活区,能够以dominant negative的方式调节抑制 TAp63α和 p53功能[3]。目前的研究报道,ΔNp63α多被认为发挥原癌基因的功能。本研究的结果也证实了这一观点。同时,本研究的发现也提示了ΔNp63α可能是吸烟导致肺癌发生过程中的一个重要基因。鉴于本研究的体外研究特性,进一步的临床流行病学与病理学研究将有助于深入认识ΔNp63α与吸烟导致肺癌发生的相关性。
[1]Doll R.On the etiology of lung cancer[J].J Natl Cancer Inst,1950,11(3):638-640.
[2]Watson WL.Cancer of the lung:consideration of incidence and etiology[J].NY Med,1950,6(12):15-18.
[3]Dotsch V,Bernassola F,Coutandin D,et al.ΔNp63 and p73,the ancestors of p53[J].Cold Spring Harbor Perspect Biol,2010,2(9):a004887.
[4]Deyoung MP,Ellisen LW.ΔNp63 and p73 in human cancer:defining the network[J].Oncogene,2007,26(36): 5169-5183.
[5]Lo Iacono M,Monica V,Saviozzi S,et al.ΔNp63 and p73 isoform expression in non-small cell lung cancer and corresponding morphological normal lung tissue[J].J Thorac Oncol,2011,6(3):473-481.
[6]Massion PP,Taflan PM,Jamshedur Rahman SM,et al.Significance of ΔNp63 amplification and overexpression in lung cancer development and prognosis[J].Cancer Res,2003,63(21):7113-7121.
[7]Ratovitski EA.LKB1/PEA3/DeltaNΔNp63 pathway regulates PTGS-2(COX-2)transcription in lung cancer cells upon cigarette smoke exposure[J].Oxid Med Cell Longev,2010,3(5):317-324.
[8]Romano RA,Birkaya B,Sinha S.Defining the regulatory elements in the proximal promoter of DeltaNΔNp63 in keratinocytes:Potential roles for Sp1/Sp3,NF-Y,and ΔNp63[J].J Invest Dermatol,2006,126(7):1469-1479.
[9]Henningfield JE,London ED,Pogun S.Handbook of experimental pharmacology 192.Nicotine psychopharmacology.Preface[J].Handb Exp Pharmacol,2009(192):v-viii.
[10]Kiakos K,Sato A,Asao T,et al.DNA sequence selective adenine alkylation,mechanism of adduct repair,and in vivo antitumor activity of the novel achiral seco-amino-cyclopropylbenz[e]indolone analogue of duocarmycin AS-I -145[J].Mol cancer Ther,2007,6(10):2708-2718.
[11]Saeed M,Rogan E,Cavalieri E.Mechanism of metabolic activation and DNA adduct formation by the human carcinogen diethylstilbestrol:the defining link to natural estrogens[J].Int J Cancer,2009,124(6):1276-1284.
[12]Ghobrial IM,Adjei AA.Inhibitors of the ras oncogene as therapeutic targets[J].Hematol Oncol Clin North Am,2002,16(5):1065-1088.
[13]Scharovsky OG,Rozados VR,Gervasoni SI,et al.Inhibition of ras oncogene:a novel approach to antineoplastic therapy[J].J Biomed Sci,2000,7(4):292-298.
[14]Mascaux C,Iannino N,Martin B,et al.The role of RAS oncogene in survival of patients with lung cancer:a systematic review of the literature with meta-analysis[J].Br J cancer,2005,92(1):131-139.
[15]Mu DQ,Peng YS,Xu QJ.Values of mutations of K-ras oncogene at codon 12 in detection of pancreatic cancer: 15-year experience[J].World J Gastroenterol,2004,10 (4):471-475.
[16]Devereux TR,Belinsky SA,Maronpot RR,et al.Comparison of pulmonary O6-methylguanine DNA adduct levels and Ki-ras activation in lung tumors from resistant and susceptible mouse strains[J].Mol Carcinog,1993,8(3): 177-185.
[17]Melino G.ΔNp63 is a suppressor of tumorigenesis and metastasis interacting with mutant p53[J].Cell Death Differ,2011,18(9):1487-1499.
Promotion effect of cigarette smoke extracts on human normal bronchial epithelial cells to express ΔNp63α in vitro
ZHAO Yan-hong1,2,DING Wen-yong3,WU Jun-bing4,WANG Chun-ren1
(1.Institute for Medical Devices Control,National Institutes for Food and Drug Control,Beijing 100050,China;2.Center for Medical Device Evaluation/SFDA,Beijing 100044,China;3.Biochemistry Teaching and Research Division,Dalian Medical University,Dalian 116044,China;4.Institute of Biophysics,Chinese Academy of Sciences,Beijing 100101,China)
[Objective]To study the correlation of ΔNp63α expression with cigarette smoking-induced lung cancer.[Methods]We cultured exposed human normal bronchial epithelial cells(HBE cells)to cigarette smoke extracts and detected the protein and mRNA levels of ΔNp63α with Western blot and realtime PCR respectively.We also cloned the genomic promoter of ΔNp63α and determined its transcriptional activity after exposure to cigarette smoke extracts.[Results]The cigarette smoke extracts induced the expression of ΔNp63α both at protein and mRNA levels significantly in a dose dependent manner.The cigarette smoke extracts at 50 μg/mL induced 93%and 311%increasing of mRNA and protein levels respectively.The transcriptional activity of the ΔNp63α promoter was also enhanced by cigarette smoke extracts in a dose dependent manner.The extracts at 50 μg/mL induced 140%increasing of transcriptional activity.[Conclusion]Cigarette smoke extracts could induce the expression of ΔNp63α by enhancing its transcriptional activity and this finding indicated that ΔNp63α might be involved in cigarette smoking-induced lung cancer.
cigarette smoke extracts;non-small cell lung cancer;ΔNp63α
Q291
A
1671-7295(2012)04-0335-04
2012-05-11;
2012-06-29
赵艳红(1976-),女,辽宁阜新人,博士,助研。E-mail:zhaoyanhongbj@yahoo.com.cn
王春仁,正研究员。E-mail:chunrenwang@263.net
