成人自体心肌干细胞体外高效扩增及特异性鉴定
2012-05-02桑丽敏林海龙何学志吴园园颜培实孙喜琢
纪 军,张 利,桑丽敏,林海龙,何学志,吴园园,颜培实,孙喜琢
(大连市中心医院中心实验室,辽宁大连116033)
成人自体心肌干细胞体外高效扩增及特异性鉴定
纪 军,张 利,桑丽敏,林海龙,何学志,吴园园,颜培实,孙喜琢
(大连市中心医院中心实验室,辽宁大连116033)
[目的]建立一种稳定、高效的成人自体心肌干细胞体外培养扩增及特异性鉴定方法。[方法]手术中取下的心脏组织标本,通过胶原酶消化的方法获得细胞,使用自体血清进行贴壁培养和传代的方法纯化细胞,细胞增殖至3代后进行RT-PCR基因表达检测,流式细胞表面标记检测及染色体核型分析的鉴定。[结果]通过本实验的方法可以在成人心肌组织中分离和纯化心肌干细胞,并在体外可大量增殖,至3代细胞可增殖至5×107。RT-PCR鉴定其具有全能干细胞因子Nanog、Oct-4、Sox-2、Rex-1的mRNA表达,及心肌转录因子Nkx2.5和GATA4的mRNA和蛋白表达;表达间质干细胞表面标记CD29、CD90、CD105;不表达造血干细胞表面标记CD45和人免疫抗原HLA-DR;且培养后46条染色体无移位和缺失等染色体突变。[结论]通过本研究确立了一种稳定、高效的成人自体心肌干细胞体外培养,扩增和特异性鉴定的方法,为自体心肌干细胞移植技术的临床应用奠定重要的基础。
自体组织;心肌干细胞;基因表达;流式细胞术;核型分析
传统观点认为心脏是高度分化器官,没有再生能力;心肌细胞是终末分化细胞,是不可再生的细胞。胎儿出生后的心肌细胞已永久性的退出细胞周期,在心肌损伤后不能自我更新和修复坏死心肌,心脏只能通过心肌细胞肥大来适应心脏负荷的增加,心肌受损后心肌组织被瘢痕组织取代,最终导致心脏收缩功能的不可逆损伤。然而近几年来的动物实验和临床实验证实,无论是在生理还是病理的情况下,心肌细胞均在不断的更新,但更新的比例极低,包括人类在内的成体哺乳动物心脏组织中具有特异性心肌分化潜能的原始多能干细胞,即成体心肌干细胞(cardiac stem cells,CSCs)[1-3],这些研究为干细胞治疗缺血性心脏病带来了希望。
但是,CSCs的研究仍处于基础实验研究阶段,CSCs的分离提取,培养扩增,及纯化等也缺乏重复性好,稳定性高的实验方法;且仅靠个别单一细胞表面抗原表达鉴定,手段单一,缺乏有效性和可靠性。干细胞研究的终极目标是临床上的细胞移植治疗,要达到这样的高度,干细胞的培养必须满足稳定、无污染、长期培养后维持其基因表达的特异性和染色体保持稳定状态这些先决条件。本研究通过成人心肌标本的培养试图建立一种稳定、高效的方法来获取和鉴定CSCs,为CSCs的基础研究和临床应用提供有力的实验方法和理论依据。
1 材料和方法
1.1 材料与试剂
D-PBS、TrypLETM、DMEM/F12均购自GIBCO公司,collagenaseⅡ、rh-bFGF购自Invitrogen公司,RT-PCR引物及试剂盒购自大连宝生物公司,抗人CD29、CD90、CD105、CD45、Stro-1和HLA-DR等流式抗体购自Backman Coulter公司,Nkx2.5及GATA4 Western blot抗体购自Abcam公司,40 μm及70 μm滤器等实验耗材均购自BD公司。
1.2 方 法
1.2.1 细胞提取分离:心脏组织标本(心脏瓣膜移植手术中取下的瓣膜边缘心肌组织,约20~30 mg)无菌操作下置于培养皿中,滴加0.4%Ⅱ型胶原酶,将组织剪碎成0.5 mm3左右的小块。剪碎组织置于20 mL胶原酶中,37℃空气恒温震荡30 min,静置5 min。取上清,与20 mL DMEM/F12混合,经70 μm及40 μm滤器过滤,4℃保存;沉淀置于另20 mL胶原酶中,重复上步。两支同时4℃,1500 r/min,离心5 min。弃上清,沉淀30 mL DMEM/F12洗1次;1 mL DMEM/F12重悬,苔盼兰染色计数。
1.2.2 细胞培养:提取细胞接种于培养皿,使用DMEM/F12培养基,含10%自体血清,添加0.4 μg/ mL的rh-bFGF。视细胞生长情况每3~4 d进行换液,换液时D-PBS洗2遍,加入DMEM/F12培养基并补充适量rh-bFGF。每8~10 d细胞达到80%融合时进行传代。传代时使用TrypLETM完全消化约10 min,等量DMEM/F12终止消化,1500 r/min,离心5 min,细胞DMEM/F12重悬,计数,适量细胞数传代。
1.2.3 细胞mRNA表达鉴定:收集第3代2×106细胞,提取总mRNA,紫外分光光度计定量。采用一步法RT-PCR进行逆转录反应及PCR扩增。检测干细胞因子Nanog、Oct-4、Sox-2、Rex-1和心肌转录因子Nkx2.5、GATA4的mRNA表达,以GAPDH为内参。PCR反应条件:94℃,2 min;94℃,30 s;58℃,30 s;72℃,1 min(35个循环);72℃,5 min。1%琼脂糖凝胶电泳,凝胶成像及分析软件系统记录和分析mRNA表达结果。
1.2.4 Nkx2.5和GATA4的蛋白表达检测:收集第3代2×106细胞,提取总蛋白,紫外分光光度计定量。待检测蛋白变性后,经SDS-PAGE胶电泳分离,转膜。在含5 g/L脱脂奶粉(w/v)的PBS(加tween-20)中4℃封闭过夜。分别加入1∶800稀释的心肌转录因子Nkx2.5和GATA4的多克隆一抗,室温孵育2 h以上,加二抗及显色剂。使用ECL-Plus Detection System检测免疫复合物,蛋白产物分别为72 kDa及44 kDa,β-actin为内参。
1.2.5 流式细胞仪检测细胞表面标记:收集第3代5×106细胞,D-PBS洗2遍,取20~50 μL的抗人CD29、CD90、CD105、CD45、Stro-1和HLA-DR抗体与细胞充分混匀,4℃避光孵育20 min,用流式清洗液洗涤2次,加适量固定液固定后用于流式细胞仪表面标记检测。流式检测所得数据用SPSS11.0软件进行统计学处理。
1.2.6 染色体核型分析:第2代CSCs传代至培养瓶中,视细胞贴壁生长和有丝分裂情况适时加入秋水仙素(终浓度0.05 μg/mL),继续培养4 h,将细胞刮离瓶底,2000 r/min,离心15 min。去上清,低渗液37℃处理5 min,固定液固定2次,50℃烤片过夜。0.025%胰酶消化30 s,吉姆萨染色后阅片,每片计数50个分裂中期相,分析10个核型。采用美国Video Test-Karyo软件进行染色体核型分析。
2 结果
2.1 CSCs细胞生长及增殖情况
从成人心肌组织中消化所得的悬浮细胞,呈圆形,单核,大小较均一。接种后一般经过24~36 h少数细胞开始贴壁;换液后不贴壁圆形悬浮细胞基本全部清除;培养7 d使用相差显微镜观察,贴壁细胞增殖明显,形态各异;传代后细胞增殖速度明显加快;至第3代细胞成梭形,排列较规律,具有类似心肌细胞形态,细胞数达到5×107以上。细胞生长状态如图1所示。

图1 CSCs细胞培养和生长情况Fig 1 Cell culture and cell growth state pictures of CSCs
2.2 CSCs基因表达及蛋白表达鉴定结果
培养至3代的细胞仍然表达4项多能干细胞未分化因子:Nanog、Oct-4、Sox-2和Rex-1;并且表达具有早期心肌形成转录因子Nkx2.5和、GATA4的mRNA和蛋白表达(图2、3)。证实培养细胞为具有多项分化潜能的原始心肌干细胞。
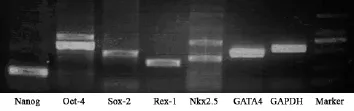
图2 CSCs细胞RT-PCR基因表达鉴定结果Fig 2 RT-PCR gene expression identification of CSCs
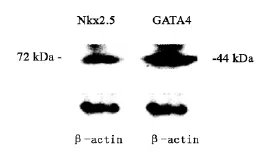
图3 CSCs细胞Nkx2.5和GATA4的蛋白表达Fig 3 Nkx2.5 and GATA4 protein expression of CSCs
2.3 CSCs表面标记鉴定结果
培养至3代的细胞表达间质干细胞表面标记CD29(99.9%)和CD105(100%),部分表达间质干细胞表面标记CD90(36.4%)和Stro-1(3.5%);造血干细胞表面标记CD45表达仅占3.3%;且不表达人免疫抗原HLA-DR(0.0%)(图4)。
2.4 CSCs染色体核型分析
使用Video Test-Karyo软件进行染色体核型分析结果显示:经过3代,28 d的体外培养后,细胞46条染色体核型全部正常,未发现缺失或移位等染色体突变现象(图5)。
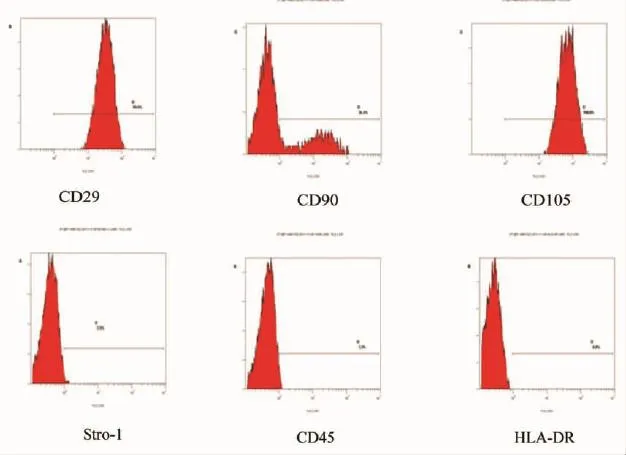
图4 流式CSCs细胞表面标记鉴定结果Fig 4 CSCs cell surface antigen identified of FACS
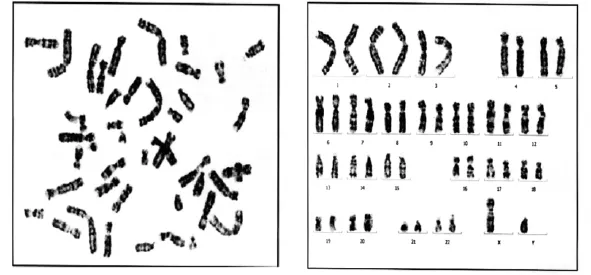
图5 CSCs染色体核型分析结果Fig 5 Karyotype analysis of CSCs
3 讨论
一般认为,成体哺乳动物的心肌细胞已永久地退出细胞周期,在心肌损伤后不能自我更新和修复坏死心肌。但是,最近的研究表明,成体心脏中可能保留着早期胚胎发育的多能CSCs。心脏组织损伤后,如心肌梗塞[4-5],心肌细胞可以再生。目前多数学者认为CSCs是指一种细胞膜上能够表达一种或多种干细胞相关抗原多能干细胞表面标志的未分化细胞,如干细胞因子受体(c-kit),P糖蛋白(MDR)和干细胞抗原(Sca-1)等多能干细胞的表面标志。而且这些细胞在一定条件下,能够分化为心肌组织中的各种细胞的未分化细胞[6]。
2003年Oh等[7]进行了心肌细胞的首次分离,他们将小鼠心脏取出后以胶原酶灌注和消化,消化后的细胞采用磁珠法分离出Sca-1+的心肌干细胞。然而,对于心肌干细胞磁珠分选及鉴定的表面标记各研究的报道并不一致。Wang等[8]证实鼠心脏分离得到的Sca-1+/CD31-细胞体外培养可以诱导表达内皮细胞及心肌细胞标志。但是,如果无诱导分化因子(例如DKK-1、DMSO、BMP2、FGF4、FGF8、5 -azacytidine)的存在,Sca-1+心肌干细胞定向分化成心肌细胞的阳性率是很低的。Laugwitz等[9]证实新生小鼠心脏中存在Isl1+细胞,这些细胞不表达Sca-1、CD31及c-kit,将其与新生心肌细胞共同培养可分化为成熟心肌细胞。在利用谱系追踪技术对Isl1+细胞分化研究显示其能够分化为血管内皮、心内膜、平滑肌、传导系统、右室及左房肌细胞谱系。虽然在新生个体心肌中Isl1+细胞普遍存在,但其在成体哺乳动物的心脏中存在较少,目前仅在右心房中发现,生理功能不详。Dawn等[10]则认为从人心肌组织中分离得到的c-kit+细胞为心肌干细胞。事实上,小鼠、大鼠、狗和人心脏的实验定量数据表明在30000~40000个心肌细胞中有1个CSC,大约65%的所有CSCs共同表达3种干细胞抗原(c-kit、MDR1、Sca-1),20%的为两种抗原,15%为一种抗原。大概5%的细胞不表达c-kit、MDR1、Sca-1。这些表面抗原标记物的分布的不同,是否与细胞的功能不同有关也不清楚[11-12]。
心肌的修复要求心肌细胞和冠状血管的形成,它不可能单单通过分化成心肌就完成修复。因为心肌梗死发生后,心肌细胞的发生并不能使运动功能缺失的区域恢复收缩功能,心肌细胞也不能在缺血的条件下生长存活。同样,血管的单独产生不能恢复和重建梗死区心肌的收缩能力,血管不能带来心脏的动力,心肌重生必须利用多种表型的CSCs的协同作用。因此,依靠个别单一干细胞抗原进行磁珠分选来获取及鉴定CSCs的方法不仅效率低下,具有多种不确定性,同时也不利于得到多种分化潜能的CSCs。
当然,作为多能干细胞的CSCs也表达部分胚胎干细胞(ES)的标志物Nanog、Oct-4、Sox-2和Rex-1。它们在全能胚胎干细胞和生殖细胞上表达,该表达对于维持干细胞的自我更新和多能性是必要的。ES的分化可导致这些标志物mRNA表达的下调。它们不仅是细胞系多能分化的主要调节因子,而且也是主要的作为鉴定全能ES细胞的标志物[13]。CSCs也表达间质干细胞表面标记CD29、CD105、CD90和Stro-1等,但不表达造血干细胞表面标记CD45和人免疫抗原HLA-DR[14-15]。CSCs除表达多能干细胞的某些表面标志外,同时已开始表达早期心肌形成转录因子,如Nkx2.5、肌细胞促进因子-C(MEF-C)和GATA结合蛋白4(GATA4)等[16-17]。这些心肌形成转录因子的表达是CSCs分化发育的先决条件。早期心肌形成转录因子的表达受心肌微环境内多种诱导因素如生长因子和激素等的调控。在CSCs定位到损伤心肌后,转化生长因子(TGF)-β、BMP2和Cripto-1等与CSC表面受体结合,激活干细胞内Smads、TAK1和PI3K等信号转导小分子,继而诱导激活转录因子-2(ATF-2)、GATA4、Nkx2.5和MEF-C等转录因子的表达,启动CSC的终末分化。Nkx2.5是CSCs内最早表达的转录因子之一,参与调控CSC内MLC-v和ANP等终末心肌分化基因的表达[18]。GATA4是具有双重锌指结构的转录因子,参与调控α-MHC、ANP和MLC等多种终末心肌分化基因的表达[19]。干细胞内终末心肌分化基因的表达需要转录因子间的相互协同。总之,多种干细胞表面标记,全能干细胞标志物,以及早期心肌固有转录因子的表达检测是鉴定具有多种分化潜能心肌干细胞的重要前提。
本实验通过胶原酶消化的方法从成人心肌组织中获得单个细胞,不采用个别单一干细胞抗原磁珠分选的方法,而是通过使用自体血清贴壁培养和传代对细胞进行纯化和扩增,大大提高了扩增效率,至3代细胞可增殖至5×107以上,并且在10代后仍然保持旺盛的增殖能力。培养3代后的细胞不仅保持全能干细胞因子Nanog、Oct-4、Sox-2、Rex-1的表达,并且具有心肌转录因子Nkx2.5、GATA4的mRNA和蛋白表达;同时表达间质干细胞表面标记CD29、CD90、CD105(本实验Stro-1呈低表达),但不表达造血干细胞表面标记CD45和人免疫抗原HLA-DR;且经过28 d体外培养后,染色体核型未发生缺失、移位等突变。这些实验结果证实,本实验的方法可以稳定、高效的获取和全面、可靠的鉴定具有多向分化功能的CSCs,为CSCs的基础研究和成人自体CSCs移植技术的临床应用奠定重要的基础。
[1]Nadal-Ginard B,Anversa P,Kajstura J,et al.Cardiac stem cells and myocardial regeneration[J].Novartis Found Symp,2005,265:142-154.
[2]Beltrami AP,Barlucchi L,Torella D,et al.Adult cardiacstem cells are multipotent and supportmyocadial regeneration[J].Cell,2003,114(6):763-776.
[3]Bollini S,Smart N,Riley PR.Resident cardiac progenitor cells:at the heart of regeneration[J].Mol Cell Cardiol,2011,50(2):296-303.
[4]Leistner DM,Fischer-Rasokat U,Honold J,et al.Transplantation of progenitor cells and regeneration enhancement in acute myocardial infarction(TOPCARE-AMI):final 5-year results suggest long-term safety and efficacy[J].Clin Res Cardiol,2011,100(10):925-934.
[5]Giraud MN,Flueckiger R,Cook S,et al.Long-term evaluation of myoblast seeded patches implanted on infarcted rat hearts[J].Artif Organs,2010,34(6):184-192.
[6]Leri A,Kajstura J,Anversa P.Cardiac stem cells and mecha-nisms of myocardial regeneration[J].Physiol Rev,2005,85(4):1373-1416.
[7]Oh H,Bradfutc SB,Gallardo TD,et al.Cardiac progenitor cells from adult myocardium:homing,differentiation,and fusion after infarction[J].Proc Natl Acad Sci USA,2003,100(21):12313-12318.
[8]Wang X,Hu Q,Nakamura Y,et al.The role of the Sca-1+/ CD31-cardiac progenitor cell population in postinfarction left ventricular remodeling[J].Stem Cells,2006,24:1779 -1788.
[9]Laugwitz KL,Moretti A,Lam J,et al.Postnatal isll+cardioblasts enter fully differentiated cardiomyocyte lineages[J].Nature,2005,433(7026):647-653.
[10]Dawn B,Stein AB,Urbanek K,et al.Cardiac stem cells delivered intravascularly traverse the vessel barrier,regenerate infarcted myocardium,and improve cardiac function[J].Proc Natl Acad Sci USA,2005,102:3766-3771.
[11]Mishra R,Vijayan K,Colletti EJ,et al.Characterization and functionality of cardiac progenitor cells in congenital heart patients[J].Circulation,2011,123(4):364-373.
[12]Urbanek K,Torella D,Sheikh F,et al.Myocardial regeneration by activation of multipotent cardiac stem cells in ischemic heart failure[J].Proc Natl Acad Sci USA,2005,102(24):8692-8697.
[13]Kento T,Eishi A,Shoken H,et al.Human cardiac stem cells exhibit mesenchymal features and are maintained through Akt/GSK-3β signaling[J].Biochem Biophys Res Commun,2007,352:635-641.
[14]Pittenger MF,Martin BJ.Mesenchymal stem cells and their potential as cardiac therapeutics[J].Circ Res,2004,95:9-20.
[15]Sakaguchi Y,Sekiya I,Yagishita K,et al.Comparison of human stem cells derived from various mesenchymal tissues:superiority of synovium as a cell source[J].Arthritis Rheum,2005,52:2521-2529.
[16]Ventura C,Zmellu E,Maninchedda E,et al.Protein kinase c signaling transduces endorphin-primed cardiogenesis in GTR1 embryonic stem cells[J].Cire Res,2003,92(6):617-622.
[17]Behfar A,Zingman LV,Hodgson DM,et al.Stem cell differentiation requires a paracrine pathway in the heart[J].FASEBJ,2002,16(12):1558-1566.
[18]Nagai R,Komuro I.Dual effects of the homeobox transcription factor csx/nkx2.5 on cardiomyocytes[J].Biochem Biophys Res Commun,2002,298(4):493-500.
[19]Farrell MJ,Kirby ML.Cell biology of cardiac development[J].Int Rev Cytol,2001,202(1):99-158.
Autologous adult cardiac stem cells amplification efficiency and specific identification in vitro
JI Jun,ZHANG Li,SANG Li-min,LIN Hai-long,HE Xue-zhi,WU Yuan-yuan,YAN Pei-shi,SUN Xi-zhuo
(Department of Central Laboratory,Dalian Municipal Central Hospital,Dalian 116033,China)
[Objective]To establish a stable and efficient adult cardiac stem cells in vitro amplification and identification methods.[Methods]Heart tissue removed in surgery,the cells obtained by collagenase digestion method,using the adherent culture purified cells and passage.Cell proliferation to third-generation,gene expression detected by RT-PCR;cell surface markers detected by flow cytometry;and the karyotype identification analysised by karyotyping.[Results]Through this experiment,the cardiac stem cells in adult cardiac tissue were isolated and purified in vitro.Cells after culture maintained pluripotent stem cell factor Nanog,Oct-4,Sox-2 and Rex-1 mRNA expression,and cardiac transcription factor Nkx2.5 and GATA4 mRNA and protein expression;expressed CD29,CD90,CD105 stem cell surface marker,but not expressed the hematopoietic stem cell surface markers CD45 and human antigens HLA-DR;and chromosome mutation did not occur.[Conclusion]Through this study,establish a stable,efficient autologous adult cardiac stem cells amplification and specific identification method in vitro.And establish an important foundation of autologous cardiac stem cell transplantation for clinical application.
autologous tissue;cardiac stem cell;gene expression;flow cytometry;karyotyping
R541
A
1671-7295(2012)04-0329-06
2012-04-13;
2012-07-01
纪军(1976-),男,辽宁大连人,主治医师。E-mail:cancer-1976@hotmail.com
张利,主任医师。E-mail:tyouri19652004@yahoo.com.cn
