LuxS基因缺失对变异链球菌生物学性状的影响
2012-02-05张耀超
张耀超
(西安医学院口腔医学系,陕西西安710021)
变异链球菌(Streptococcus mutans,Sm,以下简称变链菌)是G+性微需氧菌,可使碳水化合物分解产酸而导致牙齿无机质脱矿,并与牙菌斑生物被膜的形成密切相关。因此,变链菌在人类口腔微生物环境中占有重要的生态地位,是最重要的致龋菌[1]。在自然条件下,绝大多数微生物粘附在一个表面上,以生物被膜(biofilm)的形式生存。牙菌斑就是一种典型的生物被膜,是龋病和牙周病发生的始动因子。生物被膜中的种群基因表达的调节与浮游细菌不同,细菌必须协调大量基因的表达以形成稳定的生物被膜[2]。LuxS基因在G-和G+细菌中都高度保守,由约450~550个碱基对组成。变链菌基因图谱中LuxS基因编码160个氨基酸的LuxS蛋白,LuxS蛋白是一种合成酶,能合成LuxS系统的信号分子即AI-2信号分子[3]。LuxS编码的AI-2信号参与牙菌斑内细菌间的信息交流,并利用群体感应系统调控特定的生理功能[4]。本研究在前期成功构建变链菌LuxS基因缺失突变株的基础上,进一步观察LuxS基因缺失对变异链球菌生长特点和生物被膜形成能力的影响。
1 材料和方法
1.1 主要材料和设备
变异链球菌UA159标准株(四川大学华西口腔医学中心);变链菌LuxS基因突变株(本实验室成功构建并保存);TSA固体培养基、TSA-Cmr固体培养基(含10 μg/mL氯霉素)、BHI液体培养基(北京陆桥生物制品公司);BHI固体培养基(含有25 μg/mL氯霉素的BHI琼脂用以选择性培养突变株);氯霉素粉剂(中国药品生物制品检定所标准产品);结晶紫溶液(天津金章科技发展有限公司);光学显微镜(Olympus,日本);R200电子天平(德国);标准24孔微量板(Costar 3524,Corning Inc.);直径为12 mm圆形盖玻片(江苏盐城恒泰玻璃仪器厂);微量加样器 (Eppendorf公司,德国);紫外分光光度计(BECKMAN,美国)。
1.2 变链菌标准株和LuxS突变株生长特性观察
1.2.1 两菌株在不同培养基中生长情况和鉴定
取-70℃冻存的变链菌 UA159标准株和LuxS突变株,常规复苏后分别接种于TSA固体培养基和 TSA-Cmr固体培养基中,37℃厌氧(800 mL/L N2、100 mL/L H2、100 mL/L CO2)条件下培养48 h后,观察两菌株在两种培养基中的菌落生长情况。同时挑取单个菌落分别进行常规生化鉴定和革兰染色涂片鉴定。
1.2.2 两菌株生长曲线观察
将常规复苏24 h的变链菌UA159标准株和LuxS突变株分别接种于BHI琼脂培养基,37℃厌氧(800 mL/L N2,100 mL/L H2,100 mL/L CO2)条件下培养48 h,分别挑取两菌株单菌落转种于BHI液体培养基增菌,37℃厌氧条件下培养过夜。涂片检查为纯培养后充分混匀,于紫外分光光度计600 nm处制备成吸光度A=1.0的菌悬液备用。将上述菌悬液1 000倍稀释接种于BHI液体培养基,置37℃恒温摇床中孵育,定时取样测量A值,每次每个菌种测3份取均值,以不接种细菌的BHI液体培养基作阴性对照组。实验重复3次。
1.3 变链菌UA159标准株和LuxS突变株生物被膜形成能力的观察
根据Loo等[5]的方法并加以修改,建立变链菌LuxS基因突变株和标准株生物被膜,并染色观察。先在标准24孔微量板中放入直径12 mm的盖玻片,再将复苏24 h的两菌株的菌悬液调节浓度至A600=0.1后,各取500 μL滴至盖玻片表面,同时向孔中加入1 mL BHI液体培养基,另在空白盖玻片滴加等量BHI培养液作为阴性对照组。上述每组复3孔,分别于37℃厌氧条件(800 mL/L N2,100 mL/L H2,100 mL/L CO2)条件下培养48 h后,取出24孔板,微量吸液器吸弃孔内菌悬液,用PBS缓冲液轻轻冲洗以去除表面未粘附的细菌,室温下自然干燥20 min,肉眼观察玻片上生物膜形成情况。然后每孔加入10 g/L结晶紫溶液200 μL,室温下放置20 min后吸弃染色液,用PBS缓冲液轻轻冲洗掉玻片表面的染色液和浮游菌,自然干燥30 min,光学显微镜下分别观察标准株和突变株生物被膜形成情况。
1.4 统计学分析
应用SPSS 13.0统计软件进行统计分析,两组间计量资料(±s)比较用t检验,检验水准α=0.05。
2 结果
2.1 变链菌UA159标准株与LuxS突变株生长特性比较
2.1.1两菌株在不同培养基中的生长情况和鉴定结果
在含10 μg/mL氯霉素的TSA-Cmr固体培养基中,标准株基本不能生长,而突变株的生长状况基本正常。在TSA固体培养基中,两菌株均生长正常,且在菌落形态学上没有明显的表型差别,菌落均为乳白色、呈细小而光滑的隆起状,且边缘整齐。经常规生化鉴定,两菌株均为血清C型(表1)。
涂片、革兰染色后光学显微镜下观察,两菌株均为革兰染色阳性,但形态上存在一定的差异:标准株菌体呈长链状排列而且相互缠绕,局部甚至呈小的团块状,为典型的变链菌形态(图1);而LuxS突变株菌体多数呈短链状排列,形成长链的较少,甚至可以见到不少游离的单个菌体(图2)。
2.1.2两菌株生长曲线的比较
以A值为纵座标,时间为横座标绘制两菌株生长曲线可见,两种菌株在生长模式上基本一致,均呈典型的“S”曲线,只是在进入生长稳定期(11.5~22.5 h)后,两者在细菌饱和度上有一定的差异,即:11.5 h之前各时间点两菌株的A值均无统计学差异(P>0.05);而自11.5 h起至22.5 h内各时间点,LuxS突变株的A值均低于标准株,且差异具有统计学意义(P<0.05)(表2,图3)。
2.2 变链菌UA159标准株与LuxS突变株生物被膜形成能力的比较
培养48 h后肉眼观察,标准株和突变株均能在玻片上形成生物被膜,而阴性对照组未见生物被膜形成。其中标准株的生物膜光滑而完整,且分布均匀,呈乳白色;突变株的生物被膜形态则较标准株粗糙、薄且分布不均匀、大部分形成较大的团块(图4)。当PBS轻轻冲洗盖玻片时,标准株生物被膜与玻片表面结合的较牢固,基本上不受冲洗的影响;突变株被膜内的部分细胞较易脱落,会重新悬浮到冲洗液中。
经结晶紫染色后光学显微镜观察,标准株呈完整片状,几乎较均匀的粘附于玻片表面,并且有一定的厚度;而LuxS突变株形成的被膜量少且薄,被膜团块间有较大的间隙,呈散在的筛孔状分布(图5)。

表1 变链菌UA159标准株和LuxS突变株形态和生化鉴定结果
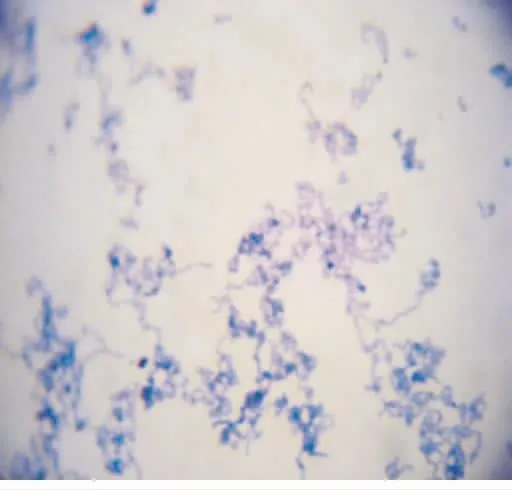
图1 标准株(革兰染色×1 000)

图2 突变株(革兰染色×1 000)
表2 24 h内变链菌LuxS突变株与标准株生长情况比较 (A值,n=9,±s)

表2 24 h内变链菌LuxS突变株与标准株生长情况比较 (A值,n=9,±s)
*与标准株相比P<0.05
时间(h)标准株 突变株0.5 0.018±0.014 0.018±0.020 1.5 0.079±0.024 0.079±0.018 2.5 0.146±0.071 0.143±0.021 3.5 0.247±0.082 0.242±0.032 4.5 0.301±0.079 0.302±0.043 5.5 0.343±0.095 0.343±0.051 6.5 0.394±0.098 0.390±0.057 7.5 0.489±0.083 0.481±0.069 8.5 0.746±0.102 0.703±0.095 9.5 1.258±0.191 1.229±0.107 10.5 2.253±0.304 2.059±0.313 11.5 2.558±0.373 2.272±0.304* 12.5 2.901±0.411 2.457±0.351*………21.5 2.663±0.394 2.399±0.394* 22.5 2.599±0.371 2.369±0.313* 23.5 2.342±0.322 2.217±0.336

图4 变链菌标准株和突变株生物膜肉眼观察
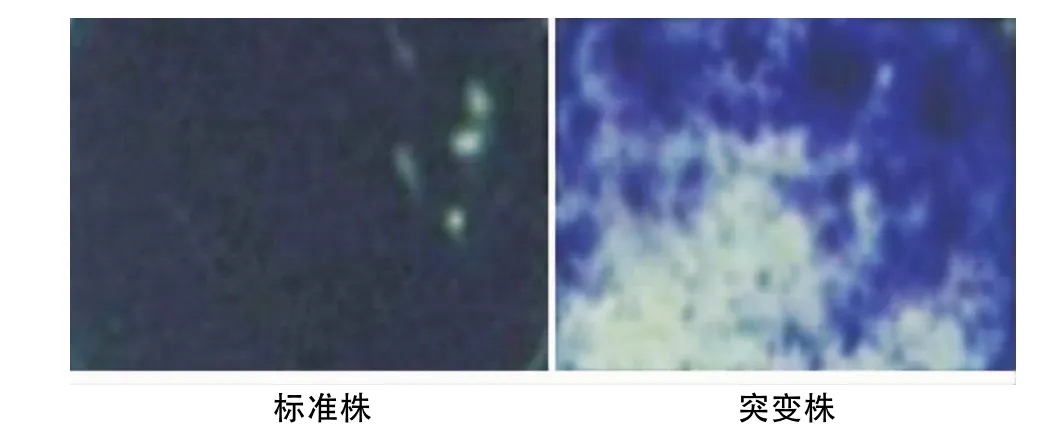
图5 标准株和突变株生物膜结晶紫染色后的镜下观察(×40)
3 讨论
变链菌是最重要的致龋菌,长期以来一直是国内外龋病防治研究的热点。随着分子生物学技术的发展,为了更好地研究某个与龋病相关的酶或基因,通常采用生物学手段突变该基因,构建出基因突变株[6],以期分析该基因在致病方面的作用[7-8]。
目前研究发现:在微生物界存在着两种群体感应调控系统,一种是具有严格种属特异性的种内群体感应调控系统[9-10],另一种是从哈氏弧菌(Vibrio harveyi)研究中发现了特异性的种间群体感应调控系统,即LuxS系统[11],存在于多种拥有特征性LuxS基因的细菌菌群当中。由于LuxS基因在不同菌属中均高度保守,并已陆续发现超过40种致病生物膜构成菌能表达同源的LuxS蛋白,并且合成参与哈氏弧菌LuxS调控的自体诱导物(autoinducer,AI)信号分子,因此推测该系统可能具有种属间的调控作用。在G+和G-细菌中存在一个共同的信号分子为呋喃酰硼酸二酯 (furanosylborate diester),即AI-2信号分子,它可以在细菌菌群间的相互作用中作为一种普遍密度感应信号而发挥功能,LuxS基因就是合成该信号分子的标志性基因。依赖于LuxS的信号系统被认为是一种种属间感应群体系统,在许多种类细菌的重要生理功能和毒性的调节中发挥着重要作用[12]。
有研究显示:细菌生物被膜并不是细菌菌体随机粘连的结果,而是细菌群落相互合作分化成良好结构的结果。生物被膜的生成有赖于几个步骤,即从最初粘附到完全成熟再到成型,从浮游生物到生物被膜生成的转变需要繁琐的代谢作用和生理学变化,其中存在一些促进这一过程的基因调节子。而群体感应系统作为一种基因调节系统被发现涉及细菌生物被膜的生成。
本课题组在先前的实验中采用同源重组法构建了LuxS基因缺失的变链菌突变株:先用PCR方法扩增LuxS基因两端区域目的基因片段,运用基因重组的方法将氯霉素抗性基因连接到上下游两片段之间,并共同构建到PUC19载体的多克隆位点中,构建出带氯霉素抗性标志的LuxS基因缺失突变的pUCluxKO载体;再用电穿孔技术对变链菌进行转化,将突变载体pUCluxKO转化进入变链菌标准株菌体,突变载体与标准株染色体之间发生同源重组,使氯霉素抗性基因置换标准株的LuxS基因,随后因突变载体不能在S.mutans菌体内生长复制而丢失,从而得到LuxS基因缺失的突变株MS△LuxS。为了进一步了解LuxS基因缺失对变链菌生物学性状的影响,本研究通过常规生化鉴定、革兰染色涂片鉴定以及生长曲线测定和体外生物膜模型的建立,以期观察变链菌标准株与LuxS突变株在生物学性状方面的异同。
实验结果显示:标准株在高浓度氯霉素存在的环境下生长受到了明显抑制,甚至会被灭活;而突变株中因含有氯霉素抗性基因片段,因此能在含氯霉素的培养基中正常生长。在不含有氯霉素的TSA固体培养基中培养48 h后,两菌株均能正常生长,且在菌落形态学上没有明显的表型差异,菌落均为乳白色、呈细小而光滑的隆起状且边缘整齐。这说明LuxS基因突变后并不会导致变链菌较严重的生长缺陷,提示AI-2分子的生成并不是基本代谢过程中所必需的条件[13]。LuxS基因突变后,变链菌的生长模式或基本营养素需要量也并没有发生显著的变化[14]。常规生化鉴定显示两种菌株均为血清C型;涂片、革兰染色后观察,两菌株均为革兰染色阳性,但形态有差别:标准株的菌体呈长链状排列且相互缠绕,局部呈团块状,为典型的变链菌形态,而突变株菌体多呈短链状排列,形成长链的比较少,甚至能见到不少游离的单个菌体。这可能是因为LuxS基因突变后变链菌依赖于该基因的群体感应调节机制有了缺陷,在一定程度上影响了菌群间信号分子的传递,从而对菌群的生长方式产生了影响[15]。生长曲线比较发现:两菌株的生长模式基本相同,只是在进入生长稳定期后,标准株的细菌饱和度(A值)明显高于LuxS突变株,提示LuxS基因突变可一定程度上抑制变链菌的生长。生物被膜形成情况观察显示:两菌株均能在玻片上形成肉眼可见的生物被膜,但标准株形成的生物膜相对光滑、比较完整且分布均匀,而突变株的生物膜较为粗糙、分布不均匀、有较大的分散状团块。另外,标准株的生物被膜与玻片表面结合的较牢固,基本不受冲洗的影响,而突变株生物膜内的一部分细胞易脱落,仅少量细胞粘附在玻片上。结晶紫染色后显微镜观察,标准株生物膜呈一定厚度的完整片状,几乎铺满玻片表面,而突变株的被膜量少而薄,有分布不均匀的团块,呈散在的筛孔状分布。说明LuxS基因介导的种间群体感应系统在变链菌生物被膜形成中发挥了重要作用,但其确切的机制还有待于进一步探讨。
[1] Aguilera-Galaviz LA,Aceves-Medina,Mdel C,et al.Detection of potentionally careiogenic strains of Streptococcus mutans using the polymenase chain reaction[J].Clin Pediatric Dent,2005,27(1):47-51.
[2] Costerton JW,Lewandowski Z,Caldwell DE,et al.Microbial biofilms[J].Annu Rev Microbiol,1995,49(3):711-745.
[3] Fuqua C,Parsek MR,Greenberg EP.Regulation of gene expression cy cell-to-cell communication:acyl-homoserine lactone quorum sensing[J].Annu Rev Genet,2001,35:439-468.
[4] Kolenbrander PE,Andersen RN,Blehert DS,et al.Communication among oral bacteria[J].Microbiol Mol Biol Rev,2002,66 (3):486-505.
[5] Loo CY,Corliss DA,Ganeshkumar N,et al.Streptococcus gordonii biofilm formation:identification of genes that code for biofilm phenotypes[J].J Bacteriol,2000,182(5):1374-1382.
[6] Thurnheer T,van der Ploeg JR,Giertsen E,et al.Effects of Streptococcus mutans gtfC deficiency on mixed oral biofilms in vitro[J].Caries Res,2006,40(2):163-171.
[7] Igarashi T,Asaga E,Sato Y,et al.Inactivation of srtA gene of Streptococcus mutans inhibits dextran-dependent aggregation by glucan-binding protein C[J].Oral Microbiol Immun,2004,19 (1):57-60.
[8] Lee SF,McGavin MK.Identification of a point mutation resulting in loss of cell wall anchoring activity of srta of Streptococcus mutans NG5[J].Infect Immun,2004,72(7):4314-4317.
[9] Parsek MR,Greenberg EP.Acyl-homoserine lactone quorum sensing in gram-negative bacteria:a signaling mechanism involved in associations with higher organisms[J].Proc Natl Acad Sci USA,2000,97(16):8789-8793.
[10] Dunny GM,Leonard BA.Cell-cell communication in gram positive bacteria[J].Annu Rev Microbiol,1997,51:527-564.
[11] Schauder S,Shokat K,Surette MG,et al.The LuxS family of bacterial autoinducers:biosynthesis of a novel quorum-sensing signal molecule[J].Mol Microbiol,2001,41(2):463-476.
[12] Yoshida A,Ansai T,Takehara T,et al.LuxS-based signaling affects Streptococcus mutans biofilm formation[J].Applied Environment Microbiol,2005,71(5):2372-2380.
[13] Day WA Jr,Maurelli AT.Shigella flexnexi LuxS quorum-sensing system modulates virB expression but is not essential for virulence[J].Infect Immun,2001,69(1):15-23.
[14] Merritt J,Qi F,Goodman SD,et al.Mutation of LuxS affects biofilm formation in Streptococcus mutans[J].Infection and immunity,2003,71(4):1972–1979.
[15] Lyon WR,Madden JC,Levin JC.Mutation of LuxS affects growth and virulence factor expression in Streptococcus mutans[J].Mol Microbiol,2001,42(1):145-157.
