虾夷扇贝养殖群体及其子代的遗传多样性分析
2012-01-12韩斐斐张继彪张国范闫喜武
韩斐斐, 张继彪, 李 莉, 张国范, 闫喜武
(1. 中国科学院 海洋研究所, 山东 青岛266071; 2. 大连海洋大学, 辽宁 大连116023)
虾夷扇贝养殖群体及其子代的遗传多样性分析
韩斐斐1,2, 张继彪1, 李 莉1, 张国范1, 闫喜武2
(1. 中国科学院 海洋研究所, 山东 青岛266071; 2. 大连海洋大学, 辽宁 大连116023)
虾夷扇贝(Patinopecten(Mizuhopecten)yessoensis)于1982年从日本引进, 在中国已经成为一个很重要的产业。本研究利用微卫星标记, 对獐子岛海域2个养殖群体虾夷扇贝(大耗岛、褡裢岛), 1个日本野生群体遗传多样性进行了评估, 并对 2个养殖群体的群体内繁育和群体间杂交后代进行了遗传和生长检测。结果表明:养殖群体与日本野生群体相比, 其遗传多样性没有显著降低, 养殖群体遗传多样性较高, 养殖状况暂时良好。TL群体和DH群体遗传距离很近, DH、TL群体和RB群体的遗传距离远大于TL群体和DH群体间的遗传距离。说明2个养殖虾夷扇贝群体遗传分化较小。分别对4个子代群体的壳长、壳高在幼苗培育第1、5、10、15、20、100、190天进行测量, 结果表明生长性状差异不显著。4个子代群体的遗传多样性差异也不显著, 说明养殖群体的遗传背景不清楚, 种质资源混交较严重。本研究结果反映了我国虾夷扇贝种质资源评估状况, 并为虾夷扇贝的健康养殖提供基础数据。
虾夷扇贝(Patinopecten(Mizuhopecten)yessoensis); 微卫星; 遗传多样性; 杂交; 生长检测
虾夷扇贝(Patinopecten(Mizuhopecten)yessoensis)原产于日本海周边海域如日本、朝鲜、俄罗斯的海参崴等, 为寒温带贝类。1982年从日本引进, 并人工育苗获得成功。我国适宜养殖的海区仅限于黄海北部冷水团能够覆盖到的海域, 如辽宁的长山群岛,大连沿岸海域, 山东庙岛列岛的北部诸岛及荣成桑沟湾等。其中以大连长海县养殖规模最大。据渔业年鉴中扇贝产量和虾夷扇贝所占比例估算, 目前虾夷扇贝年产量已达30万t, 年产值达数十亿元, 成为中国浅海养殖的支柱性产业, 也是国际上贝类引种养殖最成功的例证之一。
虾夷扇贝主要有筏式养殖和底播增殖, 所用苗种几乎全部依赖育苗室的人工培育。自引进后, 虾夷扇贝以其独有的性状优势为市场所欢迎, 使其养殖规模不断扩大, 现已成为北方海域海水贝类的主要养殖对象之一[1]。自 1990年以来, 虾夷扇贝筏式养殖生产规模不断扩大, 2001~2003年, 虾夷扇贝增养殖规模进入了鼎盛时期[2]。但近几年养殖虾夷扇贝死亡率急剧增加, 在有些海区, 据估算其死亡率已达70%~80%, 与此同时, 育苗稳定性和成功率急剧下降。
自虾夷扇贝引进中国后, 主要采取人工培育方式进行虾夷扇贝苗种生产, 近年来在黄海北部到渤海海峡虽然也发现一些天然苗种, 但数量有限且产量不稳定, 养殖生产所用苗种还是主要依靠人工苗种[3]。随着养殖持续时间的延展, 养殖业规模的不断扩大, 养殖所面临的问题也不断增加, 如育苗难度越来越大, 成功率越来越低, 这不但增加了生产成本, 也影响到产业的健康发展。目前中国虾夷扇贝人工苗种生产所用亲本的来源主要是从自然海区挑选,挑选的标准主要是由有经验的技术人员检查待选亲本的规格、壳型、肥满度、性腺等表型情况[4]。另外,为了增加育苗的成功率, 往往有目的随机挑选两个不同地点的亲贝, 通过群体间杂交的方式进行苗种生产[5]。但是由于对被挑选群体的遗传背景知之甚少,故这种随机挑选有很大的盲目性。
目前, 对于群体的遗传多样性检测主要利用微卫星标记。微卫星的开发和利用在虾夷扇贝中的应用日趋增多。常亚青等[6]用 8对微卫星标记对不同区域的 5个虾夷扇贝群体进行群体遗传学分析, 从5个群体的杂合子状态表明遗传变异主要存在群体内个体之间。赵莹莹等[7]利用磁珠富集法筛选虾夷扇贝微卫星分子标记, 并在俄罗斯和大连 2个虾夷扇贝群体中进行遗传多样性分析。李春艳等[8]采用新型生物素-磁珠吸附微卫星与同位素杂交相结合的方法筛选微卫星引物, 并对大连地区 3个虾夷扇贝养殖群体的遗传结构进行分析。杨璞等[9]用微卫星引物的通用性对栉孔扇贝(♀)×虾夷扇贝(♂)进行杂种鉴定。
本研究利用微卫星分子标记, 对某育苗企业用于苗种生产的 2个养殖群体进行杂交和自繁, 以一个日本群体作为参照, 研究了 2个亲本群体和子代的遗传多样性。并且跟踪检测了杂交和自繁后代的生长情况, 以期从遗传管理的角度, 对虾夷扇贝的苗种生产给予相应的指导和借鉴。
1 材料与方法
1.1 材料
本实验用于进行遗传分析的7个虾夷扇贝群体,分别是在大连獐子岛的特定区域养殖的虾夷扇贝,大耗岛贝(简称DH)、褡裢岛贝(简称TL)、从日本引种的日本贝(简称 RB)和大耗岛贝与褡裢岛贝双列杂交子代:DH自繁 (WDH), TL♀×DH♂(WDT),DH♀×TL♂(WTD), TL 自繁(WTL)。其中, WDH、WDT、WTD、WTL四个子代用于遗传分析的是稚贝(生长到190天测量生长指标后取样)。
其中, 大耗岛贝和褡裢岛贝分别进行群体内自繁和群体间杂交繁育。从每个群体中选择雌雄比例为3 :2的性腺发育完全成熟的个体。阴干1 h后将每一个扇贝单独放入一个 100L的塑料桶中, 加满14℃的新鲜海水充气催产。配子期开始计时, 2 h后开始逐一镜检排放的配子防止雌雄同体贝影响实验结果。当每桶卵排放密度达到50个/mL时将亲贝取出(保证实验用量), 分别等量混合每个群体的精和卵, 再把两个群体的精和卵分别等份分开, 每一群体的卵分别与群体内或群体间雄贝的精液授精, 得到四个交配组合:WDH、WDT、WTD、WTL。群体随机各取48个样本。
1.2 基因组DNA的提取
取虾夷扇贝肌肉, 参照Sambrook等[10]采用常规的酚/氯仿抽提的方法提取DNA。
1.3 微卫星引物来源
使用的10对虾夷扇贝微卫星引物的序列来源于已发表的引物序列[8,11-14], 详细信息见表1。引物序列由上海生工生物工程有限公司合成。

表1 虾夷扇贝微卫星基因座引物序列Tab. 1 Microsatellite primer sequence of Yesso scallop
1.4 生长数据测量
取虾夷扇贝两个养殖群体(大耗岛 、褡裢岛)的双列杂交子代WDH、WTL、WDT、WTD个体各48个, 在虾夷扇贝幼虫培育期的第 1、5、10、15、20天和稚贝期第100、190天, 分别使用显微镜和游标卡尺测定其壳长、壳高。其中, 壳长指贝壳前后缘的最大距离, 壳高指壳顶到腹缘的最大距离[15]。获得的数据, 用Excel和SPSS13.0软件分析和处理, 差异性显著分析采用最小显著差法(Least-Significant difference, LSD)。
1.5 PCR反应和数据分析
PCR 反应体系(15μL):20 ng的基因组 DNA、10×buffer缓冲液(20 mmol/L Mg2+)、0.15 μL Tag 酶、dNTP各0.2 mmol/L、引物各0.3 μmol/L。PCR反应条件:95℃变性5 min; 94℃30 s, 退火30 s, 72℃30 s,30个循环; 72℃延伸10 min, 4℃保存。各对引物的退火温度见表1。用12%的非变性聚丙烯酰胺(丙烯酰胺和甲叉双丙烯酰胺体积比为29 :1)凝胶电泳分离PCR反应产物, 电泳液为1×TBE缓冲液, 电压300 V,电泳 1~2 h(北京六一仪器厂 DYY-Ⅱ型电泳仪,DYCZ-30型电泳槽), Gel-red染色, 利用UVP凝胶成像仪成像。
统计条带以UVP公司Doc-It Ls Image Analysisi Software软件为主, 以手工矫正统计辅助。利用POPGENEGENE (VERSION 1.31) 软件统计微卫星基因座的等位基因数 (Observed number of alleles,Na)、有效等位基因数 (Effective number of alleles,Nea)、观测杂合度 (Observed heterozygosity,Ho)、期望杂合度 (Expected heterozygosity,He)、遗传相似系数 (Genetic similarity index,I)、群体间遗传距离(Genetic Distance,Ds), 并进行多态性信息含量(Polymorphism Information Content, PIC) 分析。
参照 Botstein等[16]的方法计算多态性信息含量(Polymorphism Information Content, PIC):
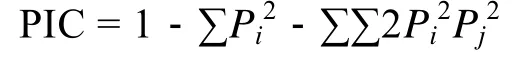
式中,Pi、Pj分别为群体中第i和第j个等位基因频率,n为等位基因数。
亲本数目是影响虾夷扇贝养殖群体遗传多样性的重要指标。根据杂合度的下降来估计有效群体大小 (effective population size,Ne)[17], 公式为:

公式中,Ne是估计有效群体个数;t是世代数;Ht是t代的平均期望杂合度;Ho是亲代的平均期望杂合度。在本实验中,t= 1,Ht是F1群体的杂合度,Ho是亲本群体的平均杂合度。
近交系数(inbreeding coefficient,F)是指根据近亲交配的世代数, 基因的纯化程度。近交率 (ΔF) 公式为:
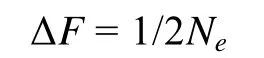
第t代的近交系数 (Ft)[18]公式为:
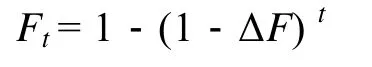
式中,Ne是估计有效群体个数;t是世代数。
2 结果
2.1 生长数据分析
虾夷扇贝两个养殖群体(大耗岛、褡裢岛)的双列杂交子代WDH、WTL、WDT、WTD的壳长、壳高的幼虫期第 1、5、10、15、20天和稚贝期第 100、190天测量结果见表2, 结果表明:4个实验组中, 在幼虫期1、5日龄时杂交组WDT的壳长、壳高生长快于自繁组WDH和WTL, 但差异不显著(P>0.05),杂交组WTD壳长、壳高生长慢于两自繁组; 在幼虫期10日龄时, 自繁组 WTL的壳长生长快于其他 3个实验组, 但差异不显著(P>0.05), WTD壳高生长最快, 与自繁组 WTL差异不显著(P>0.05), 与其他两个实验组差异显著(P<0.05), 但不明显。幼虫期 15和 20日龄时, 杂交组 WDT的壳长、壳高生长快于其他3个实验组, 15日龄时WDT的生长与其他 3组差异显著(P<0.05), 20日龄时 WDT与WDH差异不显著(P>0.05)与其他两个实验组差异显著(P<0.05), 并不十分明显。在稚贝期100日龄时, 杂交组 WTD生长组快于自繁组差异不显著(P>0.05), WDT生长最慢与自繁组WTL差异不显著(P>0.05)与其他两个实验组差异显著(P<0.05); 190日龄时与 100日龄的生长趋势相近, 即杂交组 WTD生长组快于自繁组差异显著(P<0.05), WDT生长最慢与自繁组 WTL差异不显著(P>0.05)与其他两个实验组差异显著(P<0.05); 稚贝期估算的两群体并无显著差异。
2.2 PCR扩增反应结果
实验合成了10对引物, 用每个群体中的8个样本筛选引物, 引物均能显示多态性。利用微卫星引物在虾夷扇贝群体 DH、TL、RB和子代群体 WDH、WTL、WTD、WDT进行 PCR扩增, 都能扩增出特异性条带(图1)。其中, 除XY28的多态性稍低外, 其他位点均表现出较高的多态性。
2.3 群体遗传多样性分析
应用 POPGENE(VERSION 1.31)软件对虾夷扇贝群体进行群体遗传学分析。10个微卫星位点在虾夷扇贝群体大耗岛贝(DH)、褡裢岛贝(TL)和日本贝(RB)中扩增出的等位基因数、有效等位基因数、观测杂合度、期望杂合度、杂交系数、多态性信息含量(表3)。在群体遗传学中,Na、He和Ho等都是反映群体遗传多样性的度量, 其数值越大, 说明基因丰富度越高[19]。本研究中虾夷扇贝养殖群体都表现出较高的遗传多样性水平。
在虾夷扇贝2个养殖群体DH、TL和野生群体RB中, TL群体的平均等位基因数最多, 为4.2613个, DH群体最少, 为 3.8535个, 与观测到的等位基因数相比,每个位点的有效等位基因数较少。多态信息含量是衡量位点多样性的较好指标。在 10个多态位点中, 除XY28、XY35在DH、TL、RB群体表现为中度多态, RB在 XY59中表现为中度多态外, 大部分位点多态信息含量较高。观测杂合度为0.4467~0.6047, 期望杂合度为0.6436~0.6983, 多态性信息含量为0.5599~0.6457,这些位点在虾夷扇贝中都具有较高的多态信息含量,可以应用于虾夷扇贝群体遗传的研究。
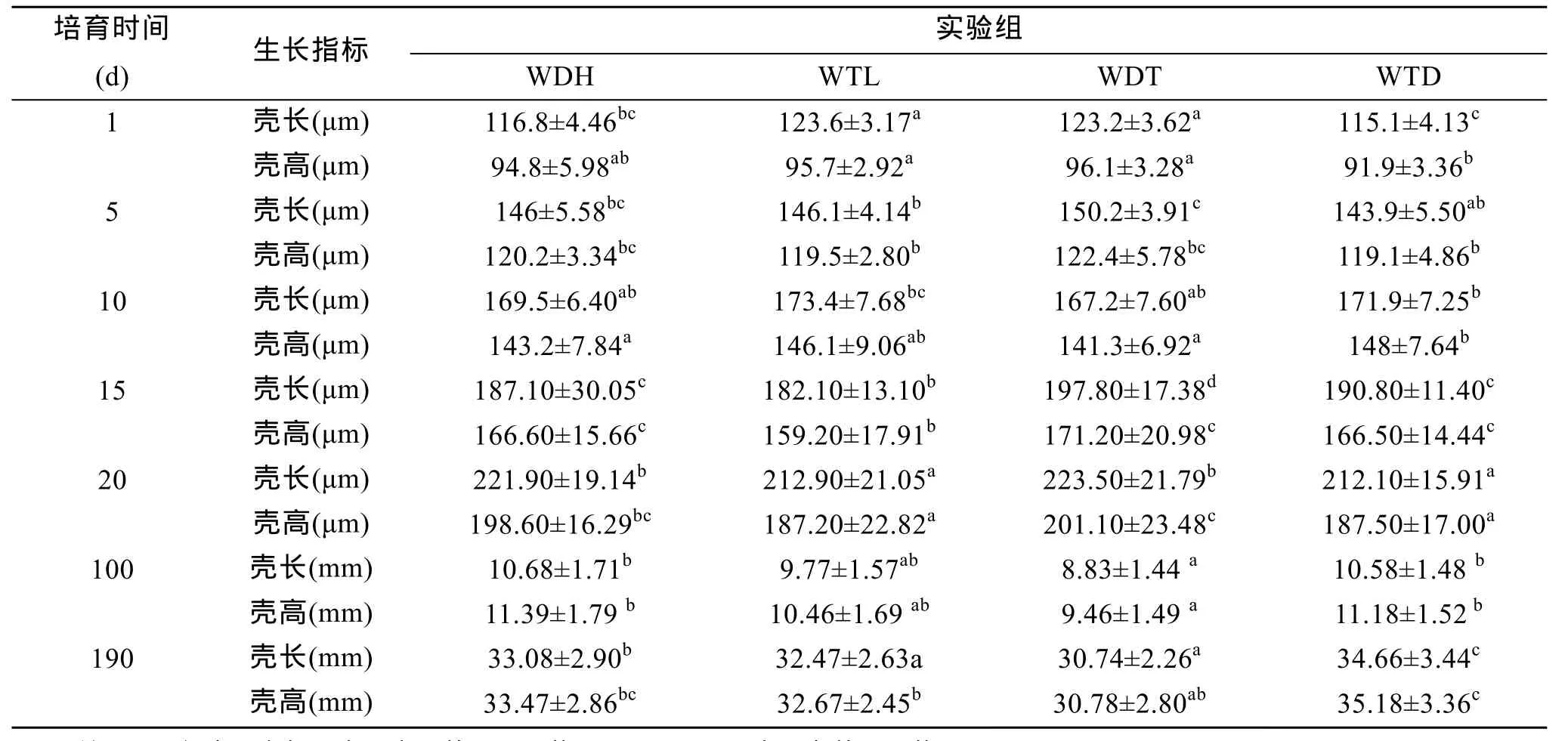
表2 虾夷扇贝壳长、壳高的平均值和标准差及中亲杂种优势Tab. 2 The mean value of shell length, height, standard devitation and heterosis in Yesso scallop

图1 XY4引物在虾夷扇贝TL群体1-24号个体中的扩增情况Fig. 1 The polymorphism at locus XY4 in Yesso scallop (TL population 1-24 individuals)
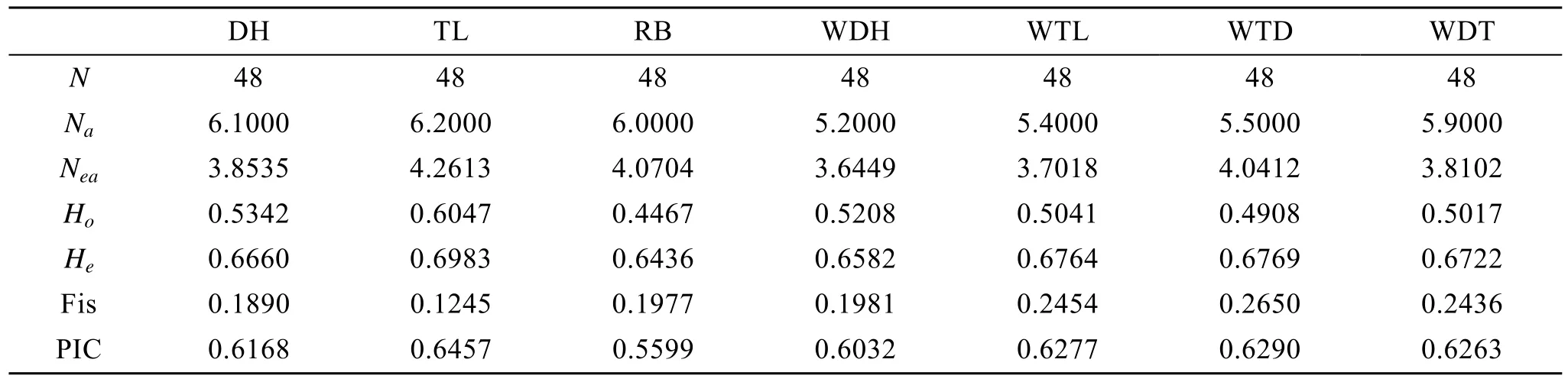
表3 2个虾夷扇贝养殖群体及其子代、1个野生群体和4个F1子代群体的遗传多态性(均值)Tab. 3 The polymorphism information between two cultured populations, one natural population and four F1 populations of Yesso scallop (mean value)
群体 DH 和 TL的等位基因数分别是 6.1~6.2个, 略大于群体WDH 、WTL、WTD、WDT等位基因数, 群体 DH 和 TL 与 WDH 、WTL、WTD、WDT的有效等位基因数相差不大。群体DH 和TL的观测杂合度和期望杂合度略大于子代群体WDH 、WTL、WTD、WDT, 说明群体内交配出现轻微的杂合度缺失。4个子代群体在 10对微卫星引物中, 除有一对引物的多态性信息含量(PIC)值在0.19~0.31之间外,其余引物在各群体中的PIC值为0.36~0.85, 说明虾夷扇贝目前的养殖状况良好。
2.4 遗传分化的计算
通过比较两两群体Fst值(表4)可以看出, DH群体和TL群体间的遗传分化指数低于0.05, 说明两个群体间的遗传分化程度较低, 而TL群体和RB群体、DH群体和RB群体间的遗传分化程度较高。
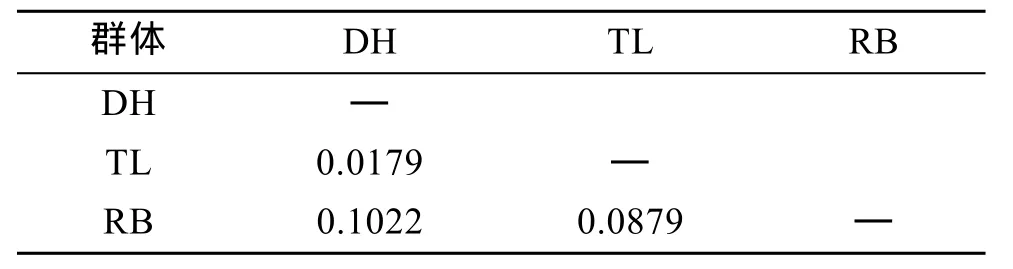
表4 虾夷扇贝DH、TL、RB群体的遗传分化系数FstTab. 4 Pairwise estimates of Fst within three populations of Yesso scallop
通过比较两两群体Fst值(表5)可以看出, 4个群体间的遗传分化指数均低于0.05, 说明4个群体间的遗传分化程度较低。
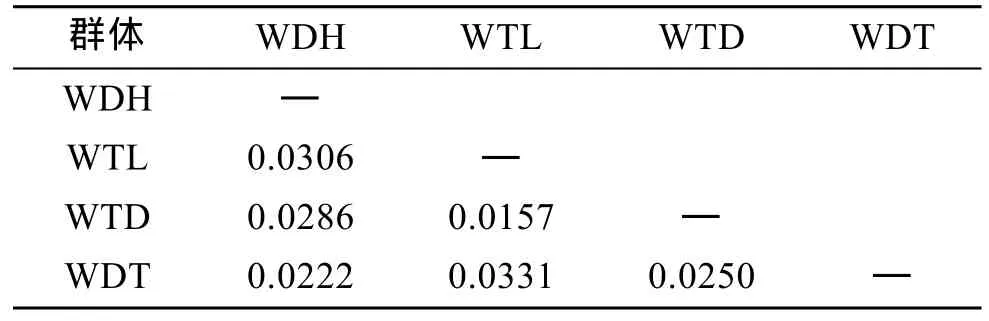
表5 虾夷扇贝F1代4个群体的Fst比较遗传分化系数FstTab. 5 Pairwise estimates of Fst within four F1 populations of Yesso scallop
2.5 Hardy-Weinberg平衡检验
在理想群体中, 群体的基因频率和基因型频率是稳定的。应用POPGENE(VERSION 1.31)数据分析软件, 基于马可夫链模型(Markov chain method)对各群体每个位点的Hardy-Weinberg P值进行无偏估计,4个 F1子代群体的检验结果表现出不同程度的平衡偏离, 其中9个位点没有偏离平衡, 31(77.5%)位点偏离了平衡, 说明这些位点在各群体中基因频率和基因型频率稳定性较差。
2.6 群体间遗传距离
根据Nei[20]分别计算了DH、TL、RB 3个群体和子代4个群体的遗传距离和遗传相似性指数。TL群体和 DH群体遗传距离最近, 遗传相似性指数最高; 和RB群体的遗传距离次之, DH群体和RB群体的遗传距离最远, 相似性指数最低(表6)。这说明从日本当年引种的日本贝(RB)与大耗岛贝(DH)、褡裢岛贝(TL)间的亲缘关系较远。WTL群体和 WTD群体遗传距离较近, 遗传相似性指数较高; WDH群体和 WDT群体遗传距离较近, 遗传相似性指数较高(表7)。
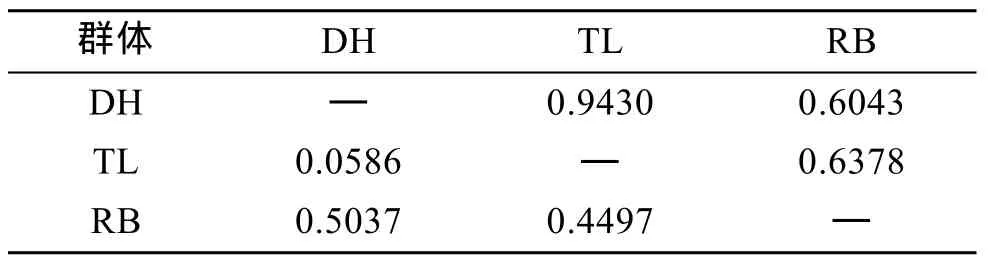
表6 虾夷扇贝 3个群体的 Nei遗传距离(表左下角)及相似性指数(表右上角)Tab. 6 Pairwise estimates of Nei’s unbiased genetic distance (below diagonal) and similarity index(above diagonal) within three populations of Yesso scallop
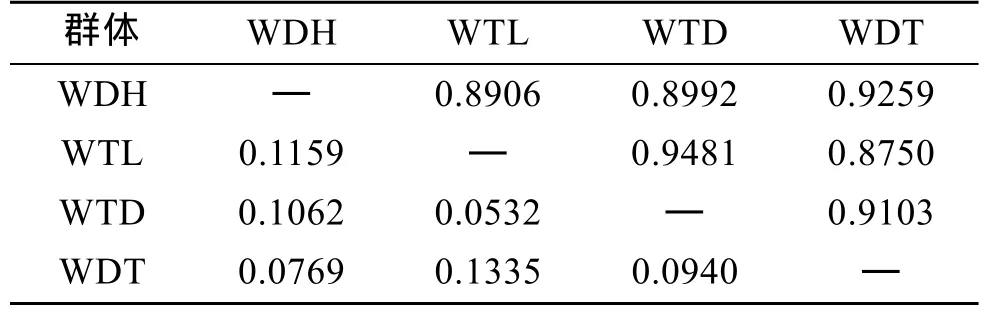
表7 虾夷扇贝4个F1代群体的Nei遗传距离(表左下角)及相似性指数(表右上角)Tab. 7 Pairwise estimates of Nei’s unbiased genetic distance (below diagonal) and similarity index(above diagonal) within four F1 populations of Yesso scallop
2.7 有效群体大小和近交系数
WDH、WTL、WTD、WDT实际使用的亲本总数大于最大有效群体数和估计有效群体数(表8)。相对较低的Ne能导致近交率的增加, 这是近交衰退的原因之一。WDH、WTL、WTD、WDT的近交系数(Ft)分别为 0.0313、0.0263、0.0152、0.0217。
3 讨论
微卫星分子标记不受生物发育时期和环境的影响, 为中性标记。利用微卫星分子标记分析虾夷扇贝亲代与子代遗传多样性, 能够更加客观地反映生物之间的本质差异, 从而能够更加客观地反映生物的种群结构和进化历史。在群体遗传学中,Na、He和Ho等都是反映群体遗传多样性的度量, 其数值越大,说明基因丰富度越高[19]。群体的遗传多样性越高, 其适应环境变化的能力越强。与野生群体相比, 遗传多样性在很多情况下都会降低, 其中在一些海洋生物中都有报道[21-22]。本研究中养殖虾夷扇贝群体的遗传多样性比野生群体没有显著降低, 可能是由于养殖群体的养殖环境适宜, 使自然条件下应该被淘汰的个体保存下来, 保持了养殖群体的遗传多样性。本实验中所检测的大部分位点偏离了 Hardy-Weinberg平衡, 说明虾夷扇贝的种质情况不容乐观,混杂现象较为严重。这与常亚青[6]研究结果相一致。
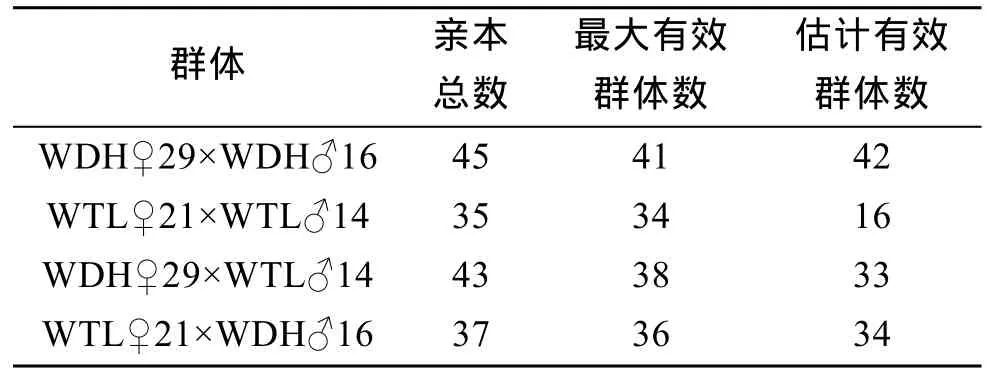
表8 4个子代群体的有效群体数(Ne)Tab. 8 The effective population size (Ne) within four F1 populations of Yesso scallop
本研究中国内养殖群体和日本群体的群体间遗传距离大于 0.4, 这很可能是由于虾夷扇贝作为一个引进种, 有效群体较小, 加之在苗种生产过程中生产单位往往用较少的亲贝尤其是较少的父本, 奠基者效应使得养殖群体和日本野生群体发生较大的遗传分化。常亚青等[6]研究了5个虾夷扇贝的遗传多样性, 虾夷扇贝群体内遗传距离大于0.5。
在本研究中, 4个实验组子代在各日龄, 壳长、壳高生长虽然有一定程度的差异, 但两养殖群体的杂交子代并未表现出明显的差异。分析产生这种现象的原因是由于两群体虾夷扇贝生长性状遗传差异不显著而引起的, 生产用亲贝种质混杂现象比较严重。张立冬等[23]研究了大长山群体、日本陆奥湾群体和獐子岛群体 3个群体的遗传多样性, 发现陆奥湾群体和獐子岛群体遗传距离最近, 遗传相似性指数最高; 陆奥湾群体和大长山群体的遗传距离最远,相似性指数最低, 并指出造成这种现象原因是由于獐子岛在全人工育苗过程中多采用日本扇贝或利用日本扇贝与当地优良种贝进行杂交, 故在遗传多样性水平上与日本虾夷扇贝群体相差不大; 而大长山全人工苗种多采自当地, 累代繁殖及近交等因素影响了其遗传多样性水平, 造成了当地群体与其他两个地区群体的差异。本研究所选用的两养殖群体的亲本可能是由于生产用亲贝种质混杂现象比较严重,从而在生长性状并未获得显著的杂种优势。
目前中国虾夷扇贝人工苗种生产所用亲本的来源主要是从自然海区挑选, 挑选的标准主要是由有经验的技术人员检查待选亲本的规格、壳型、肥满度、性腺等表型情况, 另外也要对既往用其作为亲本的繁育成败情况等做社会调查。但这些检查和调查主要还是凭经验, 也有运气成分。通过本研究可以发现, 虾夷扇贝随机杂交配易造成遗传分化的降低,因此, 生产上这种随机采用用两个地理位置不同的群体杂交是盲目的, 造成虾夷扇贝种质衰退, 对虾夷扇贝养殖产业造成冲击。因此, 从分子水平来研究两群体的自繁子代和杂交子代的遗传多样性, 从根本上解释自繁群体和杂交群体的遗传结构, 采用分子育种方法指导虾夷扇贝的种质改良是非常有意义的。
鉴于虾夷扇贝在养殖过程中很容易出现不同群体混杂的现象, 我们建议实行“种贝”和“菜贝”分区养殖的模式。所谓的“菜贝”去向是作为商品贝流向市场被消费者购买和食用, 所谓的“种贝”是用于进行苗种生产的贝类。用于“种贝”的亲贝必须有系统的谱系分析和良好的保种措施。保种的过程中不但要确保各个种群之间具有严格的隔离, 而且在世代之间能够确保遗传结构得到最大程度的保留。
[1]李文姬, 薛真福. 持续发展虾夷扇贝的健康养殖[J].水产科学, 2005, 24(9):49-51.
[2]张明明, 赵文. 我国虾夷扇贝死亡原因的探讨和控制对策[J]. 鱼病诊治, 2008, 2:65-74.
[3]常亚青, 王庆志, 宋坚, 等. 黄海北部大连沿岸虾夷扇贝天然苗采集技术研究[J]. 海洋水产研究, 2007,28(6):39-44.
[4]王海涛, 王世党, 姜启平, 等. 虾夷扇贝育苗综合技术[J]. 中国水产, 2008, 4:55-56.
[5]杨爱国, 王清印, 刘志鸿, 等. 栉孔扇贝与虾夷扇贝杂交及子一代的遗传性状[J]. 海洋水产研究, 2004,25(5):1-5.
[6]常亚青, 陈晓霞, 丁君, 等. 虾夷扇贝(Patinopecten yessoensis)5 个群体的遗传多样性[J]. 生态学报,2007, 27(3):1145-1152.
[7]赵莹莹, 朱晓琛, 孙效文, 等. 虾夷扇贝的多态性微卫星座位[J]. 动物学报, 2006, 52(1):229-233.
[8]李春艳, 丁君, 常亚青, 等. 虾夷扇贝微卫星标记的分离及其养殖群体的遗传结构分析[J]. 中国水产科学, 2009, 16(1):39-46.
[9]杨璞, 杨爱国, 刘志鸿, 等. 栉孔扇贝和虾夷扇贝通用微卫星引物的筛选及其在杂种鉴定中的应用[J].安徽农业科学, 2008, 36(19):8287-8289.
[10]Sambrook J, Fritsch E F, Maniatis T. Molecular Cloning:a Laboratory Manual, 2nd edn[M]. New York:Cold Spring Harbor Laboratory Press, 1989.
[11]慧敏. 扇贝微卫星标记的筛选及其在物种鉴定中的应用[D]. 青岛:中国海洋大学, 2008:28-29.
[12]高祥刚, 曹洁, 刘莹, 等. SSR 不对称 PCR 法分析虾夷扇贝遗传多样性[J]. 生物技术通报, 2009, 2:118-123.
[13]李云峰, 刘卫东, 高祥刚, 等. 虾夷扇贝外套膜和肾脏组织cDNA文库构建以及 EST的初步分析[J]. 中国水产科学, 2010, 17(3):578-585.
[14]赵海波. 虾夷扇贝遗传连锁图谱的构建[D]. 青岛:中国海洋大学, 2009:34.
[15]张存善, 常亚青, 曹学彬, 等. 虾夷扇贝体形性状对软体重和闭壳肌重的影响效果分析[J]. 水产学报,2009, 33(1):87-94.
[16]Botstein D, White R L, Skolnick M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. Am J Hum Genet, 1980,32(3):314-331.
[17]Saavedra C, Guerra A. Allozyme heterozygosity, founder effect and fitness traits in a cultivated population of the European oyster, Ostrea edulis[J]. Aquaculture,1996, 139(3-4):203-224.
[18]张国范, 郑怀平. 海湾扇贝养殖遗传学[M]. 北京:科学出版社, 2009:36-50.
[19]陈蒙, 常亚青, 孙谦, 等. 虾夷扇贝群体的遗传结构及微卫星标记与体尺、体重的相关性分析[J]. 大连水产学院学报, 2009, 24(4):311-316.
[20]Nei M. Estimation of average heterozygosity and genetic distance from a small number of individuals[J].Genetics, 1978, 89(3):583.
[21]Hedgecock D, Sly F. Genetic drift and effective population sizes of hatchery-propagated stocks of the Pacific oysterCrassostrea gigas[J]. Aquaculture. 1990, 88:21-38.
[22]Porta J, Porta J M, Martinez-Rodriguez G, et al. Genetic structure and genetic relatedness of a hatchery stock of Senegal sole (Solea senegalensis) inferred by microsatellites[J]. Aquaculture, 2006, 251:46-55.
[23]张立冬, 王蕾, 高悦勉. 虾夷扇贝遗传结构及微卫星标记与经济性状相关分析[J]. 生物技术通报, 2010,11:115-112.
Genetic diversity in two-generation of cultured Japanese scallop (Patinopecten(Mizuhopecten)yessoensis) populations
HAN Fei-fei1,2, ZHANG Ji-biao1, LI Li1, ZHANG Guo-fan1, YAN Xi-wu2
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Dalian Ocean University,Dalian 116023, China)
Dec.,12,2011
Patinopecten(Mizuhopecten)yessoensis; microsatellites; genetic diversity; hybridization; growth detection
The Japanese scallop (Patinopecten(Mizuhopecten)yessoensis) was introduced into China in 1982. Since then, the culture of Japanese scallop has become an important industry in China. In this study microsatellite was used to investigate the genetic variations of two cultured populations [one from Dahao island (DH) and another from Talian island (TL)]and one wild Japanese scallop population (RB). The four F1progeny populations were the one hatchery population which from Dahao island (WDH), one population from Talian island (WTL), one outcrossed population (WTD population) from Dahao island (♀) and Talian island (♂), one outcrossed population(WDT population) from Dahao island (♂) and Talian island (♀). Forty-eight individuals from each population were analyzed. Amplification was performed in a PCR reaction and its products were separated by 12% non-denaturing polyacrylamide gel. The difference in genetic diversity among two cultural populations (DH and TL population) and one natural population (RB population) was not significant. The two cultural populations were in good condition temporarily. According to their genetic similarity (I) and genetic distance (D), we found that the genetic distance between DH and TL was the least. The phenotype characters (shell length and shell height) of four F1progeny populations scallop were measured at 1, 5, 10, 15, 20, 100, 190 days old. Non-significant differences were found between different characters in four F1progeny populations at different growth stages. The difference in genetic diversity among the four F1progeny populations was not significant, either. The results showed the genetic background of cultured populations was not clear and cultured populations were mixed with each other seriously. The results of this study reflect resources evaluation situation for Japanese scallop in our country and provide the basis of data for health breeding of Japanese scallop.
Q751 文献标识码:A 文章编号:1000-3096(2012)09-0001-08
2011-12-12;
2012-04-22
中国科学院海洋研究所獐子岛渔业海洋生态养殖联合实验室开放研究基金; 中国科学院重要方向项目群(KZCX2-EW-Q21)
韩斐斐(1984-), 女, 硕士研究生, 从事水产养殖分子生物学研究, E-mail:hanfeifei0325310406@126.com; 张国范, 通信作者, 研究员, E-mail:guofanzhang2005@163.com
致谢:感谢中国科学院海洋研究所李娟、王家丰、王威和大连海洋大学霍忠明、杨霏、王琳楠对实验的帮助。
梁德海)
