藤壶科DNA分类研究
2012-01-12安建梅沙忠利
原 帅 , 安建梅, 沙忠利
(1. 山西师范大学, 山西 临汾 041004; 2. 中国科学院 海洋研究所, 山东 青岛266071)
藤壶科DNA分类研究
原 帅1,2, 安建梅1, 沙忠利2
(1. 山西师范大学, 山西 临汾 041004; 2. 中国科学院 海洋研究所, 山东 青岛266071)
围胸总目藤壶科的分类系统经历了二亚科系统(小藤壶亚科 Chthamalinae,藤壶亚科 Balaninae)、三亚科系统[藤壶亚科(Balaninae), 巨藤壶亚科(Megabalaninae),凹藤壶亚科(Concavinae)], 现在采用的是四亚科系统[藤壶亚科(Balaniae)、纹藤壶亚科(Amphibalanus)、巨藤壶亚科(Megabalaninae)和凹藤壶亚科(Concavinae)], 但各亚科之间的系统演化关系尚未进行过分子系统学方面的研究。许多藤壶科物种存在趋同进化的趋势, 致使传统的形态分类存在困难, 不能正确地进行鉴别。本文测定了藤壶科 3个亚科里个代表种的线粒体COI,16S和12S基因的部分序列, 结合GenBank中藤壶科其他物种的12S,28S和18S等基因序列, 比较了不同基因片段作为鉴别藤壶科物种的条形码的可行性和有效性, 并联合16S和12S序列初步分析了藤壶科各亚科之间的一些亲缘关系。研究结果表明:COI基因的种间和种内遗传距离有明显的间隔区,COI最小种间距离为0.122, 远大于最大种内距离0.023, 而16S基因的种间与种内距离存在覆盖, 最小种间距离为 0.018, 小于最大种内距离 0.023, 因此表明, 线粒体基因COI能更准确地鉴定藤壶科种间以及种内关系, 并得出阈值为种内差异小于0.023, 种间差异大于0.1。ML和BI系统发育分析结果基本一致, 支持4亚科的分类系统; 巨藤壶亚科形成明显单系群, 支持率很高,而两种纹藤壶和管藤壶聚成一支, 形成一个单系, 本结果支持Newman & Ross的假说, 即纹藤壶属和管藤壶属应合并。
藤壶科; 条形码; DNA; 亚科; 系统发育
围胸总目藤壶科蔓足类, 是营固着生活的海洋甲壳动物, 隶属于甲壳动物亚门颚足纲壳甲亚纲(Thecostraca), 蔓足下纲(Cirripedia), 该类群绝大多数种类分布在热带、温带以及两极海洋的沿岸区与亚沿岸区, 不少种类大量群栖, 分布稠密。由于藤壶幼体能随洋流移动, 加之成体可随附着物体如船舶、鲸、海龟等运动, 所以扩散很快, 而广泛分布于世界海洋。此外, 因成体营固着生活, 常牢固地附着在堤坝、码头等水工建筑物, 水底电线等水下设施、船舶、有机体及天然石礁上, 密集群栖时对海防、海运交通、工业和渔业等均十分有害[1]。
藤壶科分类学虽经历了漫长的历史, 但长期以来主要是以壳板形态如幅部, 翼部的宽窄(图1), 壳表面肋的形态、盖板等作为分类依据。直到20世纪中期, 口器、蔓足的毛序等软体结构才被应用到藤壶分类中(图2)。藤壶科成体均为附着生活, 壳板经常受到海浪泥沙的冲刷且喜密集群居, 致使一些形态分类学上的特征变化较大。传统的形态学分类法具有诸多局限性(1)受物种性别和发育阶段的限制,一些物种在不同性别和不同发育阶段, 形态会有差别;(2)无法鉴定许多物种中普遍存在的隐存分类单元;(3)表型可塑性和遗传多样性容易导致不正确的鉴定,隐存种的存在更加剧了物种鉴定的困难[2]。
DNA条形码(DNA Barcoding)是近几年来国际生物学研究的热点之一。理想的DNA条形码检测到的同属内种间遗传差异应明显大于种内遗传差异,且在两者之间有明显的间隔区, 即存在Barcoding gap;它是评价DNA条形码理想与否的一个重要指标[2]。用于DNA条形码研究的标准基因, 一方面应该足够保守, 能够利用通用引物进行大范围的扩增; 另一方面应该有足够的变异来区分不同物种。因此, 在鉴定不同类群的物种时需要选择有效的目的基因, 备受研究者关注的 DNA 条形码基因为线粒体COI基因序列。近来关于藤壶科类群的DNA条形码研究较少, 本文以藤壶科蔓足类为研究对象, 在形态学分类鉴定的基础上, 测定多种藤壶类的线粒体基因COI,16S和12S的部分序列, 结合GenBank中的18S,28S及12S的部分序列作为参考, 重点讨论线粒体基因COI和16S在藤壶类物种鉴定中的可行性和有效性,并联合16S和12S两个线粒体基因序列分析了藤壶科亚科间系统演化关系。
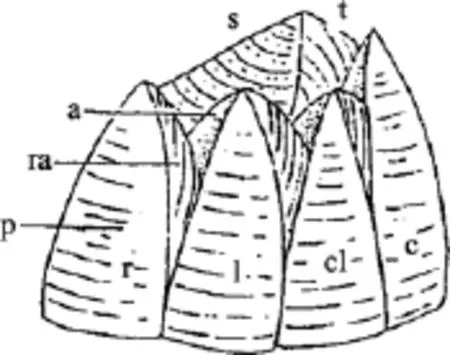
图1 藤壶外部结构Fig. 1 Barnacle external structure
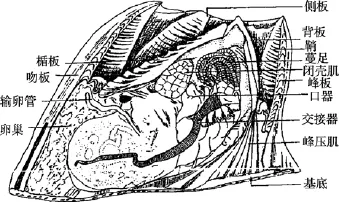
图2 用于形态分类的藤壶内部结构Fig. 2 The barnacle internal structure for Shape classification
1 材料与方法
1.1 样品采集及总DNA的提取
本文共收集了21个新鲜样本, 所有样本采集后均保存在 75%的分析纯酒精溶液中, 样本的标本号及采集地详见表1, 所有样品经任先秋研究员形态学鉴定后, 共包括藤壶科3属7种。采用TIANGEN海洋动物组织提取试剂盒提取总DNA后存放于–20 ℃冰箱中备用。
1.2 目的基因的扩增及其序列的测定
1.2.1 引物的选定
本文共扩增了COI,16S和12S等3个线粒体基因片段, 引物分别如下:LCO14905'-GGTCAACAAATCATAAAGATATTGG-3', PPCO1_JR 5'-CTTTAATACCTGTAGGGACAGCA-3'[3]; 1471F 5'-CCTGTTTANCAAAAACAT-3', 1472R 5'-AGATAGAAACCAACCTGG-3'[4], 5'-GAAACCAGGATTAGATACCC-3', 5'-TTTCCCGCGAGCGACGGGCG-3'[5]。
1.2.2 基因的扩增
PCR扩增采用 25 μL反应体系, 其中包括PCRMIX12.5 μL,上、下游引物各 3 μmol/L 和 6.5 μLDNA 模板。反应设置的条件如下:94℃, 4 min;94℃, 30 min, 45℃, 1 min, 72℃, 1.5 min, 30个循环;最后72℃延伸10 min。
1.2.3 序列的测定及校对
PCR产物经凝胶检测、纯化并克隆后将菌液送至华大基因公司采用 ABIPRISMTM3730XL DNA Analyzer 测序仪双向测序, 在BioEdit中进行正反向校正拼接。COI序列没有插入和缺失, 可翻译成氨基酸序列, 且在 NCBI 中 Blastn中为和围胸类相似度最高, 排除了假基因的干扰。
1.3 数据分析
本文共获得19条COI序列, 19条16S序列和4条12S序列, 长度分别为 887bp, 529bp, 338bp。从GenBank中下载了藤壶科其他种(表1中*标物种)共10条16S序列, 3条COI序列, 11条18S序列, 9条28S序列, 13条12S序列, 经软件Clustalx比对后, 将同一基因序列剪切成同一长度, 最后获得COI长度为653 bp,16S长度为529 bp,12S长度为338 bp,18S长度为1803 bp,28S长度为1785 bp。在Mega4.0软件中计算碱基含量、遗传距离(模型选择为 Kimura 2-parameter)和构建 NJ树[6]。在 Bioedit中将其相对应的种的16S和12S序列拼接在一起, 得到总长为864 bp的数据集。用Modeltest软件选择最优模型, 并在Paup*4.0b10软件中构建MP和ML树。贝叶斯分析在MrBayes 3.1.2软件中完成[7-8]。
2 结果与讨论
比较各基因最终序列片段, 变异位点和简约位点详见表3。COI基因序列没有插入缺失。18S在722位点处有碱基插入, 1746位点处缺失,12S,16S和28S均有多处插入缺失。
2.1 碱基组成
用软件 MEGA4对各基因片段进行碱基含量分
析(表2), 线粒体基因16S,COI,12S中 A+T 含量均明显高于 G+C 含量, 均未达到饱和, 碱基组成表现出明显的偏倚性, 核基因18S和28S则相反, A+T含量小于G+C含量。
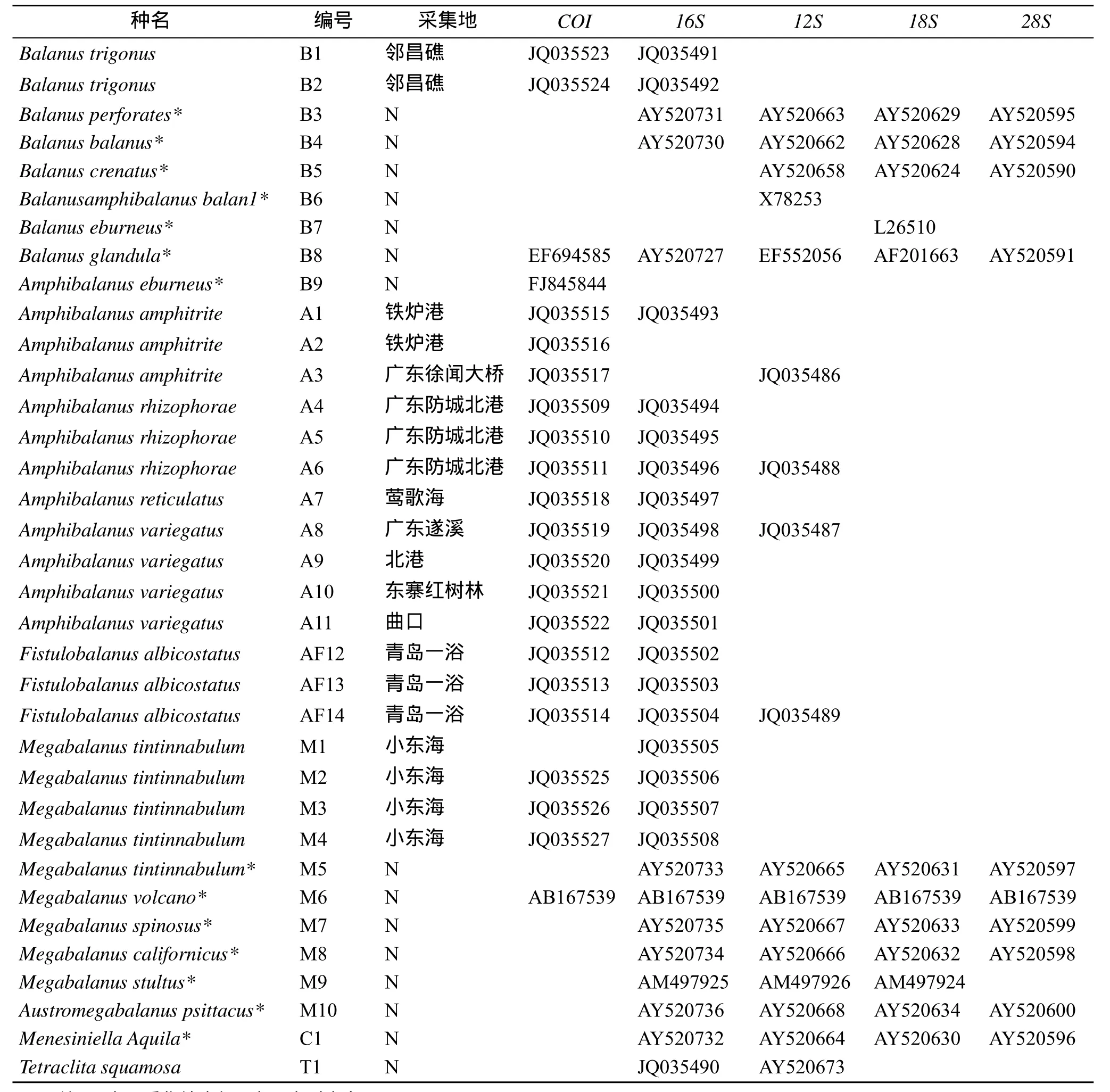
表1 样本的序列号及采集地Tab. 1 Serial numbers and sampling locations of the samples
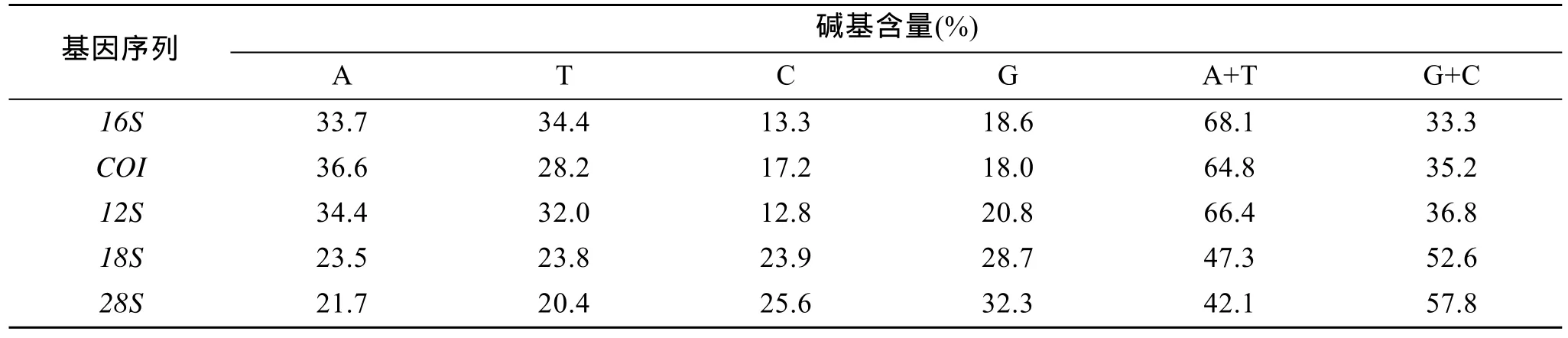
表2 5种基因片段碱基含量Tab. 2 Base contents of the fivegenefragments
2.2 藤壶科几个物种种间及种内的遗传距离
基于线粒体基因16S序列的平均种间遗传距离为0.078, 其中采自广东的红树纹藤壶(Amphibalanus rhizophorae)和来自美国的Austromegabalanus psittacus(AY520736)序列差异最大为 0.125, 而红巨藤壶 (Megabalanus volcano(AB167539))和M.californicus(AY520734)序列差异最小只有 0.018,与 Hebert等[9]利用序列数据分析结果所得的种间遗传距离大于 0.1不相符。基于COI序列的平均种间遗传距离为 0.181, 其中采自广东的红树纹藤壶(A.rhizophorae)和采自海南岛的网纹纹藤壶(A.reticulatus)序列差异最小为0.140, 大于0.1, 很好地将藤壶科各个种区分开。采自青岛的白脊管藤壶(Fistulobalanus albicostatus)和海南的钟巨藤壶(Megabalanus tintinnabulum)差异最大为0.218, 且钟巨藤壶与其他的藤壶科物种差异度大部分均为 0.2以上, 这表明巨藤壶与其他类群亲缘关系较远。基于12S序列的平均种间距离为 0.102, 其中Balanus amphibalanus balan1和M.californicus序列差异最大的为 0.155, 而采自海南小东海的钟巨藤壶(M.tintinnabulum)和红巨藤壶(M.volcano)差异最小只有0.000; 基于18S序列的平均种间遗传距离为0.013,Balanus crenatus和Megabalanus spinosus之间遗传距离最大为0.022; 基于28S序列的平均种间距离为0.038, 最大差异序列为0.061, 而最小为0.000, 结果表明12S,18S,28S种间差异均太小, 不足以区分种级阶元(表3)。本研究结果表明COI最适合作为藤壶科种级阶元分子鉴定的标准基因, 而16S次之,12S,28S,18S均不适合区分藤壶科种间关系。
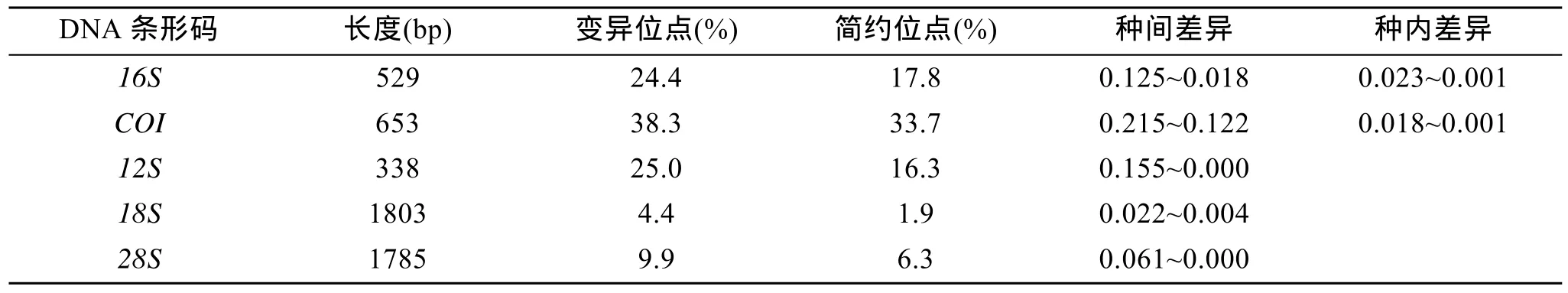
表3 基于5种DNA条形码遗传距离Tab. 3 Genetic distance on the basis of the 5 DNA barcodes
为了进一步探讨COI和16S条形码的适用性,将所得到的数据划分为5个组, 分别为藤壶组BTR,红树纹藤壶组 ARH, 杂色纹藤壶组 AVA, 白脊管藤壶组FAL, 钟巨藤壶组MTI。该五组的16S种内平均遗传距离分别为0.010,0.001, 0.004, 0.001,0.023, 均居于 0~0.023区间内, 与之前16S平均种间距离0.078, 形成明显间隔(图3), 能较好的区分藤壶科物种的种下阶元, 而基于COI序列, 该五组的种内平均距离分别为 0.005,0.001, 0.011,0.018,0.007, 其中ARH组内差异最小只有 0.001, 而 FAL组内差异最大为0.018, 均小于0.020, 而基因COI平均种间距离为0.181, 形成明显间隔区(图3), 结果表明COI基因和16S基因均适合作为藤壶类种下阶元鉴定的分子标记。
2.3 DNA条形码
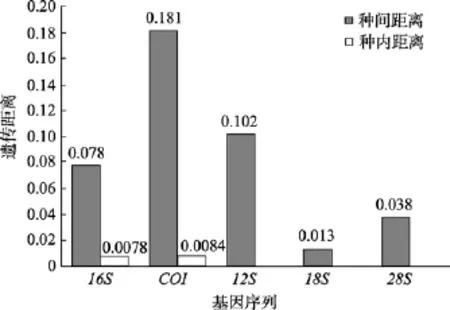
图3 5种分子标记遗传距离Fig. 3 Genetic distances of 5 molecular markers
DNA 条形码(DNA Barcoding)是近几年来国际生物学研究的热点之一, 受零售业中作为产品通用代码的“商品条形码”的启发, Herbert等[10]提出 DNA条形码概念(DNA Barcoding), 即利用一段短的DNA序列作为物种快速鉴定的标记,并希望以此建立DNA序列和生物物种之间一一对应的关系。Hebert等[11]2003年对动物界中除刺胞动物门外的其他动物门, 共11门13320个物种的CO1基因序列进行分析,发现其序列间的差异能够很好地区分所有研究物种,并认为在动物界中CO1基因是合适的DNA条形码标准基因。Bucklin等[12]用线粒体COI基因序列(639 bp)分析了桡足亚纲哲水蚤目 10属 34种系统关系,结果表明线粒体COI基因序列能很好的鉴别和区分哲水蚤的物种, 种内变异为 1%~4%, 远小于种间变异(9%~25%)。本文尝试利用线粒体COI序列鉴定甲壳动物, 通过研究 23目150种甲壳动物, 结果表明COI基因序列可以很好地区分目及以下阶元, 在甲壳动物快速鉴定中非常有效[13]。Bucklin等[14]的研究表明DNA Barcode(COI序列, 650 bp)可以很好解决磷虾同属近缘种的关系和发现隐存种。Elias-Gutierrez 等[15]应用COI序列成功鉴定了来自墨西哥和危地马拉的 61种 Cladocera 和 21种Copepoda浮游动物(代表了当地 40%的物种), 并发现了多个隐存种。本文通过对藤壶科物种COI,16S,12S,18S,28S等5种不同的DNA序列分析, 结果表明COI基因能够准确辨别藤壶科的各物种, 其中,藤壶科各科物种之间的平均遗传距离最小为 0.122,而各组种内平均遗传距离最大为 0.018(表3), 与之前Hebert等[11]分析结果相似, 同属各种COI序列的平均差异程度是 11.3%, 而种内的COI序列差异程度通常都很低, 低于2%。同时用COI作为条形码来对藤壶科物种进行鉴定的结果与目前公认的以形态划分的藤壶科物种分类地位相一致, 进一步证明了条形码学说的可行性, 也验证了COI基因适合作为藤壶科物种DNA分类的分子标记, 且阈值为种间大于10%, 种内小于2%。
2.4 白脊管藤壶和红树纹藤壶的关系
尽管红树纹藤壶和白脊管藤壶分属为两个属,但在潮间带这两种常混栖在一起, 且条纹的颜色也彼此相似, 尤其后者的壳板经海浪泥沙冲刷后极似红树纹藤壶, 个体大小相似, 难于区分, 常被混淆。形态分类学上, 根据红树纹藤壶的壳无纵肋, 壁板管道的外壁无次级窝, 盖板内面白色, 第3蔓足决无锯齿刚毛等一系列特征来与白脊管藤壶进行区别,但是由于一些自然的不可抗拒的原因, 以及幼体时期无法明确判定以上的各项形态标准, 给分类鉴定工作带来了很多困扰, 本文白脊管藤壶与红树纹藤壶的COI基因遗传距离为0.189, 大于10%, 支持这两个物种为不同物种, 且白脊管藤壶和红树纹藤壶的种内遗传距离分别为0.018和0.001, 均小于2%,证明COI基因能清楚的区分白脊管藤壶和红树纹藤壶的种内和种间水平。本文结果表明, 白脊管藤壶和红树纹藤壶仅仅是可能因为混栖在相同的生境等原因造成外部形态趋同进化, 但实质上是两种不同的物种。
2.5 藤壶科系统发育的初步分析
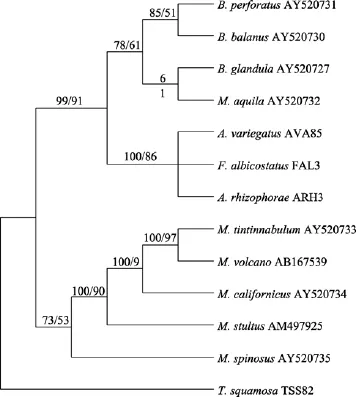
图4 基于16S+12S基因序列数据集的进化树Fig. 4 The phylogenetic tree of family Balanidae based on16S+12S genes
围胸总目藤壶科的分类系统经历了二亚科系统(小藤壶亚科 Chthamalinae,藤壶亚科 Balaninae)、三亚科系统(藤壶亚科 Balaninae, 巨藤壶亚科Megabalaninae, 凹藤壶亚科 Concavinae)及四亚科系统(藤壶亚科 Balaniae、纹藤壶亚科 Amphibalanus、巨藤壶亚科Megabalaninae和凹藤壶亚科Concavinae亚科), 目前普遍采用的 4亚科分类系统[16]。Modeltest选用的最优模型是 TVM+I+G。本文联合16S和12S两个线粒体基因序列分析了4亚科间的系统演化关系。MP树支持率较低, 本文没有采用, ML和BI两个系统发育树拓扑结构基本一致(图4), 基本支持目前 4亚科的分类系统, 拓扑树中藤壶科物种明显分为3个分支, 且均有较高的支持率。图中巨藤壶亚科的物种形成单系, 位于拓扑结构的根部, 起源较早, 支持率为BI:73, ML:53。巨藤壶亚科的物种壁板有管, 基底钙质, 幅部发达, 齿隔片之间具有横管, 藤壶科其他4个亚科的物种均不具有横管, 且巨藤壶亚科的物种普遍比其他科物种个体大, 这些形态特征均支持巨藤壶亚科为单系群, 同时也表明这些特征在藤壶科分类中是祖征。纹藤壶亚科居于拓扑树的中间, 成为一支, 有较高的支持率, BI:100,ML:86,但管藤壶属与纹藤壶形成一个并群; Zullo[17]仅根据形态学上壁板有附加管将管藤壶从纹藤壶属中分出并提升为属, 有待商榷, 本文结果支持Newman等[18]的假说即纹藤壶属似应与管藤壶属合并。藤壶亚科和凹藤壶亚科聚为一支, 形成姐妹群,位于拓扑树的内部, 但是支持率较低, 加上凹藤壶亚科仅仅包括 1种, 关于这两个亚科间的亲缘关系,有待进一步的研究探讨。
[1]刘瑞玉, 任先秋. 中国动物志 甲壳动物亚门 蔓足下纲 [M]. 北京:科学出版社, 1997.
[2]Meyer C P, Paulay G. DNA Barcoding:error rates based on comprehensivesampling [J]. PLoS Biol, 2005, 3:2229-2238.
[3]VanSyoc R J, Fernandes J N,Carrison D A, et al. Molecular phylogenetics and biogeography of Pollicipes(Crustacea:Cirripedia), a Tethyan relict[J]. Elsevier,2010, 392:193-199.
[4]Crandall K A, Fitzpatrick J J R. Crayfish molecular systematics:inferences using a combination of procedures to estimate phylogeny[J]. Syst Biol, 1996, 45 (1):1-26.
[5]Mokady O Y, Loya Y, Achituv E,et al. Speciation versus phenotipic plasticity in coral inhabiting barnacles:Darwin’s observation in a phylogenetic context[J]. Mol Evol, 1999, 49:367-375.
[6]Tamura K, Dudley J, Nei M, et al. MEGA4:Molecular Evolutionary Genetics Analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24:1596-1599.
[7]Posada D, Crandall K A. Modeltest:testing the model of DNA substitution[J]. Bioinformatics, 1998, 14:817-818.
[8]Ronquist F, Huelsenbeck J P. MrBAYES 3:Bayesian phylogenetic inference under mixed models[J]. Bioinformatics, 2003, 19:1572-1574.
[9]Hebert P D N, Ratnasingham S, DeWaard J R. Barcoding animal life:Cytochrome c oxidase subunit 1 divergences among closely related species[J]. Proc R Soc Lond B Biol Sci, 2003(b), 270:596-599.
[10]Hebert P D N, Cywinska A, Ball S L ,et al. Biological identification through DNA barcodes[J]. Proc R Soc Lond B Biol Sci, 2003(a), 270:313-321.
[11]Hebert P D N, Ratnasingham S, de Waard J R. Barcoding animal Life:cytochrome c oxidase subunit 1 divergences among closely related species[J]. Proc. R. Soc.Lond. B(Suppl 1), 2003, 270:96-99.
[12]Bucklin A, Frost B W, Allen L D, et al. Molecular systematic and phylogenetic assessment of 34 calanoid copepod species of the Calanidae and Clausocalanidae[J]. Mar Biol, 2003, 142:333-343.
[13]Costa F O, deWaard J R, Boutillier J, et al. Biological identifications through DNA barcodes:the case of the Crustacea[J]. Fisheries and Aquatic Sciences, 2007, 64:272-295.
[14]Bucklin A, Wiebe P H, Smolenack S B, et al. DNA barcodes for species identification of euphausiids(Euphausiacea, Crustacea)[J]. Plankton Research, 2007,29:483-493.
[15]Elias-Gutierrez M, Jeronimo F M, Ivanova N V, et al.DNA barcodes for Cladocera and Copepoda from Mexico and Guatemala, highlights and new discoveries[J]. Zootaxa, 2008, 1839:1-42.
[16]Pitombo F B. Phylogenetic analysis of the Balanidae(Cirripedia, Balanomorpha)[J]. Zoologica Scripta, 2004,33:261-276.
[17]Zullo V A. New genera and species of balanoid barnacles from the Oligocene and Miocene of North Carolina[J]. Palaeontology, 1984, 58 (5):1312-1338.
[18]Newman W A , Ross A. Revision of the Balanomorph barnacles including a catalogue of the species[J]. San Diego Society of Natural History Memoirs, 1976,9:1-108.
DNA taxonomy of Balanidae
YUAN Shuai1,2, AN Jian-mei1, SHA Zhong-li2
(1. Shanxi Normal University, Linfen 041004, China; 2. Institute of Oceanology, Chinese Academy of Sciences,Qingdao 266071, China )
Feb., 15, 2012
Balanidae; Barcoding; DNA; Subfamily; Phylogenetic
The Balanidae (Cirripedia Thoracica) taxonomy had two subfamilies systems(Chthamalinae, Balaninae)and three subfamilies systems (Balaninae, Megabalaninae, Concavinae). The current system is the four subfamilies system. Molecular systematic research between them have never been reported. Many species of barnacles had convergent evolution so that the traditional morphological classification was not well identified. Our research determined three mitochondrial gene fragments and compared different gene fragments’ (COI, 16S, 12S, 28Sand18S) feasibility and effectiveness as barcoding to identify Barnacle species based on the12S, 16Sgene sequence.The results showed that theCOIdistance between groups and distance within groups had obvious interval.Minimum distance between species was 0.122, being much larger than the maximum distance within species (0.023).The distance between groups and distance within groups of16Shad coincidence; minimum distance between species was 0.018, less than the maximum distance within species 0.023. Therefore, the mitochondrialCOIgene could more accurately identify barnacle between species and within species, and intraspecific difference was less than 0.023, difference between species was bigger than 0.1. The analysis of ML and BI was consistent, which supported the classification of four subfamily system. Megabalaninae formed a monophyletic with a higher rate of support,which proved that transverse tubes was plesiomorphy. Amphibalanus and Fistulobalanus form a single clade. The result supported Newman & Ross’s (1976) hypothesis that the two should be merged.
Q959 文献标识码:A 文章编号:1000-3096(2012)09-0082-07
2012-02-15;
2012-06-11
国家科学技术基础性工作专项(2011FY120200)
原帅(1985-), 女, 山西大同人, 硕士, 研究方向:甲壳动物 DNA 分类, E-mail:yundanfengqingde@126.com; 沙忠利, 通信作者, 副研究员, 研究方向:甲壳动物分类及分子系统学, E-mail:shazl@qdio.ac.cn
致谢:感谢中国科学院海洋研究所刘瑞玉院士和任先秋研究员在实验设计和形态学鉴定方面给予了帮助和指导。
梁德海)
