RP-HPLC法分离和定量测定未变性的乳清蛋白成分
2012-01-08朱鑫鑫刘晓辉赵征于景华
朱鑫鑫,刘晓辉,赵征,于景华
(天津科技大学食品工程与生物技术学院,天津 300457)
RP-HPLC法分离和定量测定未变性的乳清蛋白成分
朱鑫鑫,刘晓辉,赵征,于景华
(天津科技大学食品工程与生物技术学院,天津 300457)
建立了一种基于反相高效液相色谱(RP-HPLC)来分离并定量测定脱脂乳、加热脱脂乳及脱脂乳粉中未变性的乳清蛋白的分析方法。采用Venusil ASB-C8色谱柱;流速0.8 mL/min;检测波长215 nm;柱温30℃;流动相A为体积分数0.1%的三氟乙酸水溶液;流动相B为体积分数0.1%的三氟乙酸乙腈溶液;洗脱方式:流动相B开始在38%下等度洗脱2 min,然后在5 min内上升到43%,最后在43%下等度洗脱13 min。此方法在20 min内将4种乳清蛋白组分分离且各蛋白线性关系良好,适合定性和定量检测未变性的乳清蛋白组分。
反相高效液相色谱(RP-HPLC);乳清蛋白;定量分析
0 引言
乳清蛋白的成分主要有α-乳白蛋白(α-La)、牛血清白蛋白(BSA)和β-乳球蛋白(β-Lg),其变性程度是衡量脱脂乳粉品质好坏的一个重要指标,一般采用乳清蛋白氮指数(WPNI)法来评价,随着研究的深入此方法已不严谨[1],需要更精确的方法来测定其变性程度。国外学者采用色谱法,有的只分离出了α-La和β-Lg[2-3],有的分离时间长且没有研究β-Lg的两种遗传变异体[4-5];国内赵海霞等[6]采用RP-HPLC法仅对乳清蛋白中的α-La和β-Lg进行分离,王浩等[7]用RPHPLC法分离出乳制品中的7中蛋白质,但是样品中没有除去变性的乳清蛋白和酪蛋白,对乳清蛋白变性程度的测量造成困难。本研究为测定脱脂乳及脱脂乳粉中乳清蛋白的变性程度提供了一种有效的方法。
1 实验
1.1 材料与试剂
液态鲜牛奶;奶粉(包括国产脱脂奶粉和进口脱脂奶粉);标准品主要有α-La(纯度≥85%)、β-Lg(纯度≥90%)、β-LgA(纯度≥90%)、β-LgB(纯度≥90%)、BSA(纯度≥90%);乙腈(色谱级,纯度≥99.9%);三氟乙酸(TFA)、盐酸等试剂均为国产分析纯;液相所用到的水均为三蒸水。
1.2 仪器与设备
pH计;9N-100牛奶分离机;K9840凯氏定氮仪;L2000高效液相色谱仪及数据处理平台;色谱柱Venusil ASB-C8(250 mm×4.6 mm,5 μm,300);0.45 μm的尼龙膜。
1.3 方法
1.3.1 样品前处理
鲜牛奶除去脂肪后取100 mL,在水浴中75℃下加热10 min,然后在冰水浴中迅速冷却;另取100 mL脱脂乳,用于测定;奶粉样品,精确称取5.0 g复原于50 mL的去离子水中,25℃下搅拌2 h;用HCl调节乳及复原乳pH值至4.6,然后在4℃下6 500 g离心30 min,取上清液进行测定。上样前用0.45 μm的尼龙膜过滤。
1.3.2 高效液相色谱条件
色谱柱为Venusil ASB-C8(250 mm×4.6 mm,5 μm,300);流速为0.8 mL/min;进样量为10 μL;检测波长为215 nm;柱温30℃;洗脱时间20 min;流动相A为体积分数0.1%的三氟乙酸水溶液;流动相B为体积分数0.1%的三氟乙酸乙腈溶液;采用梯度洗脱方式。
梯度洗脱:流动相B在初始比例38%(流动相A为62%)下等度洗脱2 min,然后在5 min内上升到43%(变化率为1%),最后在43%下等度洗脱13 min。
1.3.3 标准曲线的绘制及其检测限的测定
配制一定浓度的混标:α-La(质量浓度2 g/L);β-LgA(质量浓度1.8 g/L);β-LgB(质量浓度1.4 g/L);BSA(质量浓度0.4 g/L)。然后每次稀释2倍,稀释9次,得到10组混合标准品的浓度梯度。用RP-HPLC检测混标中4种蛋白的质量浓度,以蛋白质标准品浓度为纵坐标,峰面积为横坐标绘制标准曲线,并计算最小检出限。
1.3.4 稳定性、重现性实验
分别取处理好的原脱脂乳和进口脱脂乳粉复原乳的上清液两份,一份即时检测,另一份室温放置24 h后检测;按照本研究方法进行乳清蛋白成分测定,每个样品做3次平行,分别计算4种蛋白的保留时间、峰面积和含量的标准偏差(RSD值)。
1.3.5 回收率的测定
取处理好的原脱脂乳和进口脱脂乳粉复原乳的上清液各3份,加入特定质量浓度的混标,通过0.45 μm的尼龙膜过滤后测定其中的蛋白质质量浓度,根据数据分析得出回收率。
1.3.6 样品中未变性乳清蛋白成分的测定
根据标准曲线测定4种样品中未变性的BSA,α-La,β-LgB和β-LgA的质量浓度;用凯氏定氮法测定未变性的总乳清蛋白质量浓度并计算加热脱脂乳粉中各乳清蛋白的变性程度。

式中:M1为原脱脂乳中未变性的乳清蛋白的质量浓度;M2为加热脱脂乳中未变性的乳清蛋白的质量浓度。
2 结果与讨论
2.1 未变性乳清蛋白样品的获得
RP-HPLC法测定乳中未变性乳清蛋白成分的前提是将变性的乳清蛋白和酪蛋白除去。除去变性的乳清蛋白和酪蛋白的方法有饱和NaCl盐析法和等电点沉淀法。饱和NaCl处理完样品后,由于溶液仍为饱和NaCl溶液,会堵塞色谱柱,一般不用于色谱分析中;另外饱和NaCl盐析法主要用于测定脱脂乳粉的乳清蛋白氮氮指数(WPNI的测量)[8],是测定总的乳清蛋白变性的方法而测量乳清蛋白的成分时一般用等电点沉淀法。变性的乳清蛋白和酪蛋白结合,在pH值为4.6时(酪蛋白的等电点)会发生凝集作用,离心或者过滤后可以除去[9]。目前国内外研究中用于沉淀酪蛋白的试剂主要有乳酸和盐酸两种,其中乳酸多用于电泳实验[10],盐酸则多用于液相实验[9]。因此本研究用盐酸作为pH调节剂,采用等电点沉淀法除去变性的乳清蛋白和酪蛋白,然后6 500 g离心30 min,取上清液进行测定。
2.2 RP-HPLC条件的优化
2.2.1 色谱柱的选择
根据α-La,β-Lg,BSA3种蛋白的空间结构和性质,孔径为300的C8色谱柱和C18色谱柱都可以用。对两种色谱柱分离的比较发现,C18色谱柱对于β-LgA与β-LgB的分离较延后并且β-LgB与β-LgA的分离度不如C8色谱柱(1.9以上),本实验选用Venusil ASB-C8(250 mm×4.6 mm,5 μm,300)色谱柱。
2.2.2 检测波长的选择
由于蛋白质中含有酪氨酸、苯丙氨酸和色氨酸,在280 nm处有紫外吸收。而肽键在200~220 nm处有紫外吸收并比280 nm处的吸收强几十倍[10]。本研究在280,215和220 nm下做对比实验发现:280 nm处4种蛋白峰面积明显减小,而220 nm的检测灵敏度也低于215 nm,因此本实验选用215 nm作为检测波长。
2.2.3 流速的选择
流速对蛋白质的出峰时间影响极大,本实验用1,0.8和0.5 mL/min进行对比试验。结果表明,流速为0.8 mL/min时出峰时间和各蛋白分离效果都是最佳。
2.2.4 洗脱条件优化
RP-HPLC法分离蛋白常用三氟乙酸水溶液和三氟乙酸乙腈溶液进行梯度洗脱。本研究用流动相A体积分数为0.1%的三氟乙酸水溶液(0.1%TFA+99.9% H2O),流动相B体积分数为0.1%的三氟乙酸乙腈溶液(0.1%TFA+99.9%乙腈)。当流动相B的初始比例低于38%(流动相A大于62%)时,样品中的杂质与BSA出峰重叠从而影响BSA分离,并且α-La的峰与它前边两个小峰的分离效果不好;当初始比例大于38%时,BSA与杂质一起洗脱而检测不到,并且β-LgA与β-LgB的峰型不好,因此本实验确定初始比例为38%。在兼顾出峰时间和分离度的前提下,本研究最终选取以下洗脱方式:流动相B在初始比例38%下(流动相A为62%)等度洗脱2 min,然后在5 min内上升到43%(变化率为1%),最后在43%(流动相A为57%)处等度洗脱13 min,此时4种蛋白质按时间顺序BSA、α-La、β-LgB与β-LgA都洗脱出来并且离效果最好。图1为4种乳清蛋白混标分离结果,其中β-LgA与β-LgB在标准品中的分离度为1.84。

2.3 样品中4种乳清蛋白成分的分离
在上述洗脱条件下对原脱脂乳、加热脱脂乳、国产脱脂乳粉和进口脱脂乳粉4种样品进行检测,结果如图2所示。由图2可以看出,由于样品中BSA的含量少(约占总乳清蛋白的5%),峰型较小,与α-La峰前边两个小杂峰(实验发现在样品和标准品中α-La峰前都会有两个小杂峰)的分离比较困难,通过调整流动相B的初始比例和等度洗脱时间发现当初始比例为38%并且保持洗脱2 min时,BSA的分离效果最好,并且α-La与其前边的两个杂质达到基线分离。
由图2可以看出,4种样品中BSA、α-La、β-LgB和β-LgA 4种乳清蛋白成分都达到基线分离,其中β-LgB与β-LgA在原脱脂乳中的分离度达到1.96。由图c与d可以看出,本实验所用国产脱脂乳粉中β-LgB和β-LgA的含量明显低于进口脱脂乳粉,这反映了目前我国脱脂乳粉的生产现状:国内乳粉的加工至今仍采用延续多年的加工工艺,生产的脱脂乳粉几乎全部是高温加热脱脂乳粉乳[1];此外,从分离结果看出,在脱脂乳粉生产期间,经过预热、杀菌、浓缩和喷雾干燥时β-Lg产生了新的变异体,对奶粉中β-LgB和β-LgA的色谱分离有一定影响。本方法用于测定脱脂乳及脱脂乳粉中天然存在的β-LgB和β-LgA,而对于加工过程中出现的新的变异体的测定需要进一步研究。
2.4 标准曲线绘制及检测限分析
按照上述最优条件以标准品浓度为纵坐标,色谱峰峰面积为横坐标分别制作4种乳清蛋白的标准曲线。对样品进行3次测定,计算3次标准偏差并求出最小检测限。具体数据如表1所示。
由表1可以看出,4种蛋白在设定的浓度范围内线性关系良好。可以用此标准曲线定量测定脱脂乳、加热乳及脱脂乳粉中未变性的乳清蛋白成分的质量分数。
2.5 方法的稳定性、重现性分析
表2为方法的重现性和稳定性。由表2可以看出,保留时间、峰面积和乳清蛋白成分质量分数的标准偏差(RSD)值均小于5%,说明本方法符合定量测定4种蛋白质的要求,而且重现性和稳定性良好。
2.6 回收率实验
表3为原脱脂乳和进口脱脂乳粉中4种乳清蛋白成分的回收率。表3可以看出,此方法4种乳清蛋白成分的回收率平均在93.0%~97.0%之间,RSD在0.3%~4.1%之间,显示出本方法有较高的回收率。


表1 4种蛋白标准品的线性方程、相关系数和检测限
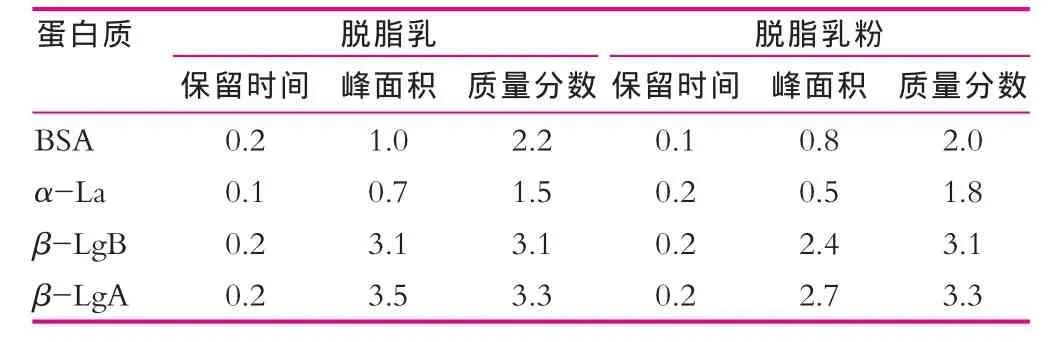
表2 方法的重现性和稳定性(标准偏差(RSD)值)%
2.7 样品中未变性的乳清蛋白成分的测定
表4为4种样品中未变性乳清蛋白成分的质量浓度、总未变性乳清蛋白的质量浓度和加热脱脂乳中乳清蛋白的变性程度。由表4可以看出,热处理会造成乳清蛋白成分的变性,不同成分变性程度不同,其中BSA变性程度最大;不同的乳粉产品其乳清蛋白的变性程度不同,说明不同的加工工艺(预热、杀菌、浓缩和喷雾干燥)对乳清蛋白的影响不同。本方法可检测出不同产品之间乳清蛋白质量浓度的差异和不同乳清蛋白组分间变性程度的差异,为定性和定量研究脱脂乳及脱脂乳粉中乳清蛋白成分提供可靠的测量方法。

表3 4种乳清蛋白成分的回收率

表4 样品中4种乳清蛋白成分的质量浓度分析结果(n=3)
3 结论
本研究建立了一种分离并定量测定未变性的乳清蛋白的RP-HPLC法,此方法使用C8色谱柱采用梯度洗脱的方式分离出BSA,α-La,β-LgB和β-LgA 4种乳清蛋白成分,并大大缩短了洗脱时间(20 min),稳定性和重复性优越,回收率在93%~97%,RSD都小于5%,并且各蛋白线性关系良好可以进行定量测定。不同的温度、pH值、离子环境和压强都会造成乳清蛋白的变性[11],许多学者用SDS-PAGE[12]或者Native-PAGE[13]法测定乳清蛋白的变性,其时间长,数据处理麻烦,重复性差,而本研究克服了这些缺点,提供了一种快速、准确地定性和定量分析乳清蛋白成分变性的方法;另外乳粉加工过程中预热、杀菌、浓缩以及喷雾干燥等工艺以及同一工艺不同的加工条件都会造成乳清蛋白的变性,本研究也可以为乳粉以及低热脱脂乳粉的生产过程中对乳清蛋白变性程度的检测提供方法参考。
[1]于景华,刘晓辉,张列兵,等.低热脱脂奶粉的生产现状[J].中国乳品工业,2010,Vol.38,No.3:45-61
[2]EI-ZAHAR K,SITOHY M,DALGALARRONDO M,et al.Purification and Physicochemical Characterization of Ovine β-lactoglobulin and α-lactalbumin[J].Natung,2004,48(3):177-183.
[3]FERREIRA I M P L V O,OLIVERA M B P P.Determination of Caseinomacropeptide by an RP-HPLC Method and Monitoring of the Addition of Rennet Whey to Powdered Milk[J].Journal of Liquid Chromatography and Related Technologies,2003,26(1):99-107.
[4]ELGAR D F,NORRIS C S,AYERS J S,et al.Simultaneous Separation and Quantitation of the Major Bovine Whey Proteins Including Proteose Peptone and Caseinomcropeptide by Reversed-Phase High-Performance Liquid Chromatography on Polystyrene-Divinybenzene [J].Journal of Chromatography A,2000,878:183-196.
[5]TORRE M,COHEN M E,CORZO N,et al.Perfusion Liquid Chromatography of Whey Proteins[J].Journal of Chromatography A,1996,729:99-111.
[6]赵海霞,李慧.高效液相色谱法测定乳清蛋白主要成分的研究[J].食品科技,2007(9):203-206.
[7]王浩,张志国,常彦忠,等.RP-HPLC法对乳制品中主要牛奶蛋白的分离及定量测定[J].食品科学,2009,30(24):376-380.
[8]R.MAHMOUD,R.J.BROWN,et al. Factors affecting measurement of Undenatured Whey Protein Nitrogen in Dried Whey by a Modified Harland-Ashworth Test[J].Dairy Sci,1990,73:1694-1699
[9]PARRIS N,BAGINSKI M A.A Rapid Method for the Determination of Whey ProteinDenaturation[J].DairySci., 1991,74:58-64.
[10]LIN S J,SUN J,CAO D D.Distinction of Different Heat-Treated Bovine Milk by Native-PAGE Fingerprinting of Their Whey Proteins[J].Food Chemistry,2010,121(3):803-808.
[11]张和平。乳清蛋白的热稳定性及其影响因素[J]。国外畜牧学-草食家畜,1991(2):58-71.
[12]OLDFIELD D J,TAYLOR M W,SINGH H.Effect of Preheating and Other Process Parameters on Whey Protein Reactions during Skim Milk Powder Manufacture[J].International Dairy Journal,2005, 15(5):501-511.
[13]MIRJANA PESIC,MIROLJUB BARAC,et al.Qualitative and Quantitative Analysis of Bovine Milk Adulteration in Caprine and Ovine Milks Using Native-PAGE[J].Food Chemistry,2011,125: 1443-1449.
Isolation and quantification of main composition with undenatured whey protein with reverse-phase HPLC
ZHU Xin-xin,LIU Xiao-hui,ZHAO Zheng,YU Jing-hua
(Department of Food Engineering and Biotechnology,Tianjin University of Science and Technology,Tianjin 300475, China)
Four main proteins(α-La,β-LgA,β-LgB,BSA)with the undenatured whey protein in skim milk,heat treatment skim milk and skim milk powder were isolated and determined by RP-HPLC.It was achieved by using a Venusil ASB-C8column(250 mm×4.6 mm,5 μm,300˙)at a flow-rate of 0.8 mL/min,column temperature 30℃and monitored with 215 nm.A gradient of solvent A 0.1%(v/v)TFA dissolved in water and B consisting of 0.1%(v/v)TFA in acetonitrile was applied.The gradient started with 37%of solvent B keeping for 2min and was increased to 43%within 5min and then kept at 43%for 13 min.This method successfully separated these four proteins within twenty minutes.With good linear correlations about the four proteins,it was used to qualitative and quantitative analysis the composition of the undenatured whey proteins.
RP-HPLC;whey protein;quantitative analysis
TS252.7
A
1001-2230(2012)05-0051-04
2011-11-08
“十一五”国家科技支撑计划资助项目(2009BADC1B02);天津科技大学引进人才科研启动基金。
朱鑫鑫(1985-),男,硕士研究生,研究方向为食品加工技术。
于景华
