不同脱乙酰度蚕蛹壳聚糖结构分析及其清除自由基能力的比较研究
2011-10-24李建科
赵 维,李建科
(陕西师范大学食品工程与营养科学学院,陕西西安 710062)
不同脱乙酰度蚕蛹壳聚糖结构分析及其清除自由基能力的比较研究
赵 维,李建科*
(陕西师范大学食品工程与营养科学学院,陕西西安 710062)
首次采用无水乙醇浸泡辅助脱乙酰基与间歇式碱处理相结合的方法,通过控制反应时间制备不同脱乙酰度的蚕蛹壳聚糖。同时对其脱乙酰度、表观黏度和分子量等理化指标进行测定,用红外光谱对其基本结构进行表征,并分别采用邻二氮菲-Fe2+氧化法、核黄素-光-氮蓝四唑法和DPPH法对其清除羟自由基(·OH)、超氧阴离子自由基(·)和DPPH自由基能力进行了测定。结果表明:当反应时间为5、7、9h时,蚕蛹壳聚糖的脱乙酰度分别为:78.12%、86.45%、95.96%;蚕蛹甲壳素和不同脱乙酰度壳聚糖的红外光谱图的不同说明其结构上的差异,可为进一步研究其性质提供理论参考;蚕蛹壳聚糖对羟自由基和超氧阴离子自由基的清除率均较低,但均高于虾蟹壳来源的壳聚糖;对DPPH·的清除率较高。三种壳聚糖对三种自由基清除率的大小顺序均为:脱乙酰度为95.96%的壳聚糖>脱乙酰度为86.45%的壳聚糖>脱乙酰度为78.12%的壳聚糖。
蚕蛹壳聚糖,不同脱乙酰度,结构分析,清除自由基能力
壳聚糖是天然存在的唯一碱性多糖甲壳素的脱乙酰产物。壳聚糖由于存在游离氨基,因而具有许多纤维素没有的独特性质,使得其在食品、医药、化工、环境等行业有着广泛的应用[1]。蚕蛹富含油和蛋白质,蛹渣是蚕蛹提取油和蛋白质后的废弃物,其中含有未被利用的甲壳素。由于蚕蛹中的灰分含量较少[2],所以是提取甲壳素,进而制备壳聚糖的良好原料。目前,国内有关蚕蛹甲壳素及壳聚糖的研究多集中在制备工艺方面[3-5],对其结构和性质的研究还不够深入,虽然已有研究证明壳聚糖及其衍生物在细胞水平和动物整体水平上有一定的抗氧化作用[6],但不同脱乙酰度蚕蛹壳聚糖的结构分析及其清除自由基能力的研究报告尚未见到,因此,很有必要对不同脱乙酰度蚕蛹壳聚糖的基本结构及其清除自由基的能力进行深入的研究探讨,以期为蛹渣的利用开辟新途径。本文首次采用无水乙醇浸泡辅助脱乙酰基与间歇式碱处理相结合的方法,通过控制反应时间制备不同脱乙酰度的蚕蛹壳聚糖,同时测试其脱乙酰度、表观黏度和分子量等理化指标,用红外光谱对其基本结构进行了表征,并对其清除羟自由基(·OH)、超氧阴离子自由基(O-2·)和DPPH·的能力进行了比较研究。
1 材料与方法
1.1 材料与仪器
蚕蛹甲壳素 从提取油和蛋白的蛹渣中自制而得;NBT(氮蓝四唑)、L-甲硫氨酸 上海沃尔森公司;DPPH(1,1-二苯基-2-苦基肼自由基) Sigma公司;核黄素 北京奥博星生物技术责任有限公司;无水乙醇、氢氧化钠、冰乙酸、无水碳酸钠、邻苯二甲酸氢钾、甲基橙、邻二氮菲、过氧化氢、硫酸亚铁、磷酸氢二钠、磷酸二氢钠 均为国产分析纯。
恒温水浴锅、电热恒温鼓风干燥箱 北京科伟永兴仪器有限公司;SC69-02C水分快速测定仪 上海第二天平仪器厂;SPJX-4-13箱式电阻炉 天津市中环实验电炉有限公司;乌氏粘度计 上海申谊玻璃制品有限公司;RVDV-II+Pro粘度计 美国博利飞公司;2000型紫外可见分光光度计 尤尼柯上海仪器公司;Avatar360E.S.P.FTIR傅立叶变换红外光谱仪 尼高力仪器公司。
1.2 实验方法
1.2.1 蚕蛹甲壳素的预处理 在反应前,采用蒸馏水浸泡30m in,避免产品颜色太深。
1.2.2 不同脱乙酰度蚕蛹壳聚糖的制备 称取1.00g蚕蛹甲壳素粉末原料于150m L锥形瓶中,加入15m L无水乙醇浸泡1.7h,然后再按1∶28(g/m L)的料液比加入质量分数为44%的NaOH溶液,搅拌均匀后,浸泡10m in,再放入94℃的水浴锅中分别反应5、7、9h,期间每隔2h取出过滤,水洗至中性,换碱1次,反应完毕后取滤渣在60℃下干燥至恒重。
1.2.3 不同脱乙酰度蚕蛹壳聚糖理化指标的测定
1.2.3.1 水分含量的测定 用水分快速测定仪进行测定。
1.2.3.2 灰分含量 采用干法灰化法,具体方法参考文献[7]。
1.2.3.3 脱乙酰度的测定 采用酸碱滴定法,具体方法参考文献[5]。
1.2.3.4 表观黏度的测定 将0.4g壳聚糖样品溶于40m L 1%乙酸溶液中,在25℃条件下进行测定,具体方法参考文献[8]。
1.2.3.5 分子量的测定 测定壳聚糖特性黏度,根据Mark-houwink方程[η]=KMα计算分子量,其中:K=1.64×10-30×(D.D.×100)14,α =-1.02 ×10-2×(D.D.×100)+1.82,[η]为特性黏度,M 为分子量,具体方法参考文献[8]。

1.2.3.6 壳聚糖产率的计算1.2.4不同脱乙酰度蚕蛹壳聚糖的红外光谱分析 采用溴化钾压片法将样品置于傅立叶变换红外光谱仪下测其IR谱图,测定波数范围为500~4000cm-1,具体方法参考文献[9]。
1.2.5 不同脱乙酰度蚕蛹壳聚糖清除自由基能力的检测 将不同脱乙酰度的壳聚糖样品分别配制成不同质量分数的壳聚糖样品溶液,采用以下方法检测其清除自由基的能力。
1.2.5.1 清除羟自由基(·OH)能力的测定 采用邻二氮菲-Fe2+氧化法[11],并对其进行改进。取2.0m L pH7.0的磷酸钠缓冲液,加入1.5m L 5mmol/L邻二氮菲应用液,充分混匀。再加入1.0m L 7.5mmol/L FeSO4溶液,立即混匀。加入1.0m L样品溶液,立即混匀。加入3.5m L双蒸水,以补充体积。最后加入1.0m L 0.1%H2O2溶液,混匀。于37℃水浴中保温60m in,于536nm测定吸光值。羟自由基清除率d表示为:
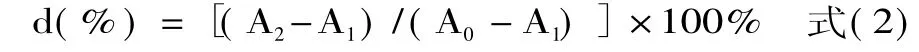
式中,A0:不加样品及H2O2时测得的吸光值;A1:加H2O2而不加样品时测得的吸光值;A2:加入样品及H2O2时测得的吸光值。
采用核黄素-光-氮蓝四唑体系测定[12],并对其进行改进。取1.0m L pH7.0磷酸钠缓冲液,加入0.5m L 3.3×10-5mol/L核黄素,0.5m L 3 ×10-3mol/L 甲硫氨酸,2.25×10-4mol/L NBT和1.0m L样品溶液。于光照箱上方安装两支30W日光灯,距密闭反应箱约20cm照射30m in后于560nm处测样品吸光值A。以溶剂代替样品溶液测得空白吸光值A0。超氧阴离子自由基(·)清除率d表示为:
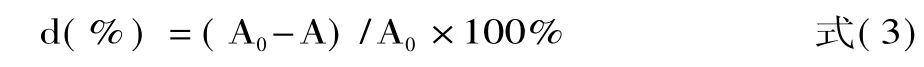
1.2.5.3 清除DPPH·活性的测定 采用DPPH法[13],并对其进行改进。在试管中加 2m L 5 ×10-5mol/L的DPPH无水乙醇溶液与2m L样品溶液,混匀,在室温下静置30min后,于517nm处测得吸光值AI,同时测定2m L 5×10-5mol/L的 DPPH 无水乙醇溶液与2m L溶剂的吸光值A0,以及2m L样品溶液与2m L溶剂的吸光值AJ。DPPH·的清除率d表示为:
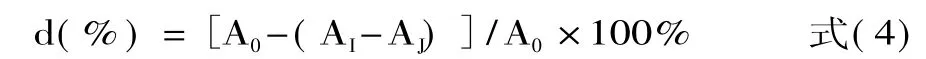
2 结果与分析
2.1 不同脱乙酰度蚕蛹壳聚糖指标成分的测定
选用以下制备工艺条件,即无水乙醇浸泡时间1.7h,NaOH溶液质量分数44%,处理温度94℃,料液比 1∶28(g/m L),分别反应 5、7、9h,所得壳聚糖产品各项指标成分见表1。
由表1可知,随着处理时间的延长,壳聚糖产品的脱乙酰度升高,但表观黏度、特性黏度和分子量也随之下降,水分、灰分和产率的变化不大,样品颜色均为原白色。其中,脱乙酰度为86.45%和95.96%的壳聚糖产品各项指标均符合相关企业食品级壳聚糖的标准[7]。
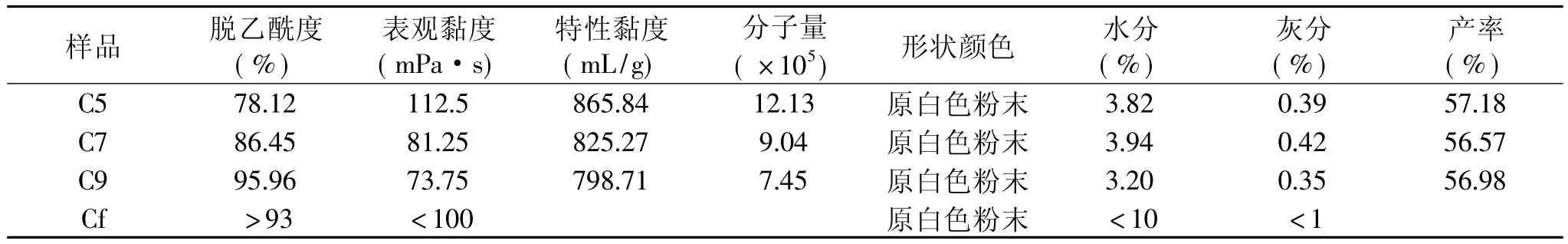
表1 不同脱乙酰度蚕蛹渣壳聚糖的指标成分
2.2 红外光谱表征样品化学结构
将蚕蛹甲壳素和不同脱乙酰度壳聚糖粉末作红外光谱分析,结果见图1。壳聚糖与甲壳素的红外光谱差异表现在酰胺谱带、氨基谱带和氢键等方面。
3400cm-1左右的宽峰是O-H和N-H的伸缩振动吸收峰互相重叠而成的多重吸收峰,即对照于残糖基上的 O-H 和 N-H[14],这个峰还说明 O-H 和N-H之间存在着强弱不同的分子内和分子间氢键,3264cm-1左右的峰是N-H的伸缩振动吸收峰。由图可知,蚕蛹壳聚糖样品在3400cm-1左右的吸收峰不及甲壳素样品的吸收峰型尖锐,而且甲壳素样品在3446cm-1和3278cm-1处都有显著的吸收峰,而壳聚糖样品仅在3437~3447cm-1左右有吸收峰,这表明壳聚糖样品分子内和分子间的氢键较未进行脱乙酰处理的甲壳素样品弱。
1652cm-1左右的吸收峰归属于酰胺Ⅰ谱带,反映的是乙酰氨基,1590cm-1左右的吸收峰属于酰胺Ⅱ谱带,是氨基的特征吸收峰,1590cm-1左右的吸收强度增强,表明氨基大量存在于壳聚糖样品中,说明了脱乙酰反应程度较高[15]。从图中可以观察到壳聚糖样品在1590cm-1左右出现了一个尖锐的吸收峰,而甲壳素样品在1590cm-1左右的吸收峰很小,这说明当甲壳素脱乙酰反应生成壳聚糖时,1655cm-1左右峰的吸收强度减弱,1590cm-1左右峰的吸收强度增强,可以证明氨基大量存在于壳聚糖样品中。壳聚糖在1590cm-1左右的吸收强度比1655cm-1处强,这说明该壳聚糖样品的脱乙酰度高,这与上面理化指标的测定结果一致。1652cm-1左右的峰位也可以证明蚕蛹甲壳素及壳聚糖均为α型[16]。
不同脱乙酰度的蚕蛹壳聚糖的红外光谱在整体上相似,仅在吸收峰的强度上表现出差异。由于壳聚糖分子中存在的分子内和分子间氢键的强弱和长短不等,因此,它们的伸缩峰出现在较宽的频率范围内。三种壳聚糖样品在3400cm-1左右的吸收峰位置分别为:b:3437cm-1,c:3439cm-1,d:3447cm-1,峰位d>c>b,峰位向高频区移动表明样品的结晶度随脱乙酰度的提高而增加[16]。三种壳聚糖样品在该处的峰型尖锐程度是:d>c>b,说明样品d含有的自由羟基多于c和b。
图中2922~2882cm-1左右的吸收峰是残糖基上的甲基或次甲基的C-H伸缩振动吸收峰。由图可知,在该峰位的吸收强度及峰的尖锐程度均为:d>c>b,说明随着壳聚糖脱乙酰度的增加,样品在该峰位的吸收度也随之增加。三种壳聚糖样品在2900~2800cm-1左右的吸收峰位置分别为:b:2917cm-1,c:2884cm-1,d:2881cm-1,即:b > c >d,说明随着样品脱乙酰度的增加,蚕蛹壳聚糖在该波段处的峰位偏向低频,一般认为壳聚糖结晶度增加会使 C-H伸缩峰向低频移动[16],所以可以证明蚕蛹壳聚糖的结晶度随着脱乙酰度的提高而增加。
1590cm-1左右的酰胺Ⅱ谱带吸收峰的强弱可以反映壳聚糖脱乙酰度的高低。三种壳聚糖样品在酰胺Ⅱ谱带的吸收峰强弱为:d>c>b,说明d样品的脱乙酰度最高。1425cm-1左右的吸收峰是蚕蛹壳聚糖的CH2弯曲变形的吸收峰,1381cm-1出现的吸收峰是CH振动和C-CH3变形峰。900~800cm-1出现的吸收峰是多糖的β构型糖苷键的特征峰,这证明蚕蛹壳聚糖的糖苷键是β构型。
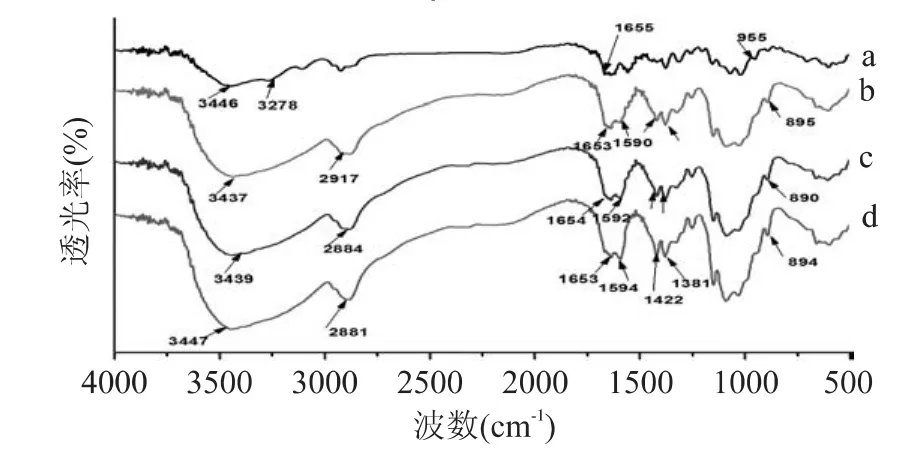
图1 蚕蛹甲壳素和不同脱乙酰度壳聚糖的红外光谱图
2.3 不同脱乙酰度蚕蛹壳聚糖清除自由基能力的检测
2.3.1 清除羟自由基(·OH)能力的测定 由图2可知,随着浓度的升高,所有样品清除羟自由基的能力逐渐增强。在相同浓度下,随着壳聚糖样品脱乙酰度的提高,其对羟自由基的清除能力也随之升高。这可能是由于高脱乙酰度的蚕蛹壳聚糖分子内自由羟基多于低脱乙酰度壳聚糖,而且其氨基含量也较多,羟基的氢原子与羟自由基作用而达到清除羟自由基的目的;氨基与羟自由基反应可以生成稳定的大分子自由基;氨基先与溶液中的氢作用形成氨正离子,再与羟自由基作用形成稳定物质[9]。这与其红外光谱所表征的不同脱乙酰度壳聚糖结构的差异是一致的。三种壳聚糖对羟自由基的清除率都随浓度的增大而增加,但清除率总体都不高。当脱乙酰度为95.96%的壳聚糖的浓度为8mg/m L时,其清除率为35.13%。但与以虾蟹壳为来源的壳聚糖[19]相比,其清除率还是要高许多。
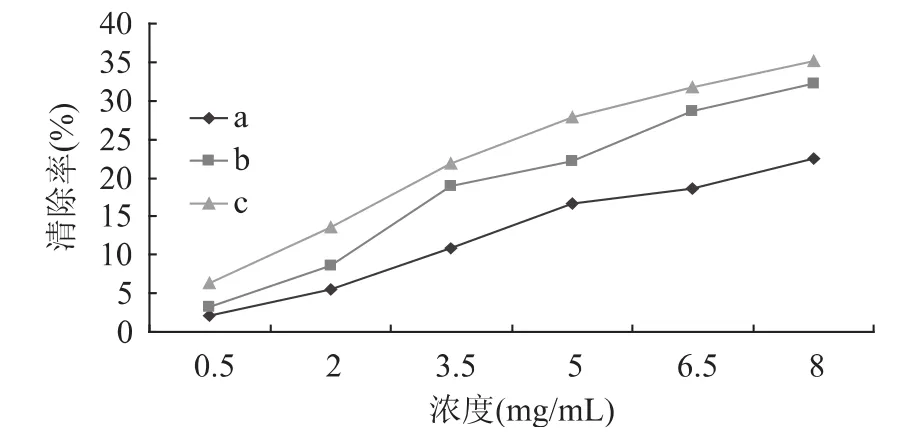
图2 不同脱乙酰度蚕蛹壳聚糖对羟自由基的清除能力
由图3可知,当壳聚糖溶液的浓度相同时,壳聚糖的脱乙酰度越高,其对超氧阴离子自由基的清除率也随之升高。这可能是因为较脱乙酰度低的壳聚糖而言,脱乙酰度高的壳聚糖其分子量相对较低,其分子链的缠绕程度相对较小,活性基团的暴露程度较高,与超氧阴离子作用的机会也随之增多,从而反应活性相对较高,但整体上较低,最高的清除率仅为29.87%,这可能是因为其分子量整体上仍较大,暴露的活性基团还不够多,若想进一步提高壳聚糖清除超氧阴离子自由基的能力,可对其进行降解,有待进一步研究。由图3还可以发现,在低浓度处,三种样品的清除率差别较小。当溶液浓度达到3.5mg/m L时,不同脱乙酰度壳聚糖对超氧阴离子自由基的清除率大小差异明显,当溶液浓度大于5mg/m L时,c号样品的清除率趋于平稳,a号和b号样品的清除率处于一直增大的趋势。尽管总体的清除率都不高,但与其它来源的壳聚糖9.32%的清除率[9]相比,还是要高很多。
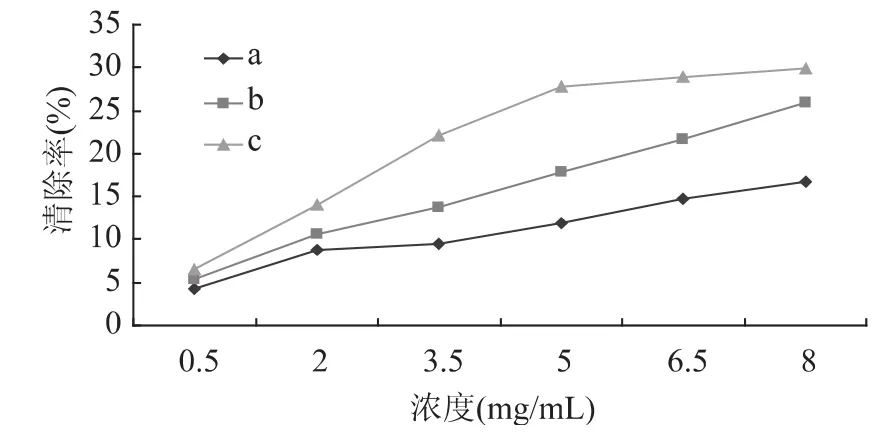
图3 不同脱乙酰度蚕蛹壳聚糖对超氧阴离子自由基的清除能力
2.3.3 清除DPPH·能力的测定 由图4可知,三种不同脱乙酰度壳聚糖对DPPH·的清除率均随着浓度的增加而增大。当溶液浓度为0.5mg/m L和2mg/m L时,不同脱乙酰度壳聚糖对超氧阴离子自由基的清除率大小差异不明显,当溶液浓度超过2mg/m L时,这种差异才显现出来。在相同浓度下,三种样品对DPPH·的清除率大小顺序为:c>b>a,说明壳聚糖对DPPH·的清除率随着脱乙酰度的增加而增大。这是因为DPPH·是一种稳定的自由基,它可以接受电子和氢形成稳定的分子。由红外图谱可以发现脱乙酰度高的壳聚糖溶液中含有更多的氨基和羟基,因此其可以提供更多的电子和氢与DPPH·结合从而达到清除的目的。
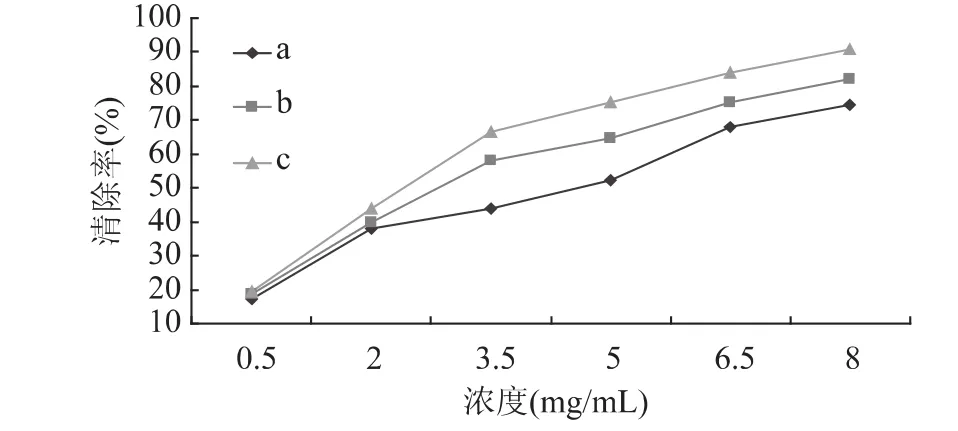
图4 不同脱乙酰度蚕蛹壳聚糖对DPPH自由基的清除能力
3 讨论
目前,国内有关蚕蛹甲壳素及壳聚糖的研究多集中于制备工艺方面,不同脱乙酰度蚕蛹壳聚糖的结构分析及其清除自由基能力的研究报告还尚未见到。通过研究蚕蛹甲壳素和不同脱乙酰度的壳聚糖的红外光谱图之间的差异,可为进一步研究其性质提供理论参考。
在三种壳聚糖清除自由基能力检测的研究中,发现无论哪种脱乙酰度的壳聚糖,在相同浓度时对羟自由基和超氧阴离子自由基的清除率均较低,而对DPPH自由基的清除率则相对较高。如在浓度为8mg/m L时,脱乙酰度为95.96%的壳聚糖对羟自由基、超氧阴离子自由基和DPPH自由基的清除率分别为:35.13%、29.87%和90.92%,差异较大,其中原因有待进一步探讨研究。
4 结论
4.1 以蚕蛹甲壳素为原料,选用以下制备工艺条件,即无水乙醇浸泡时间1.7h,NaOH溶液质量分数44%,处理温度94℃,料液比1∶28(g/m L),分别反应5、7、9h,可得脱乙酰度分别为 78.12%、86.45% 和95.96%的壳聚糖。
4.2 不同脱乙酰度蚕蛹壳聚糖红外光谱图的不同表明其结构上的差异,可为壳聚糖性质的研究提供参考。
4.3 在相同浓度下,三种脱乙酰度蚕蛹壳聚糖对羟自由基、超氧阴离子自由基和DPPH·的清除率的大小顺序为:脱乙酰度为95.96%的壳聚糖>脱乙酰度为86.45%的壳聚糖>脱乙酰度为78.12%的壳聚糖。三种不同脱乙酰度的壳聚糖在相同浓度时对羟自由基和超氧阴离子自由基的清除率均较低,但高于虾蟹壳来源的壳聚糖;对DPPH自由基的清除率则较高。
[1]Paulino A T,Simionato I J,Garcia JC,et al.Charaterization of Chitosan and Chitin Produced from Silkworm Crysalides[J].Carbohydrate Polymers,2006,64(1):98-103.
[2]倪红,陈云,梁艳,等.桑蚕蛹皮化学成分的分析及其显微结构的表征[J].湖北大学学报:自然科学版,1999,21(1):69-72.
[3]王济强.蚕蛹皮制备甲壳质和壳聚糖的研究[J].丝绸,2003(10):46-48.
[4]贾廷华,刘颖,张燕玲,等.柞蚕蛹皮壳聚糖的制备工艺研究[J].辽宁丝绸,2003(1):10-13.
[5]詹永乐,黄春芳,陈复生.家蚕蛹皮制取壳聚糖的最佳工艺条件[J].化学通报,2001(7):450-453.
[6]郝苗,金黎明,杨艳.壳寡糖对四氯化碳诱导的肝损伤的保护作用[J].食品与药品,2007,9(5A):14-16.
[7]蒋挺大 .甲壳素[M].北京:化学工业出版社,2006:87-111.
[8]朱洪红.蚕蛹甲壳素抗菌新材料的研究[D].重庆:西南大学,2008.
[9]陈冬梅.壳聚糖的降解及其抑菌性、抗氧化性研究[D].重庆:重庆工商大学,2009.
[10]李巧霞,宋宝珍,仰振球,等.微波间歇法快速制备高粘均分子量和高脱乙酰度的壳聚糖[J].过程工程学报,2006,6(5):789-793.
[11]柳红,张静.不同南瓜多糖体外清除羟基自由基作用的研究[J].武汉植物学研究,2007,25(4):356-359.
[12]赵艳红,李建科,赵维,等.常见药食植物提取物体外抗氧化活性的评价[J].食品科学,2009,30(3):104-108.
[13]陈晋明,王世平,马俪珍,等.虾青素抗氧化活性研究[J].营养学报,2007,29(2):163-169.
[14]赵国骏,姜涌明,孙龙生,等.不同来源壳聚糖的基本特性及红外光谱研究[J].功能高分子学报,1998,11(3):403-407.
[15]Zhang M,Haga A,Sekiguchi H,et al.Structure of insect chitin isolated from beetle Larva cuticle and silkworm(Bombyx mori)pupa exuvia[J].International Journal of Biological Macromolecules,2000,27:99-105.
[16]Harish Prashanth K V,Kittur F S,Tharanathan R N.Solid state structure of chitosan prepared under different N-deacetylating conditions[J].Carbohydrate Polymers,2002,50:27-33.
Structural characterization of different deacetylated degree chitosan from silkworm chrysalis residue and its scavenging free radical abilities
ZHAO Wei,LI Jian-ke*
(College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi’an 710062,China)
By controlling treatment time,different deacetylated degree chitosan was prepared from silkworm chrysalis chitin with a method combining absolute alcohol soaktime with intermittent type treatment to deacetylate for the first time.The deacetylated degree,apparent viscosity,molecular weight and some relevant typical properties of products were determined.Their basic constitution was charactered by FTIR.1,10-phenanthroline-Fe2+oxidative assay,riboflavin photodegradation--NBT reduction method and DPPH method were used to evaluate scavenging abilities of chitosan to free radical including hydroxyl radical,superoxide anion radical and DPPH radical.The results were as follows:when treatment time were 5,7,9h,deacetylated degree of chitosan were 78.12%,86.45%,95.96%,respectively.Infrared spectrogram of chitin and different deacetylated deg reechitosan had significant difference,which could provide some reference for properties and application research of produc ts.Scavenging rate of different deacetylated deg reechitosan from silkworm chrysalis to hydroxyl radical and superoxide anion radical were low,but were higher than that of chitosan from shrimps and crabs.Scavenging rate of different deacetylated degree chitosan to DPPH radical was high.The orders of scavenging rate of different deacetylated degree chitosan from silkworm chrysalis to three free radicals were chitosan whose deacetylated degree was 95.96%>chitosan whose deacetylated degree was 86.45%>chitosan whose deacetylated deg ree was 78.12%.
chitosan from silkworm chrysalis;different deacetylated degree;structural characterization;scavenging free radical abilities
TS201.2+3
A
1002-0306(2011)08-0090-05
2010-07-12 *通讯联系人
赵维(1985-),女,硕士研究生,研究方向:营养与食品卫生。
陕西省“13115”科技创新工程重大科技专项项目(2009ZDKG-05)。
