免疫反应及他汀类药物在大鼠心肌肥厚中的作用
2011-08-07王迪斌郭晓敏李秀珍
谭 晓,卫 慧,王迪斌,朱 嵘,郭晓敏,李秀珍,高 莹
(南京医科大学第二附属医院心内科,江苏南京,210011)
心肌肥厚是由于心肌细胞外信号刺激,引起一系列受体介导的细胞信号转导,以及核内某些基因活化而出现的,是心肌细胞肥大、心肌间质细胞增殖以及心肌细胞外基质改建等心肌重塑的结果,为心力衰竭、心律失常及猝死的重要原因之一。近年来相关研究表明,心肌肥厚可能与机械性因素、神经体液因素、细胞因子及遗传等相关。但是,心肌肥厚常伴随白介素-6(IL-6)、IL-1β、心肌肥厚因子-1(CT-1)、IL-18及 C反应蛋白等炎性因子的异常表达。临床治疗心肌肥厚常采用血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体阻断剂、钙离子拮抗剂、β受体阻滞剂、利尿剂、抗心律失常药等药物以及起搏器、手术和介入治疗等,但疗效有限,且手术及介入治疗风险高。而他汀类药物因其显著的降脂作用可防治心脑血管疾病,其他诸多非降脂效应,如抗炎、抗氧化、改善内皮细胞功能、抑制平滑肌细胞增殖等,可有效抑制心肌肥厚的发生[1-3]。本研究拟从免疫机制出发,旨在探讨其在心肌肥厚中的作用,以及他汀类药物对心肌肥厚的影响。
1 资料与方法
1.1 主要材料和试剂
阿托伐他汀(商品名:立普妥,美国辉瑞公司生产),一抗(CD4 antibody、CD8 antibody、TNF-α antibody)购自美国Abcam 公司,二抗(羊抗兔,货号:111-035-003;兔抗羊,货号:305-035-003)购自JACKSON公司,SP试剂盒购自福州迈新生物科技有限公司,苏木素染色液购自福州迈新公司,切片机购自美国Reichert Histostate公司。
1.2 方法
1.2.1 实验动物分组:SD大鼠共36只(南京医科大学实验动物中心提供),体质量220~300 g,雌雄不限,用标准颗粒性饲料喂养1周后(洗脱期)随机分成5组,包括:①正常对照组6只;②心肌肥厚组6只;③脾细胞输注组6只;④心肌肥厚+他汀组6只;⑤脾细胞输注+他汀组6只;另外6只为待取脾细胞的心肌肥厚大鼠。
1.2.2 心肌肥厚大鼠模型的制备[4]及给药方法:按上述分组,将心肌肥厚组和心肌肥厚+他汀组的大鼠制作心肌肥厚模型。将SD大鼠给予盐酸氯胺酮注射液(2 mL∶0.1 g)2 mL/kg麻醉后,仰卧固定于鼠台上,用3%碘酒和75%乙醇消毒后从腹部正中剑突下切开皮肤2 cm左右,打开腹腔,在肾动脉上方分离一小段腹主动脉,穿过一条丝线,将去尖的7号针头连同腹主动脉一并结扎,然后立即抽出针头,即造成腹主动脉的缩窄,再将内脏恢复原位,关闭腹腔,继续饲喂。予④、⑤2组阿托伐他汀按2 mg/(kg·d)剂量灌胃,持续8周。其余组用等剂量生理盐水灌胃。
1.2.3 脾细胞的分离和输注:取饲养4周的待取脾细胞的心肌肥厚大鼠6只,处死后取其脾脏,在2℃的生理盐水中浸泡10 min,经100目不锈钢丝网在2%BSA-HanKs液中研磨,制成匀浆,收集滤液后,经水平离心机2 000 r/min×15 min离心,弃上清;低渗法破除红细胞。10%BSAHanKs液洗涤脾细胞2次。RPMI 1 640悬浮细胞用2%台盼蓝染色,显微镜下观察细胞活力>95%。RPMI 1 640重悬细胞,调整浓度至100×106~150×109个/L。将脾细胞悬液1 mL经尾静脉输注予③、⑤组。
1.2.4 左室质量和体质量的测定:动物称质量后处死,取出心脏,分离左右心室,用电子天平称取左心室质量(LVM),计算左心室重量指数(LVI)=左心室质量与体质量比(LVM/BW)表示左心室肥厚的程度。
1.2.5 心脏超声检查:大鼠以7.5%水合氯醛(5 mL/kg)腹腔注射麻醉后备皮,应用超声心动图(VIVID7型号,美国GE公司)及7.5MHz高频线控探头(美国GE公司),进行超声检测,取胸胃旁左室长轴切面,M型超声心动图取样线取心底波群,测主动脉根部内径和左房的大小。高频线控探头置于心尖部,取心尖四腔图,取样容积置于二尖瓣瓣口,获得舒张期二尖瓣血流频谱,上述均按照美国超声医学标准进行。连续储存获得上述的超声图像,然后再用实时、慢速回放及冻结图像等技术对图像进行分析处理。各测量数据均取5个心动周期的均值。测量的指标:左室射血分数(EF)=(EDV-ESV)/EDV,左室短轴缩短率(FS)=(LVDd-LVDs)/LVDd,室间隔厚度(IVS),左室后壁厚度(LVPW),舒张末期左室内径(LVD)和收缩末期左室内径(LVS)。
1.2.6 心肌CD4、CD8、TNF-α蛋白的表达的测定:采用免疫组化方法。取各组大鼠左室游离壁及心尖部心肌,制成石腊切片,将切片放入60℃恒温箱中烘烤60 min,脱腊,再分别在无水乙醇中浸泡5 min,95%乙醇中浸泡5 min,85%乙醇中浸泡5 min,70%乙醇中浸泡5 min,用磷酸盐缓冲液(PBS)清洗3次,进行抗原修复,再次洗涤后,用3%H2O2灭活内源性过氧化物酶,PBS液洗涤5 min,共3次,加入一抗100 μ L,继续PBS洗涤5 min,共3次,加入增强剂,37℃孵育20 min,洗涤后,加酶标二抗,洗涤后 DAB显色,终止显色后复染,封片。以PBS代替一抗作阴性对照,应用 imagepro-plus软件系统对 CD4、CD8、TNF-α表达进行图像分析,每张切片放大400倍,随机选取3个视野,以心肌细胞间隙、血管周围和细胞表面呈棕褐色颗粒为阳性,以平均光密度作为图像的输出结果,测定各组心肌标本的CD4、CD8、TNF-α。

图1 心肌肥厚组与正常对照组心肌大体标本
2 结 果
2.1 模型制备
4周后取正常对照组与心肌肥厚组大体标本观察可见,肥厚组心肌较对照组心肌明显肥厚,见图1。
2.2 各组大鼠LVI
心肌肥厚组LVI(2.77±0.12)较正常对照组(2.11±0.14)升高31.2%(P<0.05);脾细胞输注组(2.58±0.16)较正常对照组升高22.3%(P<0.05);心肌肥厚+他汀组(2.33±0.14)较肥厚组下降15.7%(P<0.05);脾细胞输注+他汀组(2.25±0.10)较脾细胞输注组下降12.8%(P<0.05)。
2.3 各组大鼠的心脏超声结果
8周后,测定大鼠心脏超声结果。除肥厚+他汀组及脾细胞输注+他汀组中的LVD,脾细胞输+他汀组的 LVPW、LVS外,其他各组大鼠IVS、LVPW、LVD、LVS与正常对照组相比明显增大,而 EF、FS明显降低(P<0.05或P<0.01);心肌肥厚组大鼠的IVS、LVPW、LVS较脾细胞输注组显著增大,EF和FS显著降低(P<0.01);心肌肥厚组加上他汀药干预后,上述指标较心肌肥厚组有明显改善(P<0.01),脾细胞输注组加上他汀药干预后,LVPW、LVS、EF、FS较单纯脾细胞输注组明显改善(P<0.05或P<0.01)。见表 1。
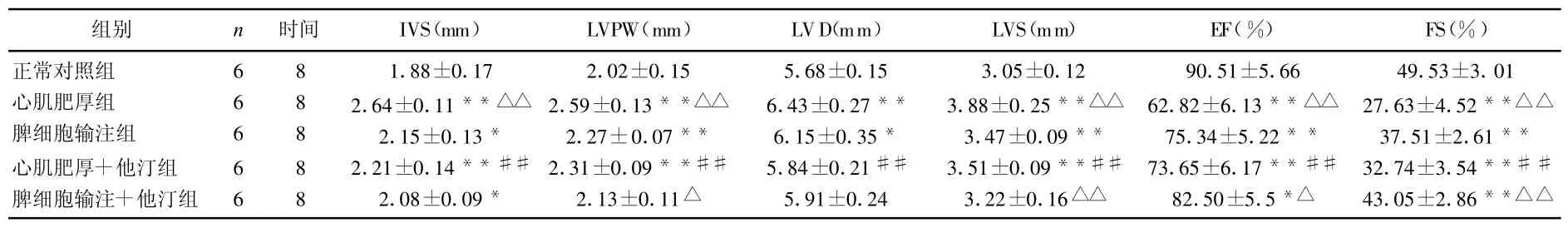
表1 5组超声心动图形态学及功能学指标的比较
2.4 心肌 CD4、CD8、TNF-α蛋白的表达
与正常对照组相比,其他各组大鼠CD4、TNF-α均明显升高(P<0.05),而CD8表达明显降低(P<0.05);心肌肥厚组CD4、TNF-α的表达较其他各组升高幅度最为明显,CD8降低幅度较其他各组也最为明显;心肌肥厚+他汀组CD4、TNF-α表达较肥厚组已有明显回落,但仍较脾细胞输注组为高,而CD8则有一定幅度上升,但仍低于脾细胞输注组;脾细胞输注+他汀组CD4、TNF-α表达较脾细胞输注组有降低,但仍高于正常对照组,CD8较脾细胞输注组升高,较正常对照组为低。CD4/CD8在肥厚组最大,其次是心肌肥厚+他汀组、脾细胞输注组、脾细胞输注+他汀组、正常对照组。见图2~5。

图2 CD4、CD8和TNF-左室心肌的表达
3 讨 论
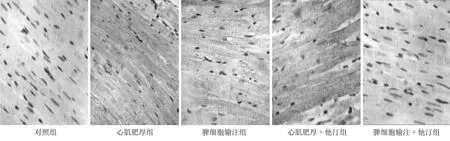
图3 免疫组化检测CD4在心肌中的表达 (DAB显色 400倍)

图4 免疫组化检测CD8在心肌中的表达 (DAB显色 400倍)

图5 免疫组化检测TNF-α在心肌中的表达 (DAB显色 400倍)
心肌肥厚是心肌细胞对多种病理刺激的一种适应性反应,目前认为心肌肥厚的形成与细胞外多种因素刺激细胞内的信号转导和核内的某些基因活化有关[5],常见的临床病因是心脏的压力负荷增高。压力超负荷一方面直接刺激细胞生长,另一方面可刺激心肌组织结构变异,使心肌组织产生自身抗原,诱发免疫反应及产生各种内分泌因子,如RAS、儿茶酚胺类、胰岛素样生长因子、IL-6等,进一步活化免疫细胞。活化的B和T细胞能识别细胞核内的自身抗原决定簇,通过信号转导,诱导产生CT-1、AT-II、醛固酮等[6],促进心肌重构。同时B、T细胞还能识别心肌肌球蛋白上多个抗原决定簇,刺激其发生增殖。自身免疫反应过去被认为是病毒性心肌炎和扩张性心肌病的主要机制[7],而其在心肌肥厚中的作用还知之甚少,值得进一步深入探究。CD4为辅助性T细胞标志,T淋巴细胞活化时,通过T细胞表面受体(TCR)识别与主要组织相容性复合体(MHC)Ⅱ类分子相连的抗原肽,从而形成TCR-抗原肽-MHC二类分子复合物。识别后CD4分子结合于MHCⅡ类分子的非多态部位,增加T细胞内信号转导,共同构成了细胞活化的第一信号,辅助B细胞产生抗体,放大免疫应答。而CD8是T抑制/杀伤细胞(TS/TC)的表面标志,具有抑制T细胞活化,阻止B细胞产生抗体,从而抑制细胞及体液免疫效应,发挥其免疫调节作用。
本实验通过缩窄腹主动脉制造心肌肥厚模型,模拟压力超负荷导致的心肌肥厚,造模后大鼠心肌明显增厚,心室重量指数升高,提示压力超负荷是心肌肥厚的主要因素之一;本实验将心肌肥厚大鼠的脾细胞输注给正常SD大鼠,发现受者CD4、TNF-α的表达较对照组明显升高,CD8降低,说明心肌肥厚大鼠的脾细胞进行过继传输,受者大鼠体内的心肌也发生一定程度的肥厚,与文献报道一致[8-9]。他汀类药物是羟甲基戊二酸单酰辅酶A还原酶抑制剂,常规认为其通过阻断该酶使胆固醇合成减少,增加胆固醇的清除,达到调脂的作用。但他汀类药物除了调脂,还具有一定的调节免疫[10]、抗炎、抗氧化、降低 C反应蛋白[11]等多重效应。张雪娟等[12]认为:阿托伐他汀可明显降低CT-1、IL-18水平,对压力负荷导致的心肌肥厚有明显的保护作用,可能与其抗炎作用有关。本实验结果显示阿托伐他汀能明显降低肥厚组及脾细胞输注组CD4,TNF-α蛋白表达,而CD8蛋白表达上升,具有显著抗心肌肥厚作用,其抗心肌肥厚作用机制可能与其阻断细胞免疫信号转导,抑制炎性因子分泌,降低免疫应答从而调节免疫炎症作用相关。但免疫调控是一个复杂的网络体系,该实验观察指标有限,阿托伐他汀调节免疫机制还有待更多的研究来证实。
[1] Loch D,Levick S,Hoey A,et al.Rosuvastatin attenuates hypertension-induced cardiovascular remodeling without affecting blood pressure in DOCA-salt hypertensive rats[J].Cardiovasc Pharmacol,2006,47(3):396.
[2] Zacà V,Rastogi S,Imai M,et al.Chronic mono-therapy with rosuvastatin prevents progressive left ventricular dysfunction and remodeling in dogs with heart failure[J].Am Coll Cardiol,2007,50(6):551.
[3] 季 辉.瑞舒伐他汀对高血压并发高脂血症患者的临床疗效分析[J].实用临床医药杂志,2010,14(21):53.
[4] 王彦珍,孙 胜,蔡莉蓉,等.大鼠腹主动脉狭窄高血压心肌肥厚模型的优化[J].军医进修学院学报,2004,25(3):231.
[5] Chandrasekar B,Mummidi S,Claycomb WC,et al.Interleukin-18 is a Prohypertrophic cytokine that acts through a phosphatidy linositol 3-kinase phosphoinositide dependent kinase-1-Akt-GATAS signaling pathway in cardiomyocytes[J].J Biol chem,2005,280(6):4553.
[6] Si X,Rahmani M,Yuan J,et al.Detection of cardiac signaling in the injured and and hypertrophied heart[J].Methods mol med,2005,112:291.
[7] Tatenkulova SN,Mareev VI,Zykov KA,et al.Immune mechanisms of inflammation in dilated cardiomyopathy[J].Kardiologiia,2009,49(2):4.
[8] Kitazawa Y,Fujino M,Sakai T,et al.Foxp3-expressing regulatory T cells expanded with CD28 superagonist antibody can prevent rat cardiac allograft rejection[J].J Heart Lung Transplant,2008,27(4):362.
[9] Xia G,He J,Zhang Z,et al.Targeting acute allograft rejection by immunotherapy with ex vivo-expanded natural CD4+CD25+regulatory T cells[J].Transplantation,2006,82(12):1749.
[10] Mielniczuk L M,Baughman K L.Immune modulation therapy in heart failure[J].Congest Heart Fail,2006,12(2):91.
[11] Wu L,Zhao L,Zheng Q,et al.Sinvastatin attenuates hypertrophic responses induced by cardiotrophin-1 via JAK STAT pathway in cultured cardiomyocytes[J].Mol cell Biochem,2006,284(1-2):65.
[12] 张雪娟,徐庆科,谭 凯,等.阿托伐他汀防止压力负荷导致心肌肥厚的抗炎机制[J].中华高压杂志,2008,16(11):1028.
