百癣夏塔热胶囊对小鼠接触性皮炎的作用及机制研究
2011-08-07陈菲菲朱晓芳
陈菲菲,朱晓芳,高 慧,骆 丹
(1.扬州大学临床医学院皮肤科,江苏扬州,225001;2.南京医科大学第一附属医院皮肤科,江苏南京,210029)
变应性接触性皮炎(ACD)是皮肤、黏膜接触致敏物后,由T细胞介导的迟发型变态反应引起的炎症性皮肤病。研究发现肿瘤坏死因子在变应性接触性皮炎的发病过程中发挥重要作用,核因子-κ B参与免疫与炎症的调节过程。百癣夏塔热胶囊具有清除异常黏液质、胆液质及败血、消肿止痒,清热解毒等功能,用于治疗过敏性皮炎、带状疱疹、花斑癣、银屑病、和痤疮等。本研究通过建立小鼠变应性接触性皮炎模型,观察百癣夏塔热胶囊对小鼠ACD的治疗作用,探讨百癣夏塔热胶囊对小鼠ACD的作用机制。
1 材料与方法
1.1 动物
实验用小鼠为扬州大学医学院动物中心提供的昆明小鼠42只,雌雄各半,6~8周龄,体重25~30 g。小鼠饲养于金属笼中,随意饮食、饮水,周围温度20℃,湿度60%。
1.2 主要试剂和试剂盒
2,4-二硝基氟苯(SigmaAldrich公司)、百癣夏塔热胶囊(陕西东泰制药)、地塞米松片(浙江仙琚制药股份有限公司)、TNF-α ELISA试剂盒、NF-κ B免疫组化试剂盒(武汉博士德公司)。
1.3 实验器材与仪器
皮肤圆形打孔器(直径6 mm)、电子分析天平、数显游标卡尺、微孔板酶标仪、酶标仪洗板机。
1.4 实验方法
小鼠变应性接触性皮炎模型建立:①DNFB配备:250 mg DNFB加入4:1体积比的丙酮与橄榄油混合液50 mL,配成0.5%的DNFB溶液;将250 mg DNFB加入4:1体积比的丙酮与橄榄油混合液125 mL,配成0.2%的DNFB溶液。②取昆明小鼠10只,雌雄各半,小鼠于实验前1天在腹部备皮2 cm×1.5 cm,用8%硫化钠水溶液脱毛,生理盐水充分擦洗。实验第1天、第2天在腹部去毛部位涂布0.5%的25 μ L DNFB溶液致敏。实验第6天在小鼠的左耳腹、耳背面涂布0.2%的20 μ L DNFB溶液诱发皮炎。右耳涂布20 μ L基质[1]。建立小鼠变应性接触性皮炎模型。实验第7天观察小鼠左耳大体形态变化,处死后取左耳皮损行组织病理检查,判定造模是否成功。
百癣夏塔热胶囊对小鼠变应性接触性皮炎模型的影响:①实验分组:造模成功后,32只小鼠被随机分为4组,分别为正常对照组、模型组、地塞米松对照组和百癣夏塔热给药组,每组8只。②DNFB诱发模型:同小鼠变应性接触性皮炎模型建立。③给药方法:百癣夏塔热组小鼠体重用药量为30 g左右小鼠0.1片/d(药物剂量按每千克体质量为《中华人民共和国药典》规定临床用量的20倍),溶于0.5%羧甲基纤维素溶液中,将药物浓度校正到实验中每30g小鼠体质量灌胃量为0.4 mL。地塞米松体重用药量为30 g左右小鼠0.09 mg/d(按成人每天地塞米松9 mg,小鼠用药量为20倍),溶于0.5%羧甲基纤维素溶液中,每次取0.4 mL灌胃。模型组每次予以生理盐水0.4 mL灌胃。实验第1天起各组自第1次涂药前2 h灌胃,连续用药5 d,1次/d。实验第6天涂药前2 h及涂药后6 h灌胃各1次。所有小鼠于第7天摘眼球取血备用。测量小鼠双耳中部厚度,用皮肤圆形打孔器沿小鼠左耳耳缘中部打孔,所取左耳组织置于95%酒精中固定。进行组织病理检查及免疫病理检查。
观察指标:①耳厚度差:数显游标卡尺测量小鼠双侧耳中部的厚度,计算诱发后左右耳厚度差。②组织病理检查:处死后取小鼠左耳组织常规石蜡切片,HE染色。光镜观察组织病理变化。③NF-κ B在皮损处的表达:小鼠左耳组织进行常规石蜡包埋,连续切片,切片常规脱蜡至水,3%H2O2溶液消除内源性过氧化物酶活性,热修复抗原,滴加5%BSA封闭液,然后依次加入一抗、生物素化二抗,SABC后,DAB显色,苏木素复染,脱水,透明,封片。显微镜观察。④血清TNF-α检测小鼠摘除眼球取血1.5 mL,静置15 min后,3 000 r/min离心15 min,分离血清,采用酶联免疫吸附法(ELISA)测定血清中细胞因子TNF-α水平。
2 结 果
2.1 小鼠变应性接触性皮炎模型的建立
用DNFB诱发的小鼠左耳肿胀、充血,耳部血管扩张。组织病理显示表皮角化过度,表皮增厚,表皮细胞间及细胞内水肿,能发现较多的单一核细胞及少数多形核细胞的浸润。真皮结缔组织水肿,血管周围可见轻度细胞浸润(见图1)。小鼠变应性接触性皮炎模型成功建立。
2.2 各药物对鼠耳厚度的影响
肉眼观察,模型组小鼠左耳肿胀、充血,可见耳部血管扩张。地塞米松对照组及百癣夏塔热给药组小鼠左耳肿胀不明显,无明显充血。地塞米松组及百癣夏塔热组诱发后小鼠左右耳厚度差与模型组相比明显减小。地塞米松及百癣夏塔热胶囊能有效改善变应性接触性皮炎小鼠耳肿胀情况,见表 1。


图1 小鼠变应性接触性皮炎临床、组织病理改变(HE染色 100倍)

表1 百癣夏塔热胶囊对接触性皮炎小鼠耳厚度差的影响( x±s)

图2 各药物对组织病理的影响(HE染色 100倍)
2.3 各药物对组织病理学的影响
模型组HE染色切片可见:表皮角化过度,表皮增厚,表皮细胞间及细胞内水肿,能发现较多的单一核细胞及少数多形核细胞的浸润。真皮结缔组织水肿,血管周围可见轻度细胞浸润。地塞米松对照组及百癣夏塔热给药组HE染色切片可见:表皮、真皮无明显水肿,炎性细胞浸润减少(见图2)。
2.4 各药物对NF-κ B检测结果的影响
NF-κ B p65在变应性接触性皮炎皮损角质形成细胞核周和胞浆表达,模型组皮损处胞浆及部分胞核可见棕黄色颗粒沉着。百癣夏塔热组及地塞米松组NF-κ B p65表达明显减少甚至消失,正常对照组未见NF-κ B p65表达(见图 3)。

图3 各药物对耳组织NF-κ B表达的影响(SP染色 200倍)
2.5 各药物对小鼠血清中细胞因子TNF-α的影响
模型组小鼠血清中TNF-α水平比正常对照组明显升高,经百癣夏塔热胶囊及地塞米松处理后的小鼠血清TNF-α水平与模型组相比明显下降,百癣夏塔热胶囊及地塞米松能降低变应性接触性皮炎小鼠血清中TNF-α含量,抑制了变应性接触性皮炎的炎症反应,见表2。
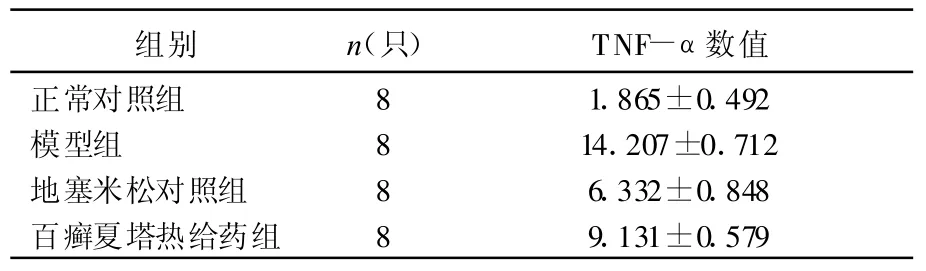
表2 各组小鼠血清中TNF-α数值测定( x±s)
实验前各组小鼠体重无明显差异,各组给药过程中体重略有下降,但差异无统计学意义,说明百癣夏塔热胶囊对小鼠生理及代谢功能无明显影响,各组动物一般状况良好。
3 讨 论
变应性接触性皮炎属于与Ⅳ型变态反应,皮疹多形性、剧烈瘙痒、易于复发。目前大多数观点认为,变应性接触性皮炎主要由 Th1型细胞介导,而Th2型细胞参与其调节过程。
TNF-α主要由Th1细胞分泌,它在ACD的发病过程中发挥重要作用[2],TNF-α是重要的炎症前介质,可以诱导炎症反应中多种细胞因子的产生、黏附分子(如ICAM-1)和协同刺激因子的表达[3-4],也具有局部促炎性反应作用,改变血管内皮细胞的通透性,增加血管渗出,刺激中性粒细胞等炎性细胞的趋化反应,从而启动炎性反应,加强单核巨噬细胞的吞噬功能,诱导前列腺素的合成等。同时促进成纤维细胞生长,刺激IL-1、IL-6、单核细胞趋化蛋白(MCP)等其他细胞因子合成释放,产生细胞因子的瀑布效应。在变应性接触性皮炎发病过程中能够最终导致白细胞、淋巴细胞及单核细胞等外渗至组织内引起炎症反应。同时,肿瘤坏死因子TNF-α对朗格汉斯细胞的活化、移动和抗原的提呈起重要作用[5]。
NF-κ B在变应性接触性皮炎发病过程中起着重要的作用,首先NF-κ B在抗原递呈细胞成熟阶段与分化中起重要的作用,它是树突状细胞成熟过程中炎症刺激信号的转换器,与树突状细胞的成熟密切相关[6],促进了变应性接触性皮炎发病初始阶段抗原递呈作用。其次NF-κ B可能作为始发炎症反应的上游环节在疾病中起重要作用。活化的NF-κ B参与机体多种蛋白、酶及细胞因子的基因转录[7],激活的NF-κ B可诱导免疫细胞的多种炎症相关基因表达[8]、炎细胞因子(TNF-α、IL-1 、IL-6)、趋化因子、协同刺激分子及黏附分子等表达,进而参与免疫炎症反应调控。因此NF-κ B的激活就可作为炎性反应的触发器及关键环节,瀑布式诱导机体一系列炎性反应因子的产生[9],最终导致炎性病理损伤。
肿瘤坏死因子(TNF-α)是诱导NF-κ B活化的重要细胞因子。TNF-α能够调节皮肤炎症相关分子的表达而激发皮肤炎症。已有多项研究结果支持NF-κ B与TNF-α之间可形成相互激活的级联反应。TNF-α正反馈调节NF-κ B激活后,可增强TNF-α和IL-1β等的基因转录,促使TNF-α和IL-1β产生和释放增多,后者又导致NF-κ B的进一步激活。
百癣夏塔热胶囊是由芦荟、地锦草、司卡摩尼亚脂、毛诃子肉、诃子肉、西青果等药加工而成的维药制剂,能稳定肥大细胞的细胞膜,抑制肥大细胞脱颗粒,提高致痒阀[10]。现代药理研究证明,芦荟和诃子具有抗炎、止痒、免疫调节、抗氧化等药理作用[11],诃子肉,毛诃子肉、西青果的主要有效成分均为没食子酸[12]。没食子酸具有抗炎、抗突变、抗氧化等多种生物学活性。
百癣夏塔热胶囊临床上可以用于过敏性皮炎等疾病的治疗,但治疗的机理少有人研究。本实验结果表示,通过小鼠耳肿胀度及组织病理的变化,证明百癣夏塔热胶囊对小鼠变应性接触性接触性皮炎有明显的治疗作用。百癣夏塔热胶囊明显抑制小鼠DNFB诱发的ACD,表明该药具有抑制T淋巴细胞参与的过敏反应,同时对DNFB引起的炎症反应有抑制作用。百癣夏塔热胶囊对小鼠接触性皮炎的免疫调节作用除了直接抑制Th1细胞相关的细胞因子 TNF-α表达外,还可能通过直接或间接抑制NF-κ B的活化,从而进一步抑制NF-κ B调控的促炎细胞因子。从而对ACD起到治疗作用。目前,治疗变应性接触性皮炎的主要药物是抗组胺药及激素,百癣夏塔热胶囊可以作为治疗的有益的补充。
[1] 许宗严,吴 铁,吴志华.鼠皮炎湿疹模型建立的研究进展[J].中国临床药理学与治疗学,2005,10(7):730.
[2] Nakae S,Komiyama Y,Narumi S,et al.IL-1 induced tumor necrosis factor-alpha elicits inflammatory cell infillration in the skin by inducing IFN-gamma-inducible protein in the elicitation phase of the contact hypersensitivity response[J].Int Immunol,2003,15:251.
[3] Groves R W,Allen M H,Ross E L,et al.Tumour necrosis factor alpha is pro-inflammatory in normal human skin and modulates cutaneous adhesion molecule expression[J].Br J Dermatol,1995,132:345.
[4] Sheu M Y,Fowler A J,Kao J,et al.Topical peroxisome proliferator activated receptor-alpha activators reduce inflammation in irritant and allergic contact dermatitis models[J].J Invest Dermatol,2002,118:94.
[5] Cumberbatch M,Dearman R J,Kimber I.langerhans cells requiresignals from both tumour necrosis factor-alpha and interleukin-1 beta for migration[J].Immunology,1997,92:388.
[6] OSullivan B J,Thomas R.CD40Ligation conditions dendritic cell antigen-presenting function through sustained activation of NF-κ B[J].J Immunol,2002,168(11):5491.
[7] Barnes P J,Karin M.Nuclear factor-kappaB:a pivotal transcription factor in chronic inflammatory diseases[J].N Engl J Med,1997,336:1066.
[8] Barnes P J,Karin M.Nuclear Factor-κ B-A pivotal transcription factor in chronic inflammatiory diseases[J].N Engl J Med,1997,336:1066.
[9] Sha W C.Regulation of immune responses by NF-κ B/Rel transcription factors[J].J Exp Med,1998,187:143.
[10] 努尔买买提·艾买提,斯拉甫·艾白,哈木拉提·吾甫尔.夏塔热片合用夏塔热软膏的抗过敏作用研究[J].中药新药与临床药理,2003,14(1):24.
[11] 郑虎占,董泽宏,佘 靖,等.中药现代研究与应用[M].北京:学苑出版社,1998,2256.
[12] 王晓飞,金向群.高效液相色谱法测定百癣夏塔热胶囊中没食子酸的含量[J].时珍国医国药,2006,17(2):194.
