胰腺癌经动脉介入治疗的研究现状
2011-05-28李伟程合倪泉兴
李伟 程合 倪泉兴
1.山东省中医药大学药学院基础化学系,山东 济南 250355;2.复旦大学附属肿瘤医院胰腺肝胆外科,复旦大学上海医学院肿瘤学系,上海 200032
胰腺癌经动脉介入治疗的研究现状
李伟1程合2倪泉兴2
1.山东省中医药大学药学院基础化学系,山东 济南 250355;2.复旦大学附属肿瘤医院胰腺肝胆外科,复旦大学上海医学院肿瘤学系,上海 200032
胰腺癌是一类恶性程度高、病情进展迅速、手术切除率低且预后极差的消化系统恶性肿瘤。患者常由于早期诊断困难而失去手术根治性切除的机会,且放、化疗等治疗效果不尽如人意。近年来,随介入技术的不断发展,微创性介入治疗已成为提高生存质量、延长生存期的重点研究方向之一。其中,经动脉灌注的介入联合化疗以其相对高效、安全、简便、并发症和不良反应较低等优点,成为无法手术切除的患者延长存活期,提高生活质量的重要治疗手段之一;而以动脉介入为主的新辅助治疗对提高患者的手术切除率以及生存率具有显著意义。在基因治疗成为肿瘤治疗研究热点的现况下,靶向治疗与介入治疗的结合将成为临床胰腺癌治疗的一个具有广阔发展前景的方向。
胰腺癌; 介入治疗; 动脉介入; 联合化疗; 靶向治疗
胰腺癌是消化系统常见的恶性肿瘤之一,据统计,美国2010年胰腺癌新发病例数约43 140例,同期死亡36 800例,在所有恶性肿瘤中,发病率居第10位,是第4位癌症死因,5年生存率仅5%~6%[1]。在我国北京、上海等大城市,胰腺癌发病率在20年间增长了约4倍,其中上海总发病率高达14/10万,已经与发达国家持平,且我国胰腺癌发病还呈现出比较明显的低龄化趋势。由于胰腺解剖位置特殊,胰腺癌临床症状往往为非特异性,虽然近年来实验室检测技术提高,影像学技术迅速发展,以及其他诊断技术进步,但是胰腺癌的早期诊断率仍然很低,80%~85%的胰腺癌患者临床确定诊断时就已发生局部血管侵犯或者全身的转移而无法行根治性的切除术,只有约5%~10%的患者能行根治性切除手术,即使这部分患者,预后仍然很差。对于中晚期胰腺癌的治疗,主要行化疗、放疗和中医药治疗等,往往带来较多的不良反应,且临床治疗效果有限[2-3]。胰腺癌对静脉化疗极不敏感,以往以5-FU为基础的静脉化疗,并不能提高胰腺癌患者的生存率,而且由于其血液系统及消化系统等严重的不良反应,患者的生命质量亦没有得到提高。近年来,吉西他滨作为一种新的抗癌药物应用于胰腺癌的静脉化疗,虽然较以往的以5-FU为主的化疗提高了临床受益,但即使与其他化疗药物联合应用,其疗效仍然很低。因此,对胰腺癌的治疗需要新的更有效的方法。最近几年,胰腺癌的经动脉介入治疗取得了一定的研究进展,现对国内外的胰腺癌的血管介入性治疗研究现状作一综述。
1 理论基础
1.1 胰腺血管解剖基础
胰腺的位置较深,位于腹后壁,胰腺的动脉血供主要是来自于腹腔干发出的肝总动脉、脾动脉、肠系膜上动脉,胰腺头部的血供主要来自胃十二指肠动脉发出的胰十二指肠前上、后上动脉和肠系膜上动脉发出的胰十二指肠动脉前下、后下动脉,并吻合成血管弓。胰腺体尾部的血供主要来自脾动脉发出的胰背动脉、胰尾动脉和胰大动脉。此外,胰头和胰体尾之间常有吻合支连接于胃十二指肠动脉、胰背动脉、胰横动脉[4]。肠系膜上动脉常有变异分支发出胰背动脉和胰横动脉,因此,经腹腔干动脉或肠系膜上动脉输注的抗癌药物能覆盖整个胰腺,同时经肝动脉的输注对胰腺癌的肝转移同样有作用。根据胰腺的血供特点,胰头癌通常采用经腹腔干和肠系膜上动脉输注化疗药物,胰体尾部癌症通常采用经脾动脉和肠系膜上动脉输注药物。
1.2 理论依据
由于胰腺癌组织常被纤维组织包裹,肿瘤组织缺乏血供,经静脉化疗时,抗癌药物到达癌细胞较少,同时多重耐药基因(MDR1)的高表达,使其对化疗药物不够敏感,另外,胰腺癌组织表达高水平的P-170糖蛋白,P-糖蛋白是一种药物或毒素外排酶系统的一部分,可以迅速清除化疗药物。因此,需要提高局部化疗药物的浓度来对抗其耐药性[5-6],经导管动脉输注化疗通过导管对肿瘤的供血动脉靶向治疗和首过效应,提高了化疗药物在肿瘤组织中的药物浓度,降低了全身血液系统中的药物浓度,不仅较静脉化疗提高了疗效,同时也减少了不良反应的发生,提高了胰腺癌患者化疗的可耐受性。胰头癌经腹腔干动脉和肠系膜上动脉行介入化疗时,通过门静脉回流的二次输注,更可以杀灭门脉系统内的游离肿瘤细胞,减少术后肝转移的发生[7]。孙建等[8]对胰腺癌介入化疗后组织病理学改变进行分析,结果表明介入化疗确实可以致胰腺癌细胞变性、坏死,减少癌细胞负荷,且可以激发局部的细胞免疫功能,有利于抗癌治疗。介入化疗可以明显提高抗癌药物在胰腺癌组织中的浓度,同时可以减少化疗药物在血液系统中的浓度,减少对心、肾、肺等的不良反应。
1.3 技术方法
经导管动脉化疗一般采用Seldinger插管技术经股动脉穿刺,也有采用经锁骨下动脉穿刺的。首先行选择性的腹腔动脉和肠系膜上动脉造影,根据肿瘤的部位、血供情况及侵犯的范围确定靶血管,一般来说,对于胰头部的肿瘤多行腹腔干和肠系膜上动脉靶向输注抗癌药物,分别注入总药量的1/2,而胰体尾部的肿瘤一般以腹腔干和脾动脉作为靶血管,分别输注抗癌药物的1/2。伴有肝转移的以肝动脉灌注化疗后碘油栓塞。如果病灶局部造影显示肿瘤血管明确者,可以应用微导管做超选择插管输注化疗药物,以提高局部肿瘤组织中化疗药物的浓度及提高疗效。
2 药物选择
2.1 化疗方案
近年来,经动脉灌注化疗的研究发展很快,经动脉灌注介入治疗,化疗药物直接注入胰腺组织中,不但可以提高肿瘤组织中化疗药物的浓度,同时,可以减少化疗药物在血液系统及胃肠道中的药物浓度,减少不良反应的发生,提高患者的耐受性。常要的介入治疗的化疗药物有:吉西他滨、5-FU、丝裂霉素、顺铂、卡铂、四氢叶酸、多柔比星、氟尿嘧啶等,一般以吉西他滨为主,联合1~2种化疗药物同时灌注化疗,也有联合吉西他滨静脉化疗或者同步放疗的联合治疗方案(表1)。
国内外对胰腺癌都主张采用联合化疗方案,多项研究显示联合应用化疗药物能够在一定程度上改善中晚期胰腺癌患者的症状,提高患者的生存时间。国内1项前瞻性随机临床对照试验研究,采用FAM(多柔比星、丝裂霉素和5-FU)方案,结果显示介入化疗组较静脉化疗组明显提高了生存时间和肿瘤反应率,分别是:13.3个月vs6.2个月和77.1%vs35.7%,同时,介入化疗组比静脉化疗组有更好的疼痛缓解[9]。国外Mambrini等[10]报道采用5-FU、亚叶酸钙、表柔比星和卡铂的联合介入治疗方案,对211例符合要求的不能切除的中晚期胰腺癌患者进行化疗,患者可以耐受不良反应,中位生存期约9.2个月。Sasada等[13]对16例Ⅳ期胰腺癌患者采用经动脉灌注5-FU联合顺铂的化疗方案,同以往采取手术、静脉化疗或者放疗的患者进行历史性对照研究,结果患者的中位生存期及1、2和3年生存率均较以往的方法有显著的提高。另外,1项对意大利10个研究中心的650例Ⅲ期胰腺癌患者的以往治疗方案及结果分析,发现以吉西他滨、顺铂、氟尿嘧啶为基础的,4种化疗药物联合使用动脉灌注方案的中位生存期(16.2个月)及1年生存率(62.6%)显著高于单用吉西他滨动脉灌注的化疗方案[14]。联合化疗方案可以提高化疗药物对实体瘤的疗效,抗癌药物在作用机制上不尽相同,分别作用于细胞代谢或增生过程的不同环节,联合化疗可以对不同时期的肿瘤细胞产生杀伤作用,提高化疗效果,同时,还可以减少肿瘤细胞对化疗药物耐药性的发生[15]。
近年来,新辅助治疗成为胰腺癌治疗上的研究热点之一,国内1项随机对照前瞻性研究,将100例可切除性胰头癌患者随机分成实验组和对照组各50例,实验组采用新辅助化疗,即术前化疗联合术后化疗,对照组采用胰头癌切除后予术后化疗。结果显示,实验组疾病缓解和临床受益反应分别为80%和84%,血清肿瘤标志物下降明显,26%患者术前化疗后肿块缩小,且没有出现明显的手术并发症和严重的不良反应,与对照组相比,肝转移的发生显著降低,分别为34%和50%[16]。国外Takamori等[17]对44例胰腺癌患者术前及术后采用5-FU介入化疗联合吉西他滨静脉化疗,得到了非常显著的疗效:中位生存期达到了36.5个月,5年生存率为30.5%。这表明多模式治疗发案是可行的,术前化疗可以减少术前肿瘤的大小,降低手术的难度,同时减少术后肝转移的发生,对提高胰腺癌患者的手术切除率及生存率有显著的意义。
2.2 分子靶向药物治疗
血管内皮细胞生长因子(VEGF)与其受体VEGFR结合后,通过酪氨酸激酶磷酸化,启动信号转导途径,诱导肿瘤新生血管的形成及促进肿瘤的转移。贝伐单抗是一种重组人源化抗VEGF-A单克隆抗体,Kindler等[18]对52例转移性胰腺癌患者行贝伐单抗联合吉西他滨治疗,肿瘤反应率为21%,中位生存期为8.8个月,1年生存率为21%,主要的不良反应为出血和穿孔。但是在随后1项Ⅲ期的临床随机对照双盲试验中,对602例进展期胰腺癌患者,随机分成2组,一组行吉西他滨加贝伐单抗治疗,另一组行吉西他滨加安慰剂治疗,其中位生存期分别为5.8和5.9个月,联合贝伐单抗后,临床效果并不理想[19]。另有1项包含607例胰腺癌患者的Ⅲ期随机对照临床试验,采用吉西他滨、艾罗替尼联合贝伐单抗的治疗方案,和对照组(吉西他滨、艾罗替尼加安慰剂)相比总的生存率差异也没有统计学意义[20]。这些均表明,可能由于胰腺癌细胞过度表达其他的一些促进肿瘤生长的因子,如:成纤维细胞生长因子、血管生成胰岛素样生长因子-1等,贝伐单抗并没有对胰腺癌的治疗显示出良好的效果。
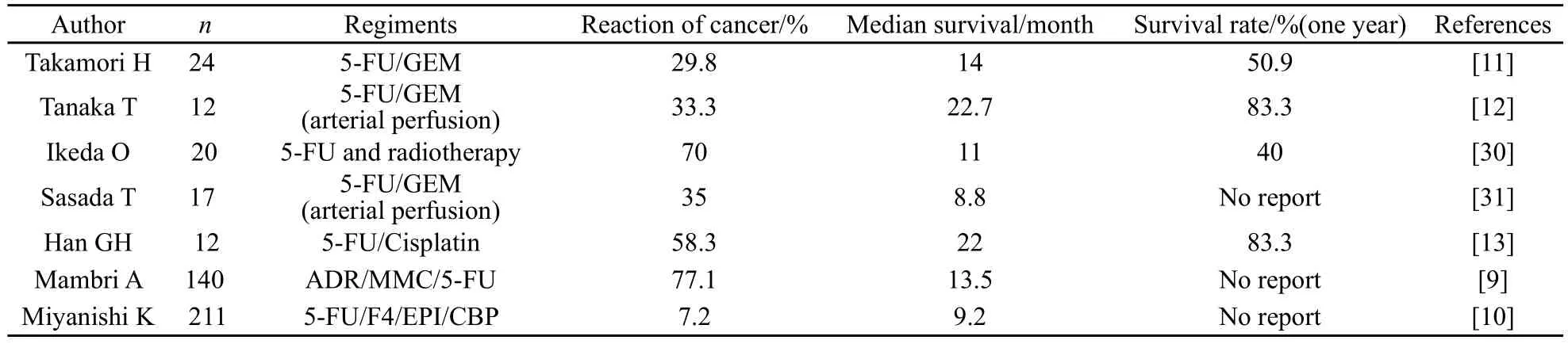
表 1 几种联合化疗方案的比较研究Tab.1 Comparative study of different combined chemotherapies
表皮生长因子受体(EGFR)又称为HER1,是一种跨膜酪氨酸激酶生长因子受体,与其配体结合后,自身磷酸化,启动信号转导途径,促进肿瘤细胞的增殖、损伤修复、侵袭和新生血管的形成。30%~89%的胰腺癌中有EGFR的表达,西妥昔单抗是一种抗EGFR的治疗性抗体,在1项Ⅱ期临床试验中,41例EGFR表达阳性的胰腺癌患者通过西妥昔单抗联合吉西他滨治疗,肿瘤反应率为12.5%,中位生存期为7.1个月,1年生存率为31.7%,并且,不良反应可以耐受,显示了良好的临床治疗效果[21]。曲妥珠单抗是一种人源化的中和性抗体,作用于Her-2受体,1项Ⅰ期临床试验,对34例高表达Her-2的胰腺癌患者行吉西他滨联合曲妥珠单抗治疗,肿瘤部分反应率为6%,41%的患者CA199下降超过50%[22]。其临床治疗效果有限,有待进一步的Ⅱ/Ⅲ期临床试验。另外,在1项联合应用曲妥珠单抗和西妥昔单抗治疗胰腺癌模型老鼠的研究中,与单用吉西他滨治疗相比,明显提高了生存率和肿瘤反应率[23],有待进一步的临床研究论证。
癌胚抗原(CEA)是一种肿瘤相关性糖蛋白,在90%以上的胰腺癌患者中高表达,Kab201是一种抗CEA的单克隆抗体,已用于不能切除的胰腺癌的Ⅰ/Ⅱ期临床试验[24]。
3 栓塞的选择
对胰腺癌供血动脉进行栓塞,可以减少化疗药物进入胃肠道及血液系统,减少骨髓抑制及恶心、呕吐等不良反应的发生,同时,可以增加药物在肿瘤组织中的滞留。另外,其本身的栓塞作用,还可以减少肿瘤的血供,增加细胞毒作用,导致肿瘤细胞的坏死。但是由于胰腺功能的特殊性,其对缺血的高度敏感性,可导致急性胰腺炎的发生,引起严重的不良反应。因此对是否需要栓塞仍存在很大的争议。Homma等[25]对胰腺周围的血供用微钢圈进行超选择性的栓塞以限制血液流入肿瘤组织中,仅保留胰大动脉和胰尾动脉,虽然他们得到的临床治疗效果非常出色(中位生存期22.86个月,1、2、3年生存率分别是100%、50%和33.3%,但是他们的新技术非常复杂,不易推广。而Sasada等[13]对16例胰腺癌患者未行特殊的栓塞,其结果(中位生存期22个月,1、2和3年生存率分别是83.3%、41.7%和16.7%)与Homma等[25]报道的相似。此外,他们也对3例血管造影显示肿瘤血供丰富的患者进行超选择栓塞,但是这3例患者的治疗效果却比较差。因此对是否需要栓塞,我们仍然还不明确。
最近,Tanaka等[26]报道了一种新的栓塞疗法,他们只栓塞起源于肠系膜上动脉的分支动脉,如:胰十二指肠下动脉、胰背动脉。而并不栓塞胃十二指肠动脉、胃十二指肠前上动脉或者胃十二指肠后上动脉。这项新方法,相对于Homma等[25]报道的方法要简单的多,同时可以增加肿瘤组织中化疗药物的浓度。另外,即使是栓塞了肠系膜上动脉及其分支,整个肝脏的血供仍可以通过腹腔干灌注覆盖。这项新技术可能是对不可切除性胰腺癌患者治疗的一种突破,但需要临床反应和受益等方面研究的支持。对胰腺癌的供血动脉是否需要栓塞,栓塞哪些动脉?仍不够明确,需要新的更有说服力的研究证据。
4 血流动力学改变
对胰腺癌介入化疗血流动力学的研究仍然十分有限,Shamseddine等[27]对7例胰腺癌患者行吉西他滨介入治疗,4例行静脉化疗,发现血浆药时曲线下面积,静脉化疗组与介入化疗组相比,差异有统计学意义(P<0.000 1)。这表明静脉组血浆中化疗药物浓度高,容易导致骨髓抑制等不良反应的发生,同时,到达肿瘤组织的药物少,难以对肿瘤发挥作用,而介入治疗则刚好相反。另外由于经动脉介入化疗的首过效应,更可以增加化疗药物对肿瘤的反应。有学者提出用血管紧张素Ⅱ联合化疗药物对胰腺癌进行治疗。AT-Ⅱ导致正常的血管收缩,而肿瘤血管不成熟,缺少平滑肌细胞和反应神经,对血管收缩剂无反应。因此可以使化疗药物在肿瘤组织中的浓度升高,提高化疗效果。同时,应用血管收缩剂AT-Ⅱ后,肿瘤组织的血供得到加强,应用CTA,可以提高胰腺癌肝转移的术前诊断率[28]。
5 对生命质量的影响
尽管目前中晚期胰腺癌行区域性动脉灌注化疗的研究报道很多,但是对化疗后生命质量的研究却并不多见[9-13],Marjolrin等[29]将120例经手术切除的胰腺癌患者随机分成2组,实验组予介入化疗联合放疗,对照组不予辅助治疗。结果显示介入化疗联合放疗组对社会、心理和情感功能没有提高,但疼痛、恶心和呕吐症状得到了明显的缓解,总的患者生命质量介入组较对照组有提高的趋势。
6 结论
区域性动脉灌注化疗与静脉化疗相比,可以显著提高化疗药物在肿瘤组织中的浓度,同时,减少骨髓抑制、恶心、呕吐等不良反应的发生。目前,对胰腺癌的化疗一般都采用联合化疗的方法,联合化疗方案可以提高化疗药物对实体瘤的疗效,减少肿瘤细胞对化疗药物耐药性的发生,但是其临床疗效仍十分有限,故有必要寻找新的治疗方法联合介入治疗,以提高患者的生存率。近年来,胰腺癌的新辅助化疗和靶向治疗研究迅速,并已取得了一定的成果。在当前的医学分子生物学时代,随着我们对胰腺癌基础领域研究的深入,加之介入治疗技术和器材的不断完善和改进,介入与分子生物学产物的结合将推动胰腺癌的治疗进入一个崭新的阶段。
[1]JEMAL A, SIEGEL R, XU J, et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60(5): 277-300.
[2]ALEXAKIS N, HALLORAN C, RARATY M, et al. Current standards of surgery for pancreatic cancer[J]. Br J Surg,2004, 91(11): 1410-1427.
[3]LOCKHART A C, ROTHENBERG M L, BERLIN J D.Treatment for pancreatic cancer: current therapy and continued progress[J]. Gastroenterology, 2005, 128(6):1642-1654.
[4]COLLINS J M, SILVA A C, HAYMAN L A. Arterial anatomy of the pancreas: part 2. Axial[J]. J Comput Assist Tomogr,2010, 34(5): 795-798.
[5]GOLDSTEIN L J. MDR1 gene expression in solid tumours[J]. Eur J Cancer, 1996, 32A(6): 1039-1050.
[6]GOLDSTEIN L J, GALSKI H, FOJO A, et al. Expression of a multidrug resistance gene in human cancers[J]. J Natl Cancer Inst, 1989, 81(2): 116-124.
[7]MILANDRI C, CALZOLARI F, PASSARDI A, et al. Intraarterial chemotherapy of advanced pancreatic cancer: a single center experience[J]. Hepatogastroenterology, 2007,54(80): 2373-2377.
[8]孙建, 倪泉兴, 傅德良, 等. 胰腺癌介入化疗后组织病理学改变及其意义[J]. 腹部外科, 2003(04).
[9]HAN G H, YIN Z X, MENG X J, et al. Prospective randomized clinical trial of two drug delivery pathway in the treatment of inoperable advanced pancreatic carcinoma[J]. Chin J Dig Dis, 2006, 7(1): 45-48.
[10]MAMBRINI A, SANGUINETTI F, PACETTI P, et al. Intraarterial infusion of 5-fluorouracil, leucovorin, epirubicin and carboplatin (FLEC regimen) in unresectable pancreatic cancer:results of a ten-year experience[J]. In Vivo, 2006, 20(6A):751-755.
[11]TAKAMORI H, KANEMITSU K, TSUJI T, et al. 5-fluorouracil intra-arterial infusion combined with systemic gemcitabine for unresectable pancreatic cancer[J]. Pancreas, 2005, 30(3):223-226.
[12]MIYANISHI K, ISHIWATARI H, HAYASHI T, et al. A phaseⅠ trial of arterial infusion chemotherapy with gemcitabine and 5-fluorouracil for unresectable advanced pancreatic cancer after vascular supply distribution via superselective embolization[J]. Jpn J Clin Oncol, 2008, 38(4): 268-274.
[13]SASADA T, DENNO R, TANAKA T, et al. Intra-arterial infusion chemotherapy with 5-fluorouracil and cisplatin in advanced pancreatic cancer: a feasibility study[J]. Am J Clin Oncol, 2008, 31(1): 71-78.
[14]RENI M, SARTORI N, MAMBRINI A, et al. An Italian study on treatment trends and outcomes of patients with stage Ⅲpancreatic adenocarcinoma in the gemcitabine era: is it time to change?[J]. Anticancer Drugs, 2010, 21(4): 459-464.
[15]WHITEHOUSE P A, COOPER A J, JOHNSON C D.Synergistic activity of gamma-linolenic acid and cytotoxic drugs against pancreatic adenocarcinoma cell lines[J].Pancreatology, 2003, 3(5): 367-373, 373-374.
[16]JIN C, YAO L, LONG J, et al. Effect of multiple-phase regional intra-arterial infusion chemotherapy on patients with resectable pancreatic head adenocarcinoma[J]. Chin Med J(Engl), 2009, 122(3): 284-290.
[17]TAKAMORI H, KANEMITSU K, HIROTA M, et al.Perioperative intra-arterial and systemic chemotherapy for pancreatic cancer[J]. Ann Surg Oncol, 2010.
[18]KINDLER H L, FRIBERG G, SINGH D A, et al. PhaseⅡ trial of bevacizumab plus gemcitabine in patients with advanced pancreatic cancer[J]. J Clin Oncol, 2005, 23(31):8033-8040.
[19]KINDLER H L, NIEDZWIECKI D, HOLLIS D, et al.Gemcitabine plus bevacizumab compared with gemcitabine plus placebo in patients with advanced pancreatic cancer:phase Ⅲ trial of the Cancer and Leukemia Group B (CALGB 80303)[J]. J Clin Oncol, 2010, 28(22): 3617-3622.
[20]VAN CUTSEM E, VERVENNE W L, BENNOUNA J, et al.Phase Ⅲ trial of bevacizumab in combination with gemcitabine and erlotinib in patients with metastatic pancreatic cancer[J]. J Clin Oncol, 2009, 27(13): 2231-2237.
[21]XIONG H Q, ROSENBERG A, LOBUGLIO A, et al.Cetuximab, a monoclonal antibody targeting the epidermal growth factor receptor, in combination with gemcitabine for advanced pancreatic cancer: a multicenter phase Ⅱ trial[J].J Clin Oncol, 2004, 22(13): 2610-2616.
[22]SAFRAN H, IANNITTI D, RAMANATHAN R, et al.Herceptin and gemcitabine for metastatic pancreatic cancers that overexpress Her-2/neu[J]. Cancer Invest, 2004, 22(5):706-712.
[23]LARBOURET C, ROBERT B, BASCOUL-MOLLEVI C,et al. Combined cetuximab and trastuzumab are superior to gemcitabine in the treatment of human pancreatic carcinoma xenografts[J]. Ann Oncol, 2010, 21(1): 98-103.
[24]SULTANA A, SHORE S, RARATY M G, et al. Randomised Phase Ⅰ/Ⅱ trial assessing the safety and efficacy of radiolabelled anti-carcinoembryonic antigen Ⅰ(131) KAb201 antibodies given intra-arterially or intravenously in patients with unresectable pancreatic adenocarcinoma[J]. BMC Cancer, 2009, 9: 66.
[25]HOMMA H, DOI T, MEZAWA S, et al. A novel arterial infusion chemotherapy for the treatment of patients with advanced pancreatic carcinoma after vascular supply distribution via superselective embolization[J]. Cancer,2000, 89(2): 303-313.
[26]TANAKA T, SAKAGUCHI H, SHO M, et al. A novel interventional radiology technique for arterial infusion chemotherapy against advanced pancreatic cancer[J]. AJR Am J Roentgenol, 2009, 192(4): W168-W177.
[27]SHAMSEDDINE A I, KHALIFEH M J, MOURAD F H, et al. Comparative pharmacokinetics and metabolic pathway of gemcitabine during intravenous and intra-arterial delivery in unresectable pancreatic cancer patients[J]. Clin Pharmacokinet, 2005, 44(9): 957-967.
[28]ISHIKAWA T, USHIKI T, KAMIMURA H, et al.Angiotensin-Ⅱ administration is useful for the detection of liver metastasis from pancreatic cancer during pharmacoangiographic computed tomography[J]. World J Gastroenterol, 2007, 13(22): 3080-3083.
[29]MORAK M J, PEK C J, KOMPANJE E J, et al. Quality of life after adjuvant intra-arterial chemotherapy and radiotherapy versus surgery alone in resectable pancreatic and periampullary cancer: a prospective randomized controlled study[J]. Cancer, 2010, 116(4): 830-836.
[30]TANAKA T, SAKAGUCHI H, ANAI H, et al. Arterial infusion of 5-fluorouracil combined with concurrent radiotherapy for unresectable pancreatic cancer: results from a pilot study[J]. AJR Am J Roentgenol, 2007, 189(2): 421-428.
[31]IKEDA O, KUSUNOKI S, KUDOH K, et al. Evaluation of the efficacy of combined continuous arterial infusion and systemic chemotherapy for the treatment of advanced pancreatic carcinoma[J]. Cardiovasc Intervent Radiol, 2006, 29(3):362-370.
The current research of intra-arterial chemotherapy on pancreatic cancer
LI Wei, CHENG He, NI Quan-xing(Department of Basic Chemistry, College of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan Shandong 250355, China)
NI Quan-xing E-mail:wantongyao@gmail.com
Pancreatic cancer is a kind of digestive system cancer, known as highly malignant, rapid progression, low resection rate and poor prognosis. Patients often lose the chance of radical resection surgery because of late diagnosis. Radiotherapy, chemotherapy as well as other treatments are also not satisfactory. In recent years, with the development of intervention technology, minimally invasive intervention therapy has become a key research direction which can improve the quality of life and prolong the survival rate. Of those, the intra-arterial infusion chemotherapy,with its relative efficiency, safety, simplification, and lower complications and toxicity, has been one of the important treatments technique for unresectable patients. What’s more, the new adjuvant chemotherapy mainly by intra-arterial chemotherapy has a remarkable significance in improving the resection rate and overall survival. Under the current hot point research on the tumor gene therapy for cancer, target therapy combined with intra-arterial therapy may be a promising direction for the treatment of pancreatic cancer.
Pancreatic cancer; Intra-arterial therapy; Combined therapy; Target therapy
10.3969/j.issn.1007-3969.2011.06.012
R815;R735.9
A
1007-3639(2011)06-0478-06
倪泉兴 E-mail:wantongyao@gmail.com
2011-04-20
2011-06-20)
