逆转录病毒载体介导人胰岛素样生长因子-I在软骨细胞中的表达
2011-04-01宋之明张绍昆吉林大学第一医院骨科吉林长春300
宋之明 张绍昆 孙 洋 任 琦 (吉林大学第一医院骨科,吉林 长春 300)
软骨损伤较为常见,但由于软骨缺乏血管分布和神经支配,因而损伤后难以自身修复。目前临床治疗软骨缺损的方法很多,随着组织工程技术的发展,利用软骨细胞移植方法修复软骨缺损的研究逐渐成为热点〔1,2〕。但由于自体软骨在体内分布较少,可获取的软骨细胞数量有限;同时软骨细胞的代谢和增殖能力低,体外长期培养易出现去分化现象,难以保持软骨细胞表型,因而获取足够数量和维持表型的自体软骨细胞对于软骨组织工程修复软骨缺损具有重要的意义。胰岛素样生长因子I(Insulin-like growth factor-I,IGF-I)是软骨形成和代谢中最重要的生长因子之一,体内外的研究表明IGF-I能刺激软骨细胞分裂增殖,并合成Ⅱ型胶原和蛋白多糖维持软骨细胞的表型〔3~7〕。本研究利用逆转录病毒介导的方法将具有促进软骨细胞增殖和维持软骨细胞表型作用的人IGF-I(hIGF-I)基因转染兔关节软骨细胞,并检测基因转移后对软骨细胞生物学行为的影响,为软骨组织工程和基因治疗软骨缺损奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 质粒 含有hIFG-I基因的逆转录病毒载体pLNC-IGFGFP由本实验室构建并保存。
1.1.2 实验动物 清洁级2周龄灰兔,雌雄不限,购自长春生物制品研究所实验动物室。
1.1.3 主要试剂 DMEM(高糖)培养基购自Hyclone公司;胎牛血清购自中国医学科学院;胰蛋白酶购自Amresco公司;polybrene、G418均购自 Invitrogen公司;牛血清白蛋白、噻唑蓝(MTT)!硫酸软骨素、木瓜蛋白酶、Ⅱ型胶原酶和焦碳酸二乙酯(DEPC)均购自Sigma公司;二甲基亚甲蓝购自Aldrich公司;小鼠抗人Ⅱ型胶原单克隆抗体购自NeoMarkers公司;兔抗人IGFI抗体、辣根过氧化物酶(HRP)-羊抗小鼠多克隆抗体、链霉亲和素-生物素-过氧化物复合物(SABC)免疫组织化学试剂盒和二氨基联苯胺(DAB)显色试剂盒均购自武汉博士德生物工程有限公司;Trizol试剂购自Gibco公司;其他试剂为国产分析纯。
1.2 方法
1.2.1 兔关节软骨细胞的分离培养 出生2 w灰兔无菌条件下取股骨内、外髁关节软骨,用0.2%Ⅱ型胶原酶于37℃消化,1 500 r/min离心10 min,沉淀物加入含10%胎牛血清的高糖DMEM培养液重悬。台盼蓝记数,并检查细胞活力,以活力达90%以上的细胞悬液按105个/ml的密度接种到培养瓶中,置37℃、5%CO2及饱和湿度条件下培养,细胞贴壁后每隔4~5 d更换培养基,倒置显微镜下观察形态变化,并行细胞染色鉴定。
1.2.2 软骨细胞鉴定
1.2.2.1 甲苯胺蓝染色 原代培养软骨细胞以2×105个/ml接种于预置有盖玻片的6孔板中,待细胞80%融合后,取出玻片,用预冷的丙酮固定细胞15 min,细胞爬片置于10 g/L的甲苯胺蓝染液中染色过夜,体积分数为95%酒精分色后,室温下烘干封片。
1.2.2.2 Ⅱ型胶原免疫细胞化学染色 将原代软骨细胞接种于处理的盖玻片上。细胞克隆爬片以4%多聚甲醛固定15 min,新鲜配制0.5%H2O2/甲醇室温处理30 min,灭活内源性过氧化物酶,进行检测。阳性对照用关节软骨组织,阴性对照用磷酸盐缓冲液(PBS)代替一抗。
1.2.3 逆转录病毒介导的hIGF-I基因转染兔关节软骨细胞
1.2.3.1 G418对兔关节软骨细胞最小致死剂量的测定 24孔板接种适量第2代软骨细胞。细胞长成50%~60%汇合时,加入含有不同浓度 G418(0.1,0.2,0.3,0.4,0.5,0.6,0.7 g/L)的选择培养液。2 w时根据细胞死亡情况确定G418对软骨细胞的最小致死剂量。
1.2.3.2 逆转录病毒介导hIGF-I(含有GFP)转染兔关节软骨细胞及G418抗性细胞的筛选 感染前1 d取第2代软骨细胞以2×104~6 ×104个/孔接种 24 孔培养板,37℃、5%CO2、饱和湿度培养。感染当天移去培养液,加入低血清培养液(含病毒上清0.1 μl、1 μl和5 μl),加入polybrene至终浓度4 μg/ml,37℃感染1~3 h后再次加入低血清培养液,将polybrene稀释至2μg/ml,培养24 h后换成含20%胎牛血清的DMEM培养基培养,72 h后换成最小致死剂量G418选择培养液进行抗性细胞筛选,2 w细胞克隆形成,其阳性克隆在G418维持剂量的压力下继续培养后,将其转移至96孔板,待细胞长满板底再依次转移至24孔板、6孔板扩大培养。以未转染细胞作为对照。
1.2.4 转染软骨细胞的鉴定
1.2.4.1 RT-PCR法检测转染后软骨细胞hIGF-I mRNA表达情况 分别用Trizol试剂提取转染2 d、2 w、4 w和6 w的软骨细胞总 RNA,按照 RT-PCR试剂盒说明书操作。hIGF-I(290 bp)引物序列为:上游5'-CATGTCCTCCTCGCATCTCT-3';下游5'-AGTGATTCCGCTCGAGCTAC-3'。内参照为β-肌动蛋白(β-actin)(540 bp),引物序列为:上游 5'-TACAACCTCCTTGCAGCTCC-3';下游 5'-GGATCTTCATGAGGTAGTAGTG-3'。PCR反应参数为:95℃ 5 min;95℃ 30 s,58℃ 30 s,72℃ 30 s,30 个循环;72℃延伸10 min。产物以琼脂糖电泳观察结果。取同时间点未转染细胞作为对照。
1.2.4.2 免疫细胞化学检测 细胞克隆爬片以4%多聚甲醛(含1‰DEPC)固定15 min,新鲜配制0.5%H2O2/甲醇室温处理30 min,灭活内源性过氧化物酶,进行免疫细胞化学检测IGF-I。未转染细胞作为对照。
1.2.4.3 绿色荧光蛋白在软骨细胞中的表达〔8〕荧光显微镜下紫外光激发观察绿色荧光蛋白的表达。
1.2.5 软骨细胞转染hIGF-I后细胞增殖能力的变化
1.2.5.1 MTT法检测转染的hIGF-I对软骨细胞数量的影响
转染后软骨细胞克隆分别在第2天、第2周和第4周、第6周接种于96孔培养板中,培养24 h后加入5 mg/ml MTT溶液20μl,培养4 h后加入150μl DMSO溶解结晶物,测定490 nm处光吸收值(OD值)%以未转染的软骨细胞为对照。
1.2.5.2 流式细胞仪检测 转染后软骨细胞克隆制成单细胞悬液,4℃预冷的70%乙醇固定,调整细胞数为1×106个/ml,流式细胞仪检测。以未转染的软骨细胞为对照。
1.2.6 转染hIGF-I后软骨细胞表型的检测
1.2.6.1 转染软骨细胞形态学特征 将转染后软骨细胞由6孔板按105个/ml密度转移细胞培养瓶,37℃,5%CO2及饱和湿度条件下培养,细胞贴壁后每隔2~3 d更换培养基,细胞长满培养瓶底后用0.25%胰酶传代,倒置显微镜下观察形态变化。
1.2.6.2 免疫细胞化学检测软骨细胞Ⅱ型胶原表达 未转染的第2代软骨细胞及转染后软骨细胞分别接种于处理的盖玻片上。细胞克隆爬片以4%多聚甲醛(含1‰ DEPC)固定15 min,新鲜配制0.5%H2O2/甲醇室温处理30 min,灭活内源性过氧化物酶,采用鼠抗人Ⅱ型胶原单克隆抗体,进行免疫细胞化学检测。阳性对照用关节软骨组织,阴性对照用PBS代替一抗。
1.2.6.3 二甲基亚甲蓝(DMB)法测细胞传代消化液中硫酸糖胺多糖(GAG)含量 将软骨细胞分别在转染后第2天、2周、4周和6周接种至24孔板,至细胞生长至90%融合时,用0.25%胰蛋白酶(每孔0.25 ml)消化留测GAG含量。细胞消化液中加入木瓜蛋白酶溶液,在60℃水浴中消化60 min,取250μl上述孵化消化液加入2.5 ml DMB显色剂,混匀,反应15 s后,于525 nm波长处比色,测定吸光度,计算糖胺多糖含量(标准品为硫酸软骨素)%
1.2.6.4 ELISA检测细胞上清Ⅱ型胶原相对含量 将软骨细胞分别在转染后第2天、2周、4周和6周接种至24孔板,至细胞生长至90%融合时,收集上清,参照ELISA试剂盒说明书检测软骨细胞培养上清中Ⅱ型胶原表达水平。
1.3 统计学分析 应用SPSS10.0软件,所有数据以±s表示,两组间比较采用t检验,多组间两两比较采用F检验。
2 结果
2.1 兔关节软骨细胞形态学观察 成功分离的兔关节软骨细胞接种后呈球形悬浮状态,折光性强,贴壁较慢,24~36 h贴壁,48 h开始伸展,细胞扁平,单层生长,外形呈梭形或多角形,可见核分裂相。随着培养时间延长,细胞体积增大,呈多边形,可见细胞聚集成簇,长成一片时呈明显的铺路石状外观,与长梭形的成纤维细胞较易区分。传代细胞形态与原代贴壁生长的细胞相似。细胞较大,扁平,呈三角形或多边形,偶可见核分
裂相,胞浆中颗粒较多。软骨细胞传代培养1~5代时,细胞周期为6 d左右。连续传5代,软骨细胞形态基本相同。5代以后,形态逐渐发生变化,表现为长梭形的成纤维样细胞增多。见图1。
2.2 软骨细胞的鉴定 甲苯胺蓝染色见细胞内有大量蓝紫色异染颗粒,Ⅱ型胶原免疫细胞化学染色显示98%以上原代软骨细胞质中有红棕色染色物质,说明有Ⅱ型胶原表达,证明体外分离软骨细胞培养成功。见图2,图3。

图1 培养5代的软骨细胞(×200)
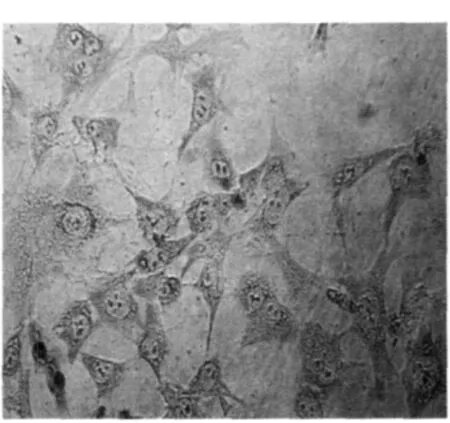
图2 软骨细胞甲苯胺蓝染色(×400)
图3 Ⅱ型胶原免疫细胞化学染色(×400)
2.3 G418对于兔关节软骨细胞的最小致死剂量的测定 加入G418后第4天,高浓度孔内细胞出现死亡脱落现象;2 w时,0.3 g/L浓度孔内可见有少数细胞存活生长,0.4 g/L及以上浓度孔内均无细胞生长。因此,G418对软骨细胞的最小致死剂量为0.4 g/L。
2.4 转染软骨细胞的筛选和鉴定
2.4.1 G418抗性软骨细胞的筛选 转染后软骨细胞经0.4 g/L G418筛选,2 w后得到抗G418的阳性细胞克隆,而未转染细胞在含G418的培养液中逐渐全部死亡,初步证明hIGF-I基因转染成功。
2.4.2 转染软骨细胞hIGF-I mRNA表达情况 RT-PCR法检测结果显示,hIGF-I基因在转染细胞内表达为阳性,在未转染的软骨细胞内表达为阴性。见图4。
2.4.3 细胞免疫组化检测 在转染的软骨细胞质中有棕黄色颗粒样阳性信号,表示hIGF-I蛋白表达阳性,而未转染细胞染色为阴性,证明hIGF-I基因转染软骨细胞成功。见图5。
2.4.4 绿色荧光蛋白在软骨细胞中的表达 在荧光显微镜下,pLNC-IGF-GFP转染的软骨细胞紫外光可激发出绿色荧光,未转染的软骨细胞未见绿色荧光。见图6。
2.5 转染后软骨细胞增殖能力变化
2.5.1 MTT法检测结果 在转染后第2天、第2周、第4周、第6周软骨细胞的增殖能力均明显高于未转染的软骨细胞(P<0.05)%转染后的软骨细胞第6周时的增殖能力与未转染的软骨细胞第2周的增殖能力无明显差别。见表1。
2.5.2 流式细胞仪检测结果 与未转染的软骨细胞相比,转染hIGF-I的软骨细胞S期细胞数目明显增加,G1期细胞数目明显下降,差异均有显著性(P<0.05),G2期细胞数目也有所降低,但无统计学意义。见表2。
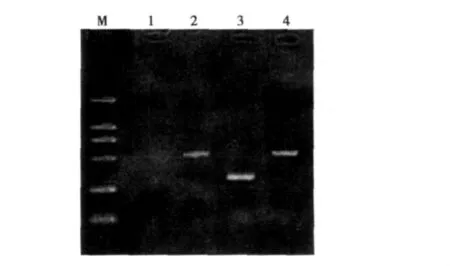
图4 转染软骨细胞RT-PCR检测
表1 MTT法检测转染软骨细胞增殖能力(±s)
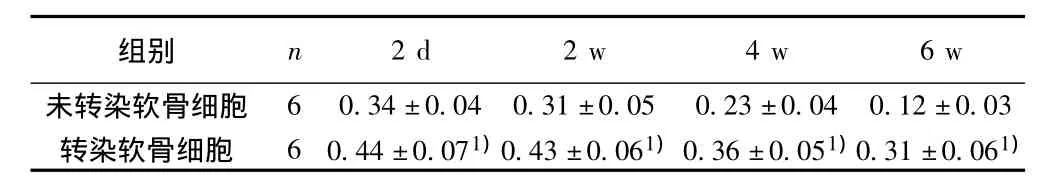
表1 MTT法检测转染软骨细胞增殖能力(±s)
与同时间点未转染软骨细胞比较:1)P<0.05,下表同
?
表2 软骨细胞的细胞周期分布(±s,%)
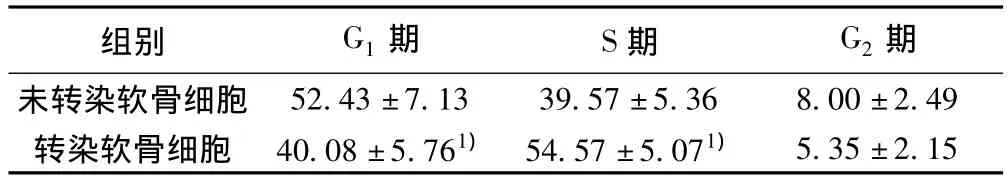
表2 软骨细胞的细胞周期分布(±s,%)
组别 G1期 S期 G2期未转染软骨细胞52.43±7.13 39.57±5.36 8.00±2.49转染软骨细胞 40.08±5.761) 54.57±5.071)5.35±2.15
2.6 转染的软骨细胞表型的检测
2.6.1 转染的软骨细胞形态学特征 形态同传代未转染的软骨细胞,但细胞周期较未转染的软骨细胞短,约为4~5 d左右。连续传7代,软骨细胞形态基本相同。第8代细胞形态逐渐发生变化,反分化的软骨细胞增多。
2.6.2 Ⅱ型胶原免疫组化检测 在转染的软骨细胞质中有红棕色异染信号,表示软骨细胞转染后继续分泌Ⅱ型胶原,没有失去软骨细胞原有表型。见图7。

图5 转染软骨细胞免疫组化染色(×400)

图6 转染细胞GFP表达(×200)

图7 Ⅱ型胶原免疫组化染色(×400)
2.6.3 Ⅱ型胶原ELISA检测结果 转染IGF-I的软骨细胞在2 d、2 w、4 w、6 w时间点细胞培养上清中Ⅱ型胶原的表达均高于未转染的软骨细胞(P<0.05),其中转染后的软骨细胞在6 w时Ⅱ型胶原仍有较高水平的表达。见表3。
2.6.4 GAG含量测定 转染后软骨细胞合成GAG的能力明显增强,均高于同时间点未转染细胞,差异具有显著性意义(P<0.05)%见表4。
表3 Ⅱ型胶原ELISA检测相对含量(±s,n=6)

表3 Ⅱ型胶原ELISA检测相对含量(±s,n=6)
组别2 d 2 w 4 w 6 w未转染软骨细胞 0.495±0.102 0.412±0.121 0.267±0.08 0.103±0.037转染软骨细胞 0.747±0.1191)0.65±0.1681)0.563±0.1531)0.416±0.0811)
表4 转染软骨细胞的GAG含量(±s,n=6,μg/cm2)
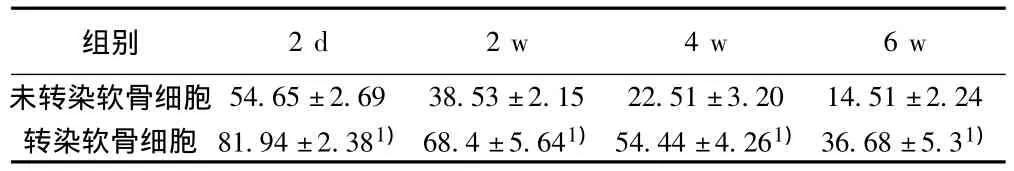
表4 转染软骨细胞的GAG含量(±s,n=6,μg/cm2)
组别2 d 2 w 4 w 6 w未转染软骨细胞 54.65±2.69 38.53±2.15 22.51±3.20 14.51±2.24转染软骨细胞 81.94±2.381)68.4±5.641)54.44±4.261)36.68±5.31)
3 讨论
软骨缺损的治疗一直是临床棘手难题。近年来,随着生长因子在软骨代谢和修复中重要作用的发现,人们将其应用于软骨损伤局部,以促进软骨损伤愈合,获得了良好的效果。在这些已发现的生长因子中,IGF-I由于可以刺激关节软骨蛋白多糖的合成、软骨细胞的分裂增殖和Ⅱ型胶原合成,故越来越受到关注。但是局部应用生长因子治疗软骨缺损仍存在很多缺点,如半衰期短、需反复使用、价格较贵等,影响其临床应用价值。随着分子生物学技术的发展,人们可以利用基因转移技术将生长因子基因转入细胞,再将转基因细胞植入损伤处以促进修复。
本实验分离并鉴定了兔关节软骨细胞,以hlGF-I cDNA为目的基因,以兔关节软骨细胞为靶细胞,利用逆转录病毒载体介导进行细胞转染,通过对转染软骨细胞的筛选鉴定,证明了hlGF-I在软骨细胞内可以得到稳定表达,又通过检测发现,转染后的软骨细胞MTT法测定的OD值增加,流式细胞仪检测显示S期细胞比例上升,软骨细胞Ⅱ型胶原表达增多,GAG含量提高,说明hIGF-I基因转移能促进关节软骨细胞增殖,并维持软骨细胞表型,为进一步研究软骨组织工程和基因治疗软骨缺损奠定了基础。
1 Hunziker EB.Articular cartilage repair:are the intrinsic biological constraints undermining this process insuperable〔J&?Osteoarthritis Cartilage,1999;7(1):15-28.
2 Brittberg M,Lindabl A,Nilsson A,et al.Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation〔J〕.N Engl J Med,1994;331(14):889-95.
3 Laron Z.Insulin-like growth factor I(IGF-I):a growth hormone〔J〕.Mol Path,2001;54(5):311-6.
4 Madry H,Kaul G,Cucchiarini M,et al.Enhanced repair of articular cartilage defects in vivo by transplanted chondrocytes overexpressing insulinlike growth factor I(IGF-I)(J〕.Gene Ther,2005;12(11):1171-9.
5 Madry H,Zurakowski D,Trippel SB.Overexpression of human insulin-like growth factor-I promotes new tissue formation in an ex vivo model of articular chondrocyte transplantation〔J〕.Gene Ther,2001;8(19):1443-9.
6 Madry H,Padera R,Seidel J,et al.Gene transfer of a human insulin-like growth factor I cDNA enhances tissue engineering of cartilage〔J〕.Hum Gene Ther,2002;13(13):1621-30.
7 Nixon AJ,Brower-Toland BD,Bent SJ,et al.Insulin-like growth factor-I gene therapy applications for cartilage repair〔J〕.Clin Orthop Relat Res,2000;379:201-3.
8 Chalfie M,Tu Y,Euskirchen G,et al.Green fluorescent protein as a marker for gene expression〔J〕.Science,1994;263(5148):802-5.
