O-苯甲酰壳聚糖的合成及其抑真菌活性
2011-01-09冯永巍夏文水申丽丽赵云杰
冯永巍, 夏文水*, 申丽丽, 赵云杰
(1.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;2.江南大学食品学院,江苏无锡 214122)
O-苯甲酰壳聚糖的合成及其抑真菌活性
冯永巍1,2, 夏文水*1,2, 申丽丽1,2, 赵云杰1,2
(1.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;2.江南大学食品学院,江苏无锡 214122)
以甲烷磺酸为催化剂和氨基保护剂,苯甲酰氯与壳聚糖酯化合成了O-苯甲酰壳聚糖。产物结构经FITR和1H-NMR光谱分析,酯化反应发生在壳聚糖的羟基,游离氨基得到了很好保护,平均取代度为0.35。以灰霉病菌Botry tis cinerea为受试菌种,研究了O-苯甲酰壳聚糖抑制真菌的活性,结果表明:壳聚糖和O-苯甲酰壳聚糖的有效中质量浓度(EC50)分别为1.55 mg/m L和0.27 mg/m L,O-苯甲酰化壳聚糖的抑真菌活性显著提高。
壳聚糖;O-苯甲酰化壳聚糖;抑真菌活性
壳聚糖是由氨基葡萄糖和N-乙酰氨基葡萄糖通过β-1,4糖苷键连接而成的生物大分子聚合物,具有促进伤口愈合、降低胆固醇、抑制微生物生长等多种生理活性[1-3]。由于具有低毒、生物可降解、能抑制多种微生物生长的特点,壳聚糖被视为开发高效、无毒的新型食品防腐剂的理想基质。然而,壳聚糖本身的防腐抗菌效果弱于目前广泛使用的食品防腐剂,无法直接替代这些防腐剂在食品中的应用[4],有必要通过化学改性的方法将其他的抑菌基团引入壳聚糖分子中提高其抑菌活性。
壳聚糖分子中的氨基和羟基都是高活性的反应位点。N-alkyl、N-benzyl、N,O-acyl壳聚糖衍生物都被证实了对细菌和包括灰霉病菌Botry tis cinerea在内的真菌具有一定的抑制作用[5-7]。但有关选择性的O-酰化壳聚糖衍生物的研究报道并不多,这是因为,壳聚糖氨基的反应活性高于羟基,制备过程中需要进行氨基的保护和脱保护,步骤复杂。然而,壳聚糖的游离氨基被认为是壳聚糖发挥抑菌等生理活性的功能基团,氨基携带的正电荷与微生物细胞表面的负电荷相互作用,是引起细胞表面的剧烈改变和细胞的渗透性变化,从而导致细胞死亡主要原因[8]。因此,本研究利用甲烷磺酸在反应中与氨基成盐对氨基进行保护,在保留游离氨基的基础上,将强抑菌基团苯甲酸引入到壳聚糖分子,酯化合成具有双抑菌基团的O-苯甲酰壳聚糖衍生物。选择引起植物病害的灰霉病菌B.cinerea为受试菌种,对O-苯甲酰壳聚糖的抑真菌作用进行了研究,为壳聚糖类食品防腐剂的开发和分子设计进行了有益的探索。
1 材料与方法
1.1 实验材料
壳聚糖,脱乙酰度(DD)=80%,相对分子质量为3×105为南通双林生物有限公司产品;马铃薯葡萄糖培养基(PDA)、琼脂,生化试剂;苯甲酰氯,甲烷磺酸,丙酮,氨水等均为分析纯为国药集团化学试剂有限公司产品;灰霉病菌Botrytis cinerea,由作者所在的江南大学食品学院微生物实验室提供
1.2 仪器设备
SPX型智能生化培养箱:南京实验仪器厂生产;RW 20 DZM.n机械搅拌器:上海试验仪器有限公司生产;SHB-Ⅲ循环水多用真空泵:郑州长城科工贸有限公司生产;5DDXB FT-IR红外光谱仪、美国Nicolet公司生产;B rucker ARX400核磁共振仪:德国Brucker公司生产。
1.3 实验方法
1.3.1 O-苯甲酰壳聚糖酯的合成 称取干燥的壳聚糖1.7 g,加入25 m L甲烷磺酸,0~5℃不断搅拌30 min。当壳聚糖完全溶解后,逐滴滴加与氨基葡萄糖等摩尔比的苯甲酰氯,剧烈搅拌反应3 h,于-18℃冷冻过夜。反应液在丙酮中沉淀。沉淀在去离子中水溶解,用氨水溶液调节p H值到7.0,沉淀析出。丙酮索氏抽提沉淀24 h,真空干燥,得到淡黄色粉末苯甲酸壳聚糖酶的合成路线,见图1。
1.3.2 产物表征
1)产物的红外光谱 FITR KB r压片法,在波数4 000~400 cm-1范围记录苯甲酰壳聚糖的 FITR图谱。
2)核磁共振光谱1H NMR1H NMR在70℃温度下进行,以 TM S为内标,样品溶解于体积分数2%的DCl D2O溶液。
1.3.3 抑真菌活性的测定
1)菌丝生长测定法[8]将壳聚糖和O-苯甲酰壳聚糖分别溶解于体积分数1%的冰醋酸溶液中,用1 mol/L NaOH调整溶液p H值至5.5~6.0。将上述溶液添加到直径9 cm的灭菌PDA平板培养基中 ,制成浓度 0、0.75、1.50、3.0、6.0 mol/m L含药培养基。在已经培养7 d的B.cinereaPDA培养基的边缘截取直径6 mm供试菌饼移入到含药培养基中心。暗处(26±2)℃培养,每个处理重复4次。待对照组(0 mg/mL)菌落接近长满平板时,用十字交叉法测量菌落直径,并计算抑菌率,公式如下:

图1 苯甲酸壳聚糖酯的合成路线Fig.1 Synthetic route of O-benzoyl-chitosan
I=[(dc-dt)/dt-dp)]×100%
式中,I为抑制率;dc为对照菌落直径;dt为处理菌落直径;dp为菌饼直径
2)抑制率回归方程的建立 以浓度的对数值(X)和抑制率的对数值(Y)建立抑制率回归方程。求出有效中浓度(EC50),其中EC50为抑制率达到50%抑菌剂的浓度。
3)实验数据统计分析 采用统计分析软件SPSS,对实验数据进行统计分析。
2 结果与讨论
2.1 产物的表征
2.1.1 产物的FTIR谱图 壳聚糖与O-苯甲酸壳聚糖的红外光谱见图2。与壳聚糖相比,O-苯甲酰壳聚糖在波数1 730、1 260 cm-1处出现新的吸收峰,可归属为酯键中的C=O键和C—O键的伸缩振动吸收。1 500~1 400 cm-1吸收峰,为取代基苯环的骨架的振动吸收。并且在1 599 cm-1处仍保留了游离—NH2特征吸收峰。综合以上结果,苯甲酰基通过酯化反应被引入到壳聚糖分子中,反应主要在壳聚糖的羟基上进行,C2位的-NH2在反应中得到了很好的保护。
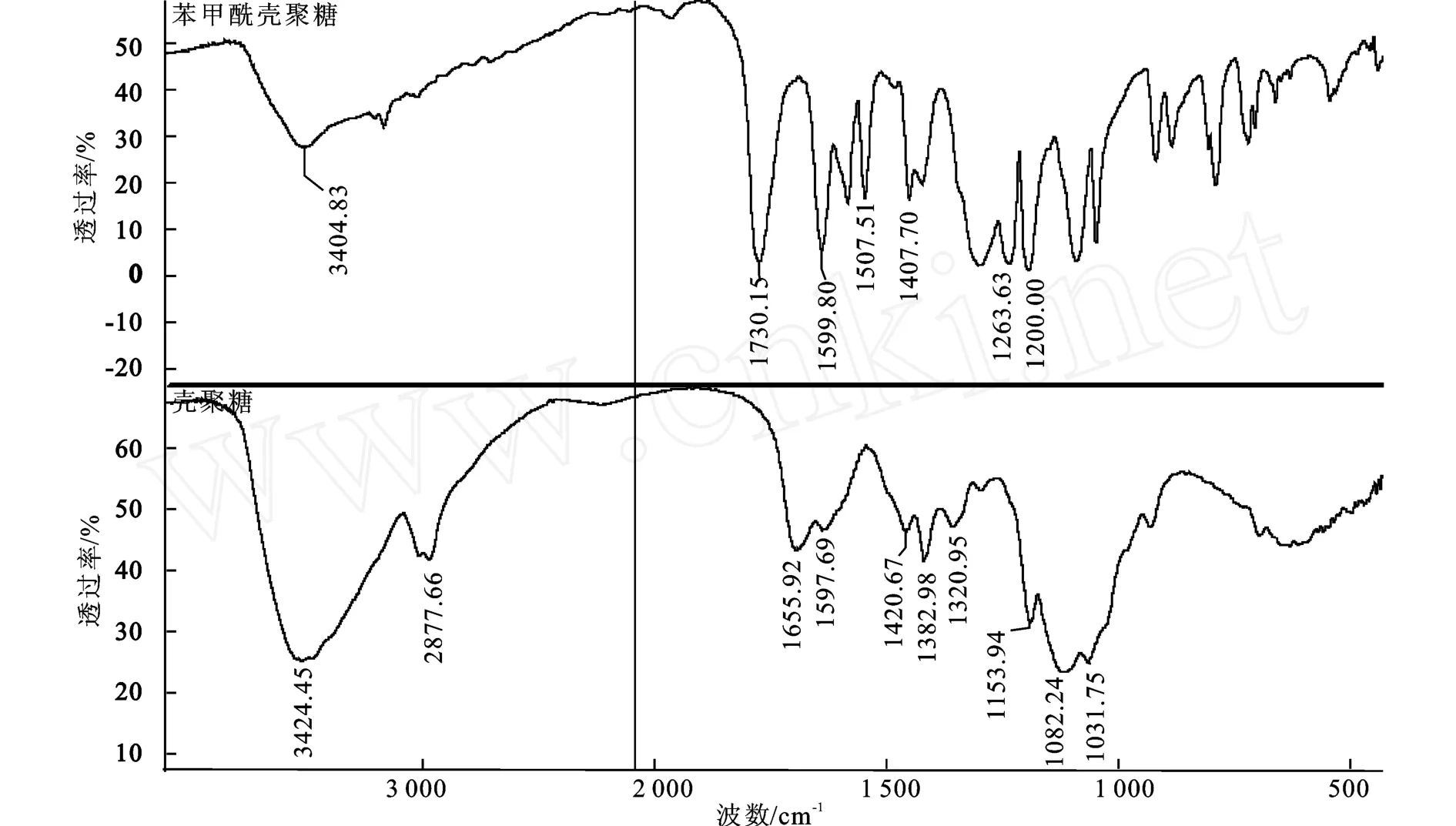
图2 产物的红外图谱Fig.2 FITR spectrum of the synthesized compound
2.1.2 产物的1H-NMR1H-NMR数据δ=2.27×10-6(1.12H)为乙酰基上甲基的化学位移;δ=3.42×10-6(2.41H)为氨氢葡萄糖环上C2位CH的化学位移;δ=3.83~4.29×10-6(14.47H)为乙酰氨基葡萄糖环上C2-C6位CH的化学位移;δ=7.64~8.15×10-6(5.22H)为苯环上的CH的化学位移。
2.1.3 取代度的计算,公式如下
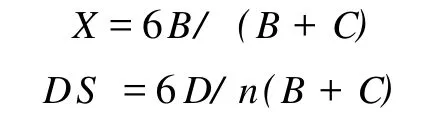
其中,DS为取代度;X为游离氨基比例;B为C2位CH的积分面积;C为乙酰氨基葡萄糖C2-C6位CH的积分面积;D为取代基上各个 H积分面积;n为取代基上氢的个数。
经过计算X=0.81,DS=0.35。游离氨基质量浓度与母体壳聚糖基本一样,说明酯化反应主要发生在羟基,氨基没有参与反应。此前,也有报道选择性合成了O-酰基壳聚糖衍生物O,O-二癸酰壳聚糖和O-琥珀酰壳聚糖[9]。这些衍生物的合成需要邻苯二甲酸酐对氨基进行保护,酯化后在水合肼中脱去氨基保护,得到最终产物,步骤繁琐,产率低。本研究采用的是一步反应法制备O-酰化壳聚糖。在反应中,甲烷磺酸既是溶剂又是催化剂。当在壳聚糖溶解在甲烷磺酸中时,甲烷磺酸会与壳聚糖分子中的氨基形成盐,并同C6位-OH和C3位-OH形成弱酯。此时,壳聚糖分子中的氢键被破坏,分子间距离增大,分子链呈扩张状态,因而在甲烷磺酸中形成均相体系,有利于O-酰化反应的发生,催化效率较高。当体系中加入酰氯后,由于酰氯具有较强的亲电性,进攻弱酯,发生酯交换,从而形成新酯,由于壳聚糖的氨基与甲烷磺酸已成盐,不与酰氯发生反应。反应结束后向体系中加入氨水进行中和,甲烷磺酸与氨水生成的盐溶于水,因此可使平衡移动,使产物的氨基以自由形式存在,得到O-酰化壳聚糖产物。
2.2 O-苯甲酰壳聚糖的抑真菌活性
根根据1.3.3中的方法,得到不同浓度的壳聚糖及O-苯甲酰壳聚糖对B.Cinerer的抑制率,见表1。壳聚糖对B.cinerea具有一定的抑制作用,抑菌活性随着质量浓度的增加而增强。但在低质量浓度时(0.75~1.5 mg/m L)表现出很低的抑菌活性,抑制率不到50%,即使当质量浓度达到6.0 mg/mL时也只能抑制B.cinerea菌丝的生长,而不能完全将其杀死,与Ahmed El Ghaouth的研究成果一致,说明壳聚糖抑真菌的作用有限,这可能与壳聚糖本身就是一些真菌细胞壁的成分有关[9]。通过化学改性将苯甲酸分子引入到壳聚糖分子中,显著提高了壳聚糖在各浓度下的抑真菌活性,O-苯甲酰壳聚糖在较低浓度对B.cinerea菌丝的生长就有比较强的抑制作用,质量浓度达到6.0 m g/m L时,几乎可以完全抑制B.cinerea菌丝的生长。Rabea EI合成了一系列N-苯甲酰壳聚糖的衍生物[10],与O-苯甲酰壳聚糖相比,这些衍生物对真菌的抑制作用并不显著,可能是因为游离氨基被屏蔽的结果。壳聚糖与O-苯甲酰壳聚糖对B.cinerea抑制作用回归方程见表2,通过方程求出了对B.cinerea的EC50分别为1.55和0.27 mg/m L,说明壳聚糖同过苯甲酰化改性后,其抑真菌活性有了显著提高。

表1 壳聚糖与O-苯甲酰壳聚糖对B.cinerea的抑制作用Tab.1 Inhibitive effect of chitosan and O-benzoyl-chitosan on radial growth of B.cinerea

表2 壳聚糖与O-苯甲酰壳聚糖对B.cinerea抑制作用回归方程Tab.2 Regressive equation of chitosan and O-benzoyl-chitosan against B.cinerea
3 结 语
在甲烷磺酸作为催化剂和氨基保护剂的体系中,成功地合成了O-苯甲酰壳聚糖。酰化反应发生在壳聚糖的-OH,C2位的-NH2得到了很好保护,产物平均取代度为0.35。壳聚糖和O-苯甲酰壳聚糖抑制B.cinerea生长的 EC50分别为 1.55和 0.27 mg/mL,表明 O-苯甲酰壳聚糖对灰霉病菌B.cinerea的抑制作用较强,高于其母体壳聚糖。
(References):
[1]Kumar M N V R,Muzzarelli,R A A,Muzzarelli C,et al.(2004).Chitosan chemistry and pharmaceutical perspectives[J].Chemical Reviews,104(12),6017-6084.
[2]ZHOU H Y,Zhang Y P,Zhang W F,et al.Biocompatibility and characteristics of injectable chitosan based thermosensitive hydrogel for drug deliveky[J].Carbohydrate Polymas,2011,83,(4):1643-1651.
[3]Chien PJ,Sheu F,Yang F H.Effectsof edible chitosan coating on quality and shelf life of sliced mango fruit[J].Journal of Food Engineering,2007,78(1),225-229.
[4]Rabea E I,Badaw y M E T,Stevens C V,et al.Chitosan asantimicrobial agent:app lications and mode of a Action[J].Biomacromolecules,2003,4(6),1457-1465.
[5]Badaw y M E I,Rabea E I,Rogge TM,et al.Fungicidal and insecticidal activity of O-acyl chitosan derivatives[J].Polymer Bulletin,2005,54(4-5),279-289.
[6]Xing K,Chen X G,Kong M,et al.Effect of oleoyl-chitosan nanoparticles as a novel antibacterial dispersion system on viability,membrane permeability and cell mo rphology of Escherichia coli and Staphylococcus aureus[J].Carbohydrate Polymers,2009,76(1),17-22.
[7]Ma G,Yang D,Zhou Y,et al.J.Preparation and characterization of water-soluble N-alkylated chitosan[J].Carbohydrate Polymers,2008,74(1),121-126.
[8]Liu H,DU Y M,Wang X H,et al.Chitosan kills bacteria through cell membrane damage[J].International Journal of Food Microbiology,2004,95(2):147-155.
[9]Ahmed E G,Josepn A,A lain A,et al.Antifungal Activity of Chitosan on Two Postharvest Pathogons of Straw berry Fuits[J].Post harvest Pathology and Mycotoxins,1992,82(4):398-402.
[10]Badaw y M E I,Rabea E I,Rogge T M,et al.Synthesis and Fungicidal Activity of New N,O-Acyl Chitosan Derivatives[J].Biomacromolecules,2004,5(2),589-595.
Syn thesis of O-benzoyl-Chitosan and Its An tifungi Activity
FENG Yong-wei1,2, XIA Wen-shui*1,2, SHEN Li-li1,2, ZHAO Yun-jie1,2
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi214122,China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
This study ssing MeSO3H as catalyst and protecting agent to synthesize O-benzoylchitsan by esterification between chitosan and benzoyl chloride.The structure of the product was analyzed by FITR and1H-NM R spectroscopy.The esterification mainly occurred on OH group rather than-NH2group of chitosan.The average degree of substitution(DS)was 0.35.The antifungi activity of O-benzoyl-chitsan against the greymould,Botrytis cinerea was carried out.The result showed that the EC50of chitosan and O-benzoyl-chitosan were 1.55 mg m L-1and 0.27 mg m L-1,respectively.The anti-fungi activity of O-benzoyl-chitosan was much stronger than that of chitosan.
chitosan,O-benzoyl-chitosan,antifungi activity
S 482.2
A
1673-1689(2011)03-0367-04
2010-05-12
国家自然科学基金项目(20876068);国家863计划项目(2007AA 100401);江苏省科技成果转化专项资金项目(BA 2009082)。
冯永巍(1980-),男,吉林长春人,博士研究生,主要从事功能性食品剂的研究。
Email:fywzyy@yahoo.com.cn
*
夏文水(1958-),男,江苏南京人,工学博士,教授,博士研究生导师。主要从事功能食品研究。Email xiaw s@jiangnan.edu.cn
