蓝藻抗病毒蛋白-N基因的克隆、表达、纯化及活性鉴定
2010-02-09陈伟韩波钱垂文刘秋英熊盛
陈伟,韩波,钱垂文,刘秋英,熊盛
暨南大学生物医药研究开发基地 广东省生物工程药物重点实验室 基因工程药物国家工程研究中心,广州 510630
蓝藻抗病毒蛋白-N (CVN) 是一种从蓝藻 (又名蓝细菌Cyanobacteria Nostoc ettipsosporum) 中分离得到的一种水溶性糖蛋白,其独特的抗病毒活性最初是在一项抗人类免疫缺陷病毒 (Human immunodeficiency virus,HIV) 天然药物筛选计划中发现的,后来的研究表明其具有广泛的抗病毒作用[1]。天然CVN相对分子质量为11 kDa,一级结构含有 101个氨基酸残基,无翻译后的修饰,带有 2个内部二硫键。CVN能特异地、高亲合性地结合在人免疫缺陷病毒HIV-1的衣壳蛋白gp120上有效降低HIV-1病毒对细胞的感染,这一特点使它可以不受病毒变异的干扰[2]。此外,CVN具有抗流感病毒、埃博拉病毒、疱疹病毒和丙型肝炎病毒的活性[3-5]。CV-N具有较高的稳定性,即使在很苛刻的物理化学条件下,如在未加缓冲液的情况下反复冻融,甚至沸水浴 (15 min) 都不会影响其结构或生物活性,只有当二硫键被打断、还原或者烷基化时,CV-N的活性才完全丧失[6];这使得CVN蛋白成为一种很有价值的抗病毒药物。
CVN蛋白分子量较小,且分子中有2个二硫键,使得该蛋白在大肠杆菌中表达困难[7]。早在CVN发现之初,CVN的重组表达研究就已经开始,目前已在大肠杆菌、酵母菌和植物细胞中表达成功,但这些重组表达方法存在表达产量低、易形成包涵体且复性困难、易形成无活性的二聚体形式、融合表达出现氨基酸缺失、纯化方法复杂等缺点[7-10]。
小分子泛素样修饰蛋白 (Small ubiquitin-like modifier,SUMO) 和泛素具有类似生物学功能,广泛存在于真核细胞中,发挥着调节蛋白质之间的相互作用 (SUMO化和去SUMO化),调节蛋白在核质间的运输,帮助蛋白质在细胞内正确的定位,调节蛋白质的转录活性以及抗泛素化等作用[11]。SUMO蛋白融合表达系统是一种有效地表达小分子量蛋白的表达方法,具有抗蛋白酶解、增加重组蛋白表达量、促进蛋白正确折叠、能准确无误地切除融合标签、纯化工艺简单等优点[12-14]。本研究利用PCR人工合成CVN的DNA系列,通过分子伴侣SUMO融合CVN基因表达,希望能通过SUMO的助折叠功能实现CVN的可溶性表达。同时还研究了重组蛋白CVN与gp120蛋白的亲和力以及体外抗病毒活性,为进一步研究并得到一种高效的抗病毒药物奠定了基础。
1 材料和方法
1.1 材料
1.1.1 菌种、质粒及细胞系
宿主菌大肠杆菌BL21(DE3)、质粒pET3c由本室保存。质粒pET3c-SUMO由暨南大学医药生物技术研究开发中心黄亚东博士惠赠。单纯疱疹病毒 1 (HSV-1)F株购自武汉大学病毒研究所。Vero细胞、MT-4细胞、HIV-I/IIIB病毒购自美国典型菌种保藏中心 (ATCC)。
1.1.2 主要试剂
Taq酶、T4 DNA连接酶、限制性内切酶NdeⅠ、BamH I购自宝生物 (大连) 有限公司。IPTG、蛋白Marker、引物由上海生工生物工程有限公司合成。Ni Sepharose TM 6 Fast Flow购自Amersham公司。MTT、WST购自Sigma公司。
1.2 方法
1.2.1 PCR合成SUMO-CVN全序列
如图 1所示,通过引物重叠延伸的方法合成SUMO-CVN的全长基因,首先通过多次PCR合成CVN基因,分别以 (F1-CVN、R1-CVN) 为引物对合成A1、以 (F2-CVN、R2-CVN) 为引物对合成A2、以 (F3-CVN、R3-CVN) 为引物对合成 A3、以(F4-CVN、R4-CVN) 为引物对合成A4、以(F4-CVN、R5-CVN)为引物对合成 A5,A5含有 CVN的全长DNA系列。以pET3c-SUMO为模板,F-sumo、R-sumo为引物对,合成的片段记为B,B含有SUMO全长DNA序列。利用B序列末端与A5序列前端的20 bp重叠互补序列,以 B和 A5为模板,(F1-SUMO,R5-CVN)为上下游引物对进行PCR反应,反应产物经1%琼脂糖凝胶电泳检测后,回收DNA片段,得到SUMO-CVN全长DNA序列。
1.2.2 表达质粒的构建及序列分析
将质粒pET3c和SUMO-CVN全长序列分别用Nde I与BamH I进行双酶切,酶切产物进行1%琼脂糖凝胶电泳,回收酶切产物,用T4 DNA连接酶把这两个酶切产物连接起来,构建成重组质粒pET3c-SUMO-CVN。重组质粒转化大肠杆菌 DH5α感受态细胞,PCR及Nde I与BamH I双酶切初步鉴定正确的质粒送上海英骏生物技术有限公司测序。
1.2.3 表达菌株的筛选及诱导表达
测序正确的质粒转化大肠杆菌 BL21(DE3) 感受态细胞,用含氨苄的平板筛选出阳性转化子,挑取单克隆到含氨苄的LB培养基中,37℃培养12 h。然后按1%比例接种到含氨苄的新鲜LB培养基试管中,37℃、180 r/min培养至OD600=0.6~1.0。加IPTG至终浓度0.5 mmol/L,在20℃下诱导20 h,离心收集菌体,进行12%的SDS-PAGE分析,选择目的蛋白高表达的单克隆进行菌株保存。
1.2.4 SUMO-CVN融合蛋白摇瓶发酵及纯化
选取高表达菌株接种到1 L含氨苄 (100 mg/L)的 LB 培养基中,按 1.2.3节中的条件,诱导 20 h后,4℃、6000×g离心10 min收集菌体,−80℃冻融1次,然后将菌体沉淀以1∶10比例重新悬浮于结合缓冲液 (20 mmol/L Tris-HCl,pH 8.0,0.5 mol/L NaCl,10 mmol/L 咪唑),超声破碎,4℃、25 000×g离心30 min收集上清和沉淀,12%的SDS-PAGE对SUMO-CVN表达蛋白的可溶性进行分析。
1.2.5 CVN蛋白纯化及鉴定
用结合缓冲液平衡Ni-NTA树脂,上完样后用洗脱缓冲液 (20 mmol/L Tris-HCl,pH 8.0,0.5 mol/L NaCl,40 mmol/L 咪唑) 进行洗脱,最后用洗脱缓冲液 (20 mmol/L Tris-HCl,pH 8.0,0.5 mol/L NaCl,200 mmol/L 咪唑) 进行目的蛋白SUMO-CVN的洗脱。融合蛋白SUMO-CVN经Sephadex G-25分子筛脱咪唑,蛋白调整浓度至1 mg/mL,加入1 U SUMO蛋白酶/mg融合蛋白,在酶切缓冲液 (20 mmol/L Tris-HCl,pH 8.0,2% Igepal,1.5 mol/L NaCl,10 mmol/L DTT) 中30℃酶切1 h。因SUMO、SUMO蛋白酶均含有6×His标签,酶切后的样品再经 Ni-NTA亲和层析除去SUMO、未酶切的SUMO-CVN和SUMO蛋白酶后得到目的蛋白CVN。
1.2.6 CVN精确分子量的测定
重组蛋白 CVN脱盐后送暨南大学生命与健康工程研究院,用基质辅助激光解吸电离飞行时间质谱 (MALDI-TOF-MS) 测定其分子量。
1.2.7 gp120蛋白结合实验
用ELISA方法分析SUMO-CVN和CVN与gp120蛋白的结合能力,gp120蛋白用包被缓冲液(0.05 mol/L Na2CO3,0.05 mol/L NaHCO3,pH 9.6) 溶解,96孔板酶标板中每孔加入100 µL gp120蛋白溶液,4℃包被过夜。用PBST (0.1% Tween20的PBS)洗板3次,再每孔加入100 µL含15%牛血清的PBST于37℃封闭2 h。PBST洗板3次之后,每孔加入100 µL的10倍系列稀释的待检测的蛋白样品,样品浓度从10−6µg/mL至100 µg/mL,每个浓度做3个复孔;同时BSA作为阴性对照,37℃孵育2 h。PBST洗板3次之后,每孔加入100 µL CVN的多克隆抗体(1∶4000稀释),37℃孵育2 h。PBST洗板3次之后,每孔加入 100 µL辣根过氧化物酶标记的羊抗兔 Ig的单克隆抗体,37℃孵育2 h。PBST洗板3次之后TMB显色,2 mol/L H2SO4终止显色,450 nm测定吸光值。
1.2.8 重组 CVN蛋白抗疱疹病毒活性测定
单层Vero细胞中,加入不同稀释度的蛋白样品,5% CO2培养48 h,每孔加入5 mg/mL MTT 10 µL,5% CO2继续培养4 h,弃上清液,每孔加入200 µL DMSO,室温避光放置30 min,振摇培养板10 min左右,酶标读数仪比色 (波长 570 nm,参比波长630 nm),测定吸光度并计算样品的半数毒性浓度(50% cytotoxic concentration,CC50)。
单层Vero细胞中,加入不同稀释度的蛋白样品和100 TCID50的HSV-1病毒液各50 µL,同时设正常细胞对照及病毒对照组,CPE法观察药物对细胞的活性。
1.2.9 WST-1法测定重组CVN蛋白抗HIV-1活性
在P3生物安全柜中,重组CVN用含10% FBS 的 RPMI 1640培养液稀释至 50 µg/mL (4.53 µmol/L)、10 µg/mL (0.91 µmol/L)、2 µg/mL (180 nmol/L) 和0.4 µg/mL (36 nmol/L),共4个浓度梯度;收集培养至对数生长期的MT-4细胞,计数细胞总数和活细胞数,用含10% FBS的RPMI 1640培养液调整细胞浓度至1×105cell/mL;取100 µL细胞悬液至96孔板中,加入100 TCID50的HIV-1/IIIB病毒 (50 µL/孔),再加入预先稀释好的不同浓度CVN样品 (50 µL/孔),每个样品平行设置4个复孔,同时设空白对照、细胞对照、病毒对照和阳性对照(AZT,63 nmol/L) 各4个复孔;37℃,5% CO2培养箱中培养96 h后,加入10 µL/孔 WST-1 (5 mmol/L)溶液,37℃孵育4 h,450 nm测定吸光值。毒性测定与抑制率测定方法相同,但各培养板孔中只加细胞和待测样品,不加病毒。计算公式:抑制率 (IR) = (As−Av)/(Ac−Av);As:样品吸光值均值;Av:病毒对照组吸光值均值;Ac:细胞对照组吸光值均值。
2 结果
2.1 SUMO-CVN的DNA序列的合成及表达载体的构建
利用PCR方法,分别合成DNA片段A1 (97 bp)、A2 (173 bp)、A3 (241 bp)、A4 (298 bp)、A5 (360 bp)和B (345 bp)。A5含有CVN的DNA全序列,B含 SUMO的DNA全序列,利用A5和B之间20 bp的重叠互补序列合成SUMO-CVN的全长DNA序列(642 bp),其大小与预期一致 (图2)。所构建的含表达质粒pET-3c-SUMO-CVN的DH5α经菌落PCR鉴定 (图 3),送阳性克隆去测序,结果表明,其序列与预期一致。
2.2 SUMO-CVN表达蛋白的摇瓶发酵及可溶性分析
将诱导前、诱导后、菌体裂解后的沉淀和菌体裂解后的上清等样品进行 SDS-PAGE。结果表明,BL21(DE3)/pET-SUMO-L-CVN阳性克隆菌株经诱导后会表达大小约为28 kDa的融合蛋白,未诱导对照无明显表达,表达量占菌体总蛋白的28%,且融合蛋白多数位于上清中,是可溶性表达 (图4)。
2.3 CVN蛋白的纯化及鉴定

图2 PCR合成SUMO-CVN的DNA系列Fig. 2 PCR artificial synthesis the whole target DNA sequence of SUMO-CVN. M: DNA marker; 1: A1; 2: A2; 3: A3; 4: A4; 5: A5; 6: B; 7: SUMO-CVN.
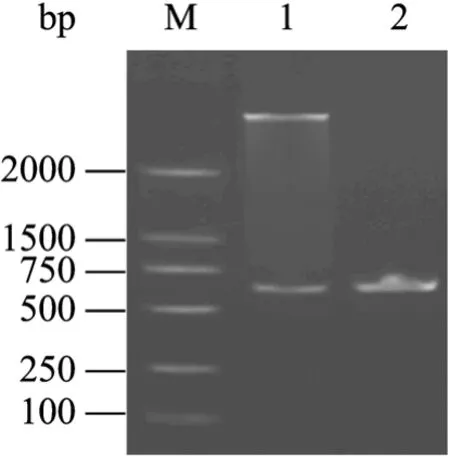
图3 重组PET-SUMO-L-CVN质粒限制酶和PCR分析Fig. 3 Restriction and PCR analysis of recombinant plasmid pET-SUMO-CVN. M: DNA marker; 1: pET-SUMO-L-CVN/ Nde I+BamH I; 2: PCR product of random clone.
取上清进行 Ni-NTA树脂亲和纯化,纯化后的目的蛋白经 Sephadex G-25分子筛脱咪唑后进行SUMO蛋白酶酶切,除去SUMO融合蛋白。酶切产物的SDS-PAGE电泳分析表明,30℃,1 h条件下80%的融合蛋白可以被酶切开。酶切产物再次用Ni-NTA亲和层析柱进行纯化得到目的蛋白 CVN,SDSPAGE电泳分析 (图5) 表明纯化的CVN蛋白纯度较高。基质辅助激光解吸/电离飞行时间质谱 (MALDITOF-MS) 测定重组蛋白的分子量,CVN分子量测定结果为11 019.87 Da (图6),与天然CVN蛋白理论分子量11 013.16 Da相差5 Da,在合理误差范围内。
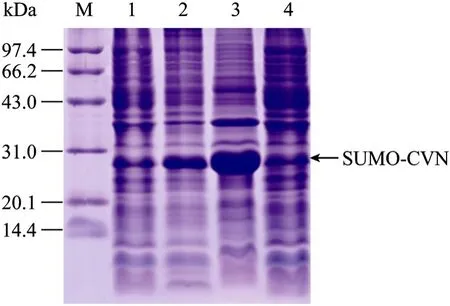
图4 SUMO-CVN的可溶性分析Fig. 4 Solubility analysis of SUMO-CVN. M: protein marker. 1: uninduced sample; 2: protein of BL21 (DE3)/pET-3c-SUMO-CVN after induced with IPTG; 3: induced recombinant BL21 supernatant; 4: induced recombinant BL21 precipitation.
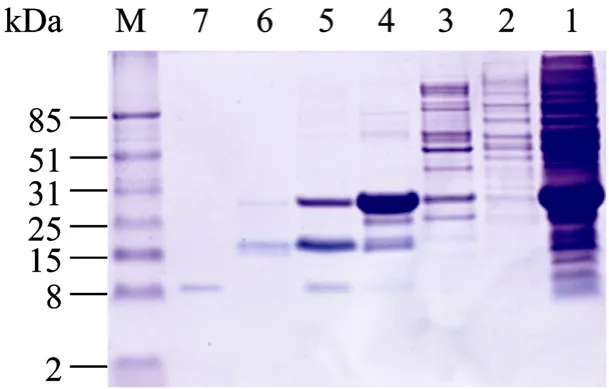
图5 SDS-PAGE分析重组蛋白CVN的纯化Fig. 5 SDS-PAGE analysis of the purified CVN. M: protein marker; 1: the supernatant of cells; 2: the fractions of penetration; 3: the eluted fractions with 40 mmol/L imidazole; 4: the eluted fractions with 200 mmol/L imidazole; 5: the eluted fractions of G-25 chromatography; 6: SUMO protease cleaved mixture; 7: the eluted fractions of the second Ni-NTA chromatography.
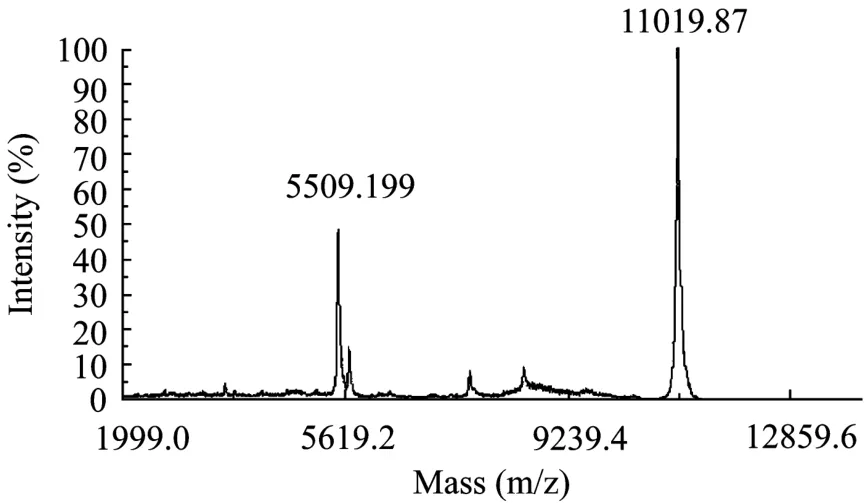
图6 MATOL-TOF MS测定重组蛋白CVN的分子量Fig. 6 Molecular weight of rCVN determined by matrixassisted laser desorption ionization coupled to a time of flight mass spectrometry (MALDI-TOF MS).
2.4 重组蛋白抗HSV活性分析
图7是一次典型实验后细胞在相差显微镜下的形态,可见病毒对细胞所致的细胞病变效应,以及药物对细胞的保护效应。结果表明,重组CVN具有良好的抗HSV-1活性,摩尔浓度更低的条件下,CVN表现出与阳性对照药物 ACV基本接近的抗病毒活性。未酶切过的 SUMO-CVN同样具有抗单纯疱疹病毒I型活性,但其活性要低于CVN蛋白,推测可能是由于多余的肽段影响了CVN蛋白的活性位点。毒性测定结果表明,SUMO-CVN和CVN对Vero细胞的毒性明显低于ACV (表2)。
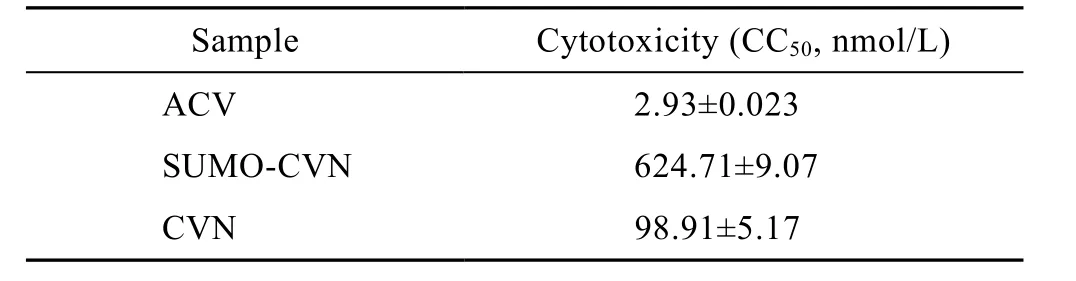
表2 MTT法测定样品抗HSV-1活性结果Table 2 Cytotoxicity to vero cells of native rCVN
2.5 CVN与gp120蛋白的亲和力
ELISA实验分析重组蛋白与gp120蛋白的结合力,结果表明,无论是融合蛋白还是CVN与gp120蛋白都有较高的亲和力,并且呈现出一定的浓度依赖性 (图8)。
2.6 重组蛋白CVN抗HIV活性结果
病毒对MT-4细胞所致的病变效应,以及CVN对MT-4细胞的保护效应如图9所示。WST-1实验表明,CVN具有明显抑制HIV-1/IIIB的活性,在浓度为10 µg/mL (0.91 µmol/L) 时,抑制率为73%,细胞密度为无病毒细胞对照组的95%,与阳性药物AZT的抑制率和毒性相当 (74%和101%),为高效低毒抗病毒物质。
3 讨论
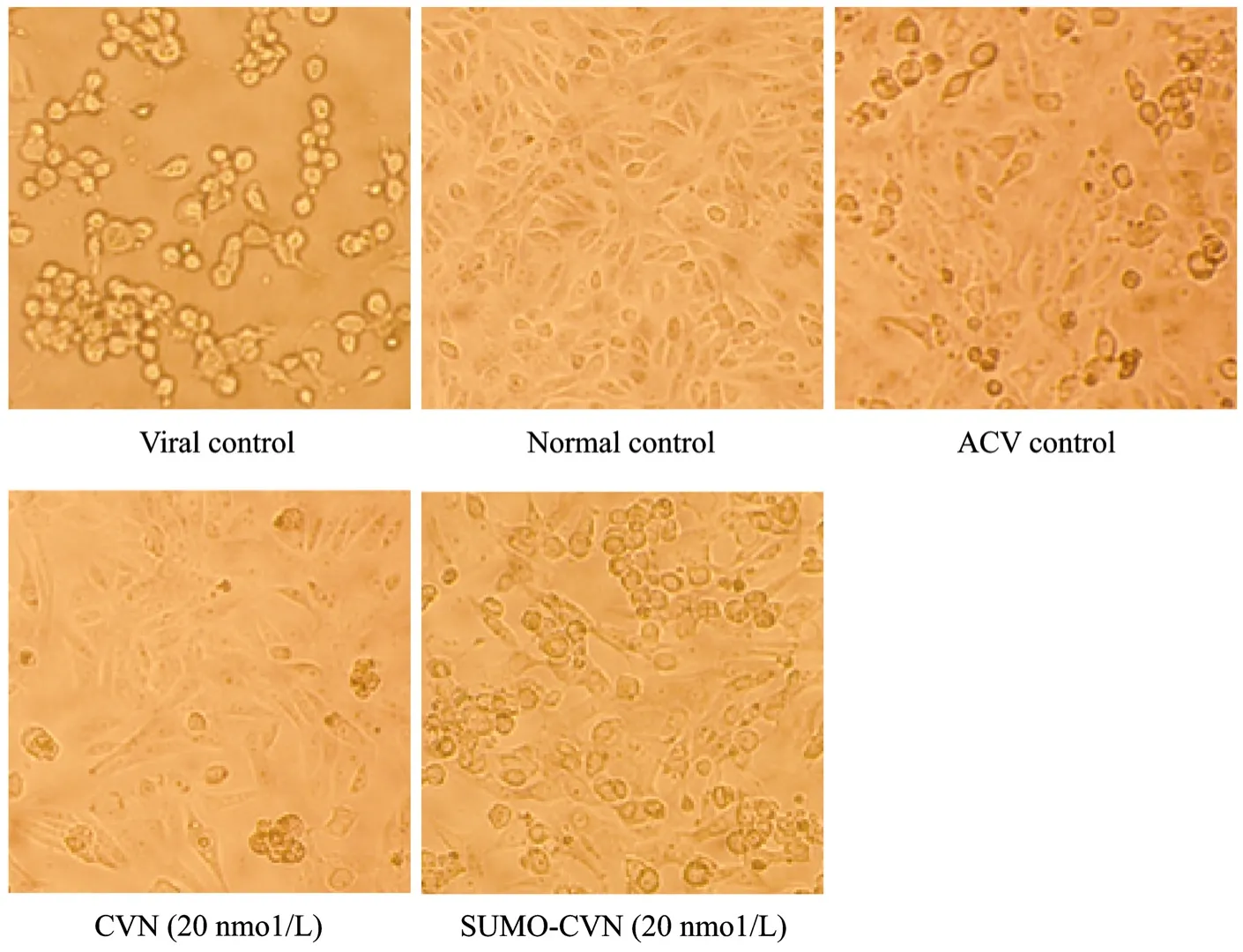
图7 重组蛋白抗HSV-1的细胞病变观察结果Fig. 7 Cytopathic effect of vero cells.
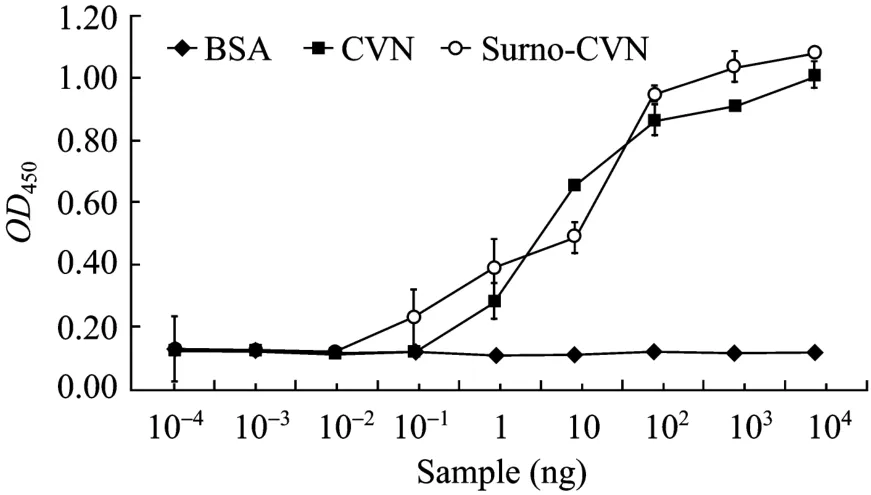
图8 ELISA分析重组蛋白与gp120的亲和力Fig. 8 Recombinant protien binding to gp120 by ELISA.
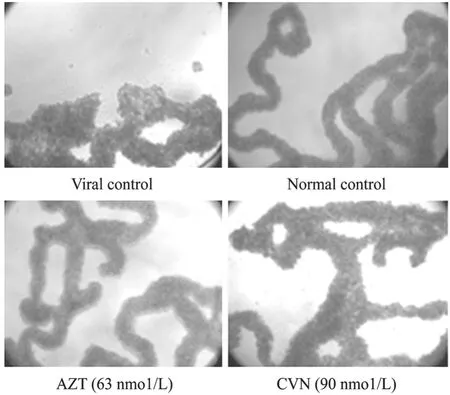
图9 重组蛋白抗HIV-1/IIIB的细胞病变观察结果Fig. 9 Cytopathic effect of MT-4 cells.
CV-N能特异地、高亲和性地结合在人免疫缺陷病毒 HIV-I的衣壳蛋白 gp120上从而发挥抗病毒活性,这一特点使它可以不受病毒变异的干扰,同时它还具有抗病毒谱广、性质稳定等特点,这使得CV-N蛋白成为一种很有价值的抗病毒药物。但因为该蛋白分子量较小,且分子中有2个二硫键,此外,其与目前已知的蛋白的系列相似性不超过20%,使得该蛋白在大肠杆菌中表达困难[15]。Boyd等人工合成了CV-N序列,经PCR扩增后克隆于pFLAG质粒上,构建成分泌型表达载体,并在E. coli中诱导表达成功;但该表达产物是一系列完整蛋白、缺失N端前2个残基的蛋白和含有ompA信号肽序列的蛋白的混合物,纯化极为困难,且活性较低[1]。Mori等用pelB 信号肽序列替换ompA,并在pET26b(+)载体中表达成功,ESIMS分析和N端的序列测定证明与天然CV-N的结构相同,并且具有抗HIV活性,但该表达重组蛋白的方法产量较低,每升高密度培养产物最高只能纯化得到10 mg目的蛋白,无法满足大规模生产的需要[16]。此外,吕锐等[17]和刘玉生等[18]都在大肠杆菌中成功表达了CVN蛋白,但都是以包涵体形式表达的,纯化过程复杂。本实验室先前构建了pET3c-CVN的表达载体转化到BL21中,经过诱导之后,发现CVN蛋白没有表达。因此,希望通过SUMO分子伴侣与CVN基因融合,以促进CVN的表达。本实验将CVN与SUMO融合后,表达量明显提高;并且主要是以可溶的形式表达的,纯化后的CVN蛋白的纯度较高,克服了其他表达方法产量低、易形成包涵体、纯化困难等缺点,为今后开展产业化生产奠定了基础。
体外抗病毒活性实验中,融合蛋白SUMO-CVN和 CVN蛋白均具有良好的抗 HSV-1活性,但是SUMO-CVN抗HSV-1活性要弱于CVN,推测可能由于多余的肽段影响了CVN蛋白抗HSV-1的活性位点。重组蛋白CVN与gp120蛋白有较高的亲和力,从理论上说明了CVN具有抑制HIV病毒感染的活性。另外,WST-1实验也证明,重组蛋白CVN也具有明显的抑制 HIV-1/IIIB活性,为高效低毒抗病毒物质。
致谢:感谢日本长崎大学药学部感染分子药学研究室郭朝万博士、北里海雄准教授协助进行HIV-1/IIIB活性测定。
REFERENCES
[1] Boyd MR, Gustafson KR, McMahon JB, et al. Discovery of cyanovirin-N, a novel human immunodeficiency virusinactivating protein that binds viral surface envelope glycoprotein gp120: potential applications to microbicide development. Antimicrob Agents Chemother, 1997, 41: 1521−1530.
[2] Yang F, Bewley CA, Louis JM, et al. Crystal structure of cyanovirin-N, a potent HIV-inactivating protein, shows unexpected domain swapping. J Mol Biol, 1999, 288(3): 403−412.
[3] Helle F, Wychowski C, Vu-Dac N, et al. Cyanovirin-N inhibits hepatitis C virus entry by binding to envelope protein glycans. J Biol Chem, 2006, 281(35): 25177−25183.
[4] Smee DF, Wandersee MK, Checketts MB, et al. Influenza A (H1N1) virus resistance to cyanovirin-N arises naturally during adaptation to mice and by passage in cell culture in the presence of the inhibitor. Antivir Chem Chemother, 2007, 18(6): 317−327.
[5] Barrientos LG, Gronenborn AM. The highly specific carbohydrate-binding protein cyanovirin-N: structure, anti-HIV/Ebola activity and possibilities for therapy. Mini Rev Med Chem, 2005, 5(1): 21−31.
[6] Barrientos LG, Louis JM, Ratner DM, et al. Solution structure of a circular-permuted variant of the potent HIV-inactivati-ng protein cyanovirin-N: structural basis for protein stability and oligosaccharide interaction. J Mol Biol, 2003, 325(1): 211−223.
[7] Sexton A, Drake PM, Mahmood N, et al. Transgenic plant production of cyanovirin-N, an HIV microbicide. FASEB J, 2006, 20: 356−358.
[8] Mori T, Gustafson KR, Pannell LK, et al. Recombinant production of cyanovirin-N, a potent human immunodeficiency virus-inactivating protein derived from a cultured cyanobacterium. Protein Express Purif, 1998, 12 (2): 151−158.
[9] Mori T, Barrientos LG, Han Z, et al. Functional homologs of cyanovirin-N amenable to mass production in prokaryotic and eukaryotic hosts. Protein Express Purif, 2002, 26(1): 42−49.
[10] Colleluori DM, Tien D, Kang F, et al. Expression, purification, and characterization of recombinant cyanovirin-N for vaginal anti-HIV microbicide development. Protein Express Purif, 2005, 39(2): 229−236.
[11] Zhou F, Xue Y, Lu H, et al. A genome-wide analysis of sumoylation-related biological processes and functions in human nucleus. FEBS Lett, 2005, 579(16): 3369−3375.
[12] Xiao YC, Qin YX, Xie JS. Fusion protein on Sumo molecular chaperone and antifungal peptide Drs help to soluble expression. Chin Biotech, 2007, 27(12): 22−25.肖业臣, 秦玉侠, 解佳森, 等. Sumo分子伴侣与富含二硫键的抗真菌肽 Drs基因的融合有助于其可溶性表达.中国生物工程杂志, 2007, 27(12): 22−25.
[13] Assadi-Porter FM, Patry S, Markley JL. Efficient and rapid protein expression and purification of small high disulfide containing sweet protein. brazzein in E. coli. Protein Express Purif, 2008, 58(2): 263−268.
[14] Huang YD, Su Y, Ding CC, et al. The expression, purification and its activity of Gst-Sumo-Mt in E. coli. Chin Biotech, 2007, 27(12): 11−16.黄亚东, 苏烨, 丁长才, 等. 融和蛋白 Gst-Sumo-Mt在大肠杆菌中的表达、纯化及其活性研究. 中国生物工程杂志, 2007, 27(12): 11−16.
[15] Gustafson KR, Sowder RC, Henderson LE, et al. Isolation, primary sequence determination, and disulfide bond structure of cyanovirin-N, an anti-HIV (human immunodeficiency virus) protein from the cyanobacterium nostocellipsosporum. Biochem Biophys Res Commun, 1997, 238(1): 223−228.
[16] Mori T, Gustafson KR, Pannell LK, et al. Recombinant production of cyanovirin-N, a potent human immunodeficiency virus inactivating protein derived from a cultured Cyanobacterium. Protein Express Purif, 1998, 12(2): 151–158.
[17] Lü R, Yu H, Liu ZT, et al. Prokaryotic expression of Cyanovirin-N gene and the purification and renaturation of its re-combinat protein. J Med Postgrad, 2007, 20(11): 1139−1142.吕锐, 于红, 刘宗涛, 等. 蓝藻抗病毒蛋白 N基因的原核表达及重组蛋白的纯化和复性. 医学研究生学报, 2007, 20(11): 1139−1142.
[18] Liu YS, Li C, Jin NY, et al. Construction and prokaryotic expression of a new antiviral protein. Immunol J, 23(4): 395–398.刘玉生, 李昌, 金宁一, 等. 新型抗病毒蛋白CVN的构建及原核表达. 免疫学杂志, 2007, 23(4): 395−398.
