末端限制性片段长度多态性技术分析硝化细菌微生物多样性
2010-02-09林炜铁朱雅楠
林炜铁,朱雅楠
华南理工大学生物科学与工程学院,广州 510006
末端限制性片段长度多态性技术分析硝化细菌微生物多样性
林炜铁,朱雅楠
华南理工大学生物科学与工程学院,广州 510006
利用T_RFLP (末端限制性片段长度多态性) 技术,分析硝化细菌富集反应器中的微生物群落结构,并对硝化细菌的丰度进行半定量研究。结果表明,培养48 h后,硝化细菌富集效果最佳,多样性指数与初始培养相比下降了62.80%,富集出的硝化细菌主要为亚硝酸盐氧化菌 (Nitrobacter)。同时对投加该硝化细菌前后的对虾养殖水体进行微生物多样性的动态研究,并推测了虾塘水中可能稳定存在的几种主要细菌种类,其中投加富集硝化细菌前后均存在的细菌种类包括短芽孢杆菌Brevibacillus brevis、微杆菌Microbacterium lactium、固氮弧菌Azoarcus indigens或者霍氏鲍特菌Bordetella holmesii。
T_RFLP,硝化细菌,反应器,群落结构,微生物多样性
T_RFLP技术是一种以分子系统学原理为基础的研究微生物种群多样性的现代分子生物学技术[5],在DNA水平上通过对特定核酸片段长度多态性的测定来分析比较硝化细菌培养器内微生物群落结构[6],本研究利用 T_RFLP技术,对富集反应器内硝化细菌进行活性检测,并对反应器内微生物群落的种群结构和多样性进行解析并研究其动态变化,从而更好地把握硝化细菌的增殖情况,解决收货菌种的时间问题,提高产业化效率。同时对投加该硝化细菌的对虾养殖水体进行微生物多样性研究。
1 材料与方法
1.1 采样
本实验采用的硝化细菌在养殖虾塘水中驯化2年后分离纯化得到,亚硝酸盐降解速率为580.7 mg/(g·d),培养温度为28℃~30℃。硝化细菌富集装置为10 L气升式反应器,通气量为100 L/h,培养基组成如下:NaNO20.5 g/L,KH2PO40.136 g/L,MgSO40.14 g/L,NaCl 0.3 g/L,NaHCO31.6 g/L,FeSO40.03 g/L,采用分批式补料方式,即每天补加NaNO2,每周更换1次培养基,在此条件下检测出硝化细菌样品生长的迟滞期、对数期、稳定期3个具有生长代表性的时期,分别为培养12 h、24 h、48 h。虾塘选择深度为1米,面积3亩的对虾养殖塘,在此塘中投加5 L OD600为40的硝化细菌。取3个生长代表期的硝化细菌富集培养液及投加硝化细菌前和投加硝化细菌后的对虾养殖水体水样各1 L,置于4℃冰箱中保存待用。投加硝化细菌后的水塘取样时间参照硝化细菌富集丰度最佳时间。
1.2 实验方法
1.2.1 细菌总DNA提取
DNA的提取采用液氮研磨法:将水样取出,抽滤后将细菌粉末连续加入液氮中,快速研磨。用DNA提取试剂盒提取研磨后菌体中的总 DNA,并于−20℃保存。
1.2.2 16S rDNA的PCR扩增
引物设计:参考Fe´ray 等于1999年发表的硝化细菌 16S rDNA通用序列[7](FGPS1269,5′-TTT TTTGAGATTTGCTAG-3′;FGPS872,5′-CTAAAACT CAAAGGAATTGA-3′)。参考Leser等于2000年发表的细菌16S rDNA通用序列[8](8-27F,5′-AGAGTT TGATCCTGGCTCAG-3′;SD-BACT-0926,5′-CCGTC AATTCCTTTRAGTTT-3′)。引物的5′末端用6-FAM荧光标记。引物由大连宝生物公司合成。
PCR反应体系:利用1.2.1中的DNA提取物作为模板。PCR反应总体系为50 µL,内含5 µL 10×PCR Buffer,4 µL dNTPs,上下游引物各0.2 µL,0.2 µL模板DNA,0.25 µL Taq酶 (TaKaRa公司)。
反应条件:使用NOB引物,预变性95 ℃ 3 min ;变性94 ℃ 1 min ,退火50 ℃ 1 min ,延伸72 ℃ 2 min,35个循环;最终72℃延伸5 min。使用细菌通用引物[9]:预变性95 ℃ 3 min;变性94℃ 30 s,退火57℃45 s,延伸72 ℃ 2 min,30个循环;最终72℃延伸4 min。反应后,均置于−20℃保存。
1.2.3 PCR反应结果检测
取5 µL PCR扩增产物进行0.8%琼脂糖凝电泳,溴化乙锭染色,紫外灯下观察拍照。
1.2.4 16S rDNA扩增产物的酶切
利用限制性内切酶Hae Ⅲ酶切PCR扩增得到的16S rDNA产物,反应总体系为20 µL,内含10倍缓冲液2 µL,PCR产物10 µL,灭菌水6.5 µL,内切酶Hae Ⅲ 1.5 µL。酶切产物的T_RFLP分析由上海基康公司完成。
1.2.5 T_RFLP图谱分析
根据 T_RFLP图谱,对反应器内硝化细菌的丰度进行半定量检测,并对其纯度进行分析。同时,通过登陆网站 http://mica.ibest.uidaho.edu/,选择T_RFLP分析程序对样品中出现的限制性片段(Terminal Rest riction Fragment,T_RF) 进行定性分析,每一个T_RF为一个操作分类单元 (Operational taxonomy unit,OTU),通过提交T_RFLP检测结果数据文件以及规定限制性内切酶Hae Ⅲ,确定其中可能含有的微生物属性,分析样品中的微生物多样性。
1.3 多样性指数计算方法
根据Hae Ⅲ酶切得到的T_RFLP图谱中T_RF (末端限制性片段数目) 及其相对峰高值,分别计算了样品中不同培养时期的硝化细菌的多样性指数和均匀度指数。多样性指数和均匀度指数的计算公式为:
均匀度指数:E1=H′/1nS
2 结果与讨论
2.1 细菌总DNA的提取
富集硝化细菌培养液中提取的 DNA代表了富集培养液中所有微生物的总 DNA组成。提取的总DNA经0.8%琼脂糖凝胶电泳后,在大于19 000 bp处有一条明显扩增条带,如图1所示。
2.2 16S rDNA PCR
以提取的总DNA为模板,利用NOB引物扩增16S rDNA,在397 bp有明显的特异性扩增条带,与引物序列拟扩增的DNA序列大小一致,如图2所示。
2.3 基于T_RFLP技术的微生物多样性分析
2.3.1 基于T_RFLP技术的硝化细菌反应器内微生物多样性分析
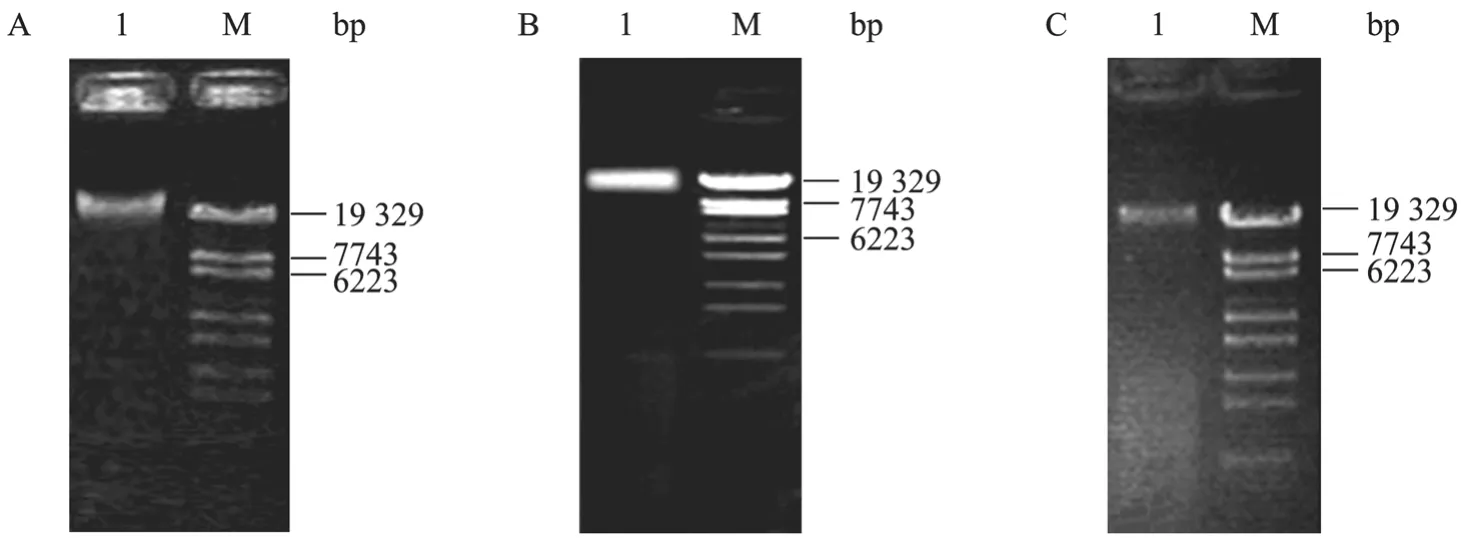
图1 富集硝化细菌培养液细菌总DNAFig. 1 DNA in the enrichment reactor. (A) Sample 1 was the DNA extracted from enrichment reactor after cultured for 12 hours. (B) Sample 1 was the DNA extracted from enrichment reactor after cultured for 24 hours. (C) Sample 1 was the DNA extracted from enrichment reactor after cultured for 48 hours.
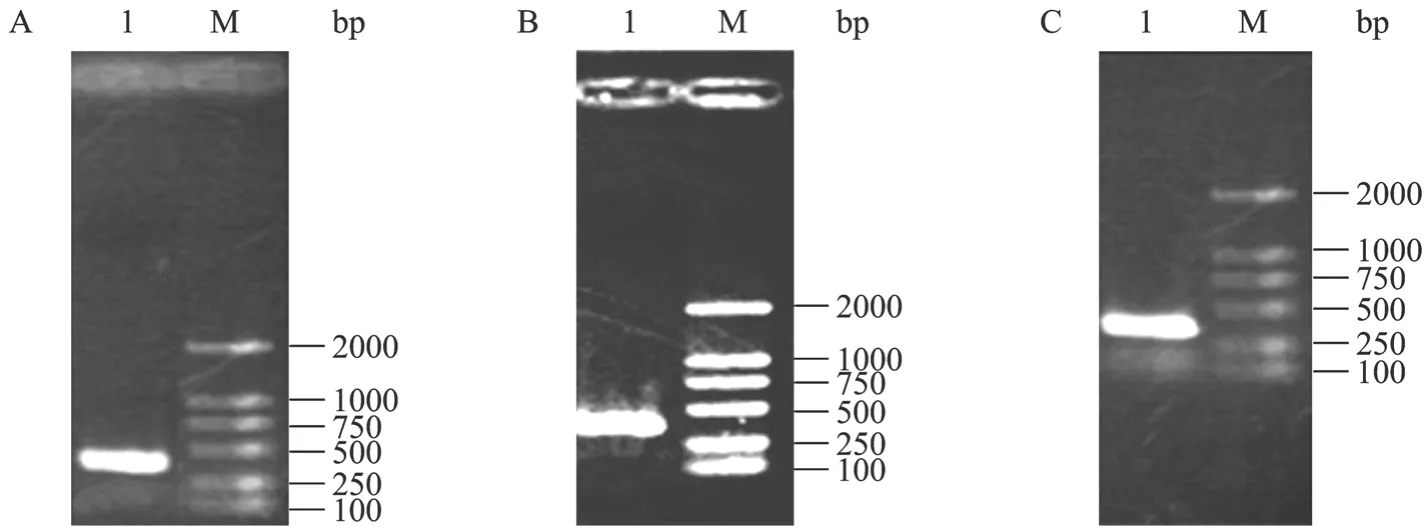
图2 基于NOB 16S rDNA的PCR扩增电泳图Fig. 2 PCR amplifications based on 16S rDNA of NOB. (A) Sample 1 was the PCR amplifications after cultured for 12 hours. (B) Sample 1 was the PCR amplifications after cultured for 24 hours. (C) Sample 1 was the PCR amplifications after cultured for 48 hours.
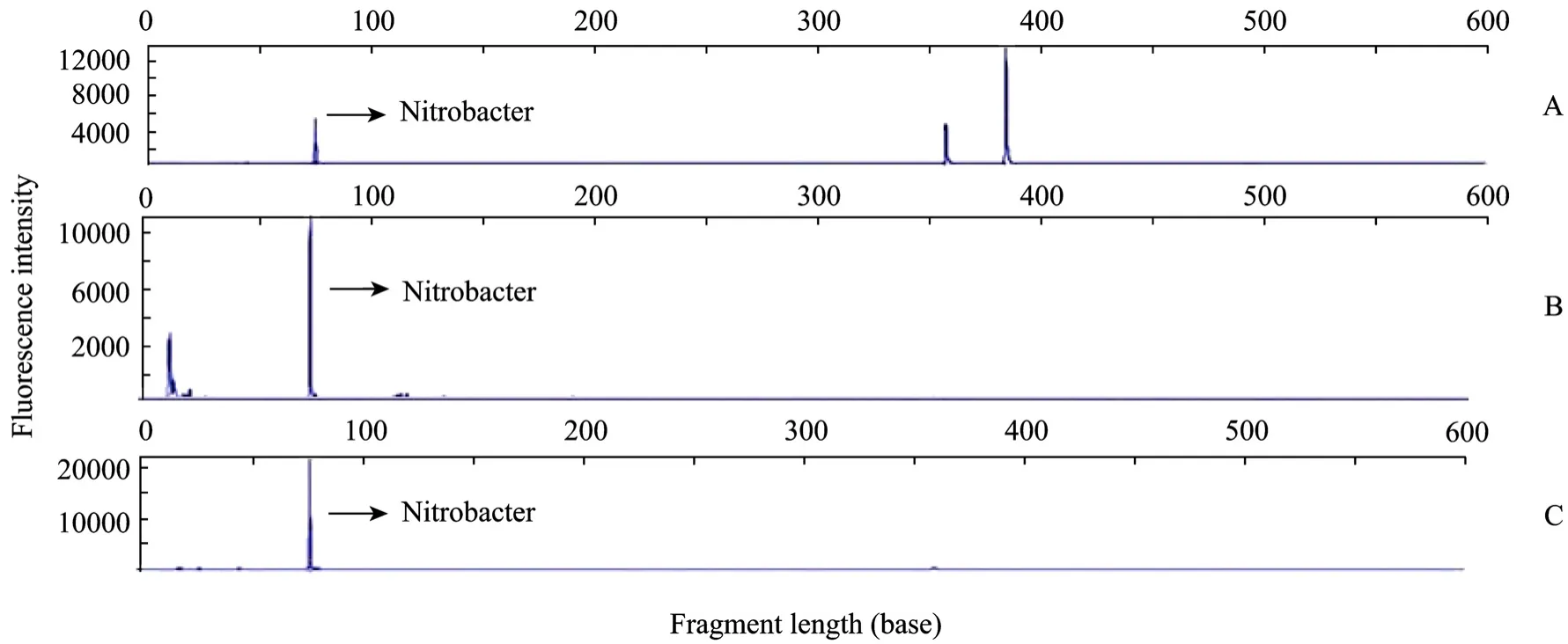
图3 NOB通用引物对不同时间细菌DNA样品进行PCR,并用Hae Ⅲ 酶切后的T_RFLP图谱Fig. 3 T_RFLP profiles based on bacteria16S rDNA with NOB primer at a different operating times. (A) Hae Ⅲ- digesting T_RFLP profiles for bacteria after cultured for 12 hours. (B) Hae Ⅲ-digesting T_RFLP profiles for bacteria after cultured for 24 hours. (C) Hae Ⅲ-digesting T_RFLP profiles for bacteria after cultured for 48 hours.
从硝化细菌反应器内提取的总 DNA的片段长度为19 000 bp,利用NOB扩增引物扩增出的16S rDNA片段大小为397 bp,符合预期的长度。图3是用自动测序仪扫描16S rDNA的Hae Ⅲ酶切图谱。图谱上每个荧光峰至少代表 1种细菌或几种近缘的细菌,每个峰面积占总峰面积的百分数代表某种类的微生物在该微生态群落中的相对数量。图 3为培养12 h、24 h、48 h后,富集培养箱中硝化细菌的T_RFLP检测结果。其中片段36 bp代表Nitrobacter,即亚硝酸盐氧化菌硝化杆菌属,与Wen等[10]在流化反应器中对 NOB的菌种检测中发现存在硝化杆菌和硝化螺菌的结果稍有不同,可能是由于不同的反应器系统造成的检测结果不同。本实验利用NOB通用引物,对反应器中的硝化细菌进行检测,并且根据 OTU数量,对硝化细菌样品中的多样性指数(Shannon Diversity,H′) 及均匀度指数 (Shannon Diversity,E′) 进行计算,结果见表1。
从不同时期硝化细菌反应器内的硝化细菌的OTU数量可以看出,随着培养时间的增加,OTU减少,由此推断出反应器内占绝对优势的微生物种类减少;从硝化细菌的微生物多样性指数 (Shannon Diversity,H′) 看出,随着时间的增加,硝化细菌的种类趋于减少,尤其是当取培养48 h的硝化细菌进入稳定期时,多样性指数更是下降了62.80%,由此可见,反应器内硝化细菌的培养纯度逐渐增加。并且通过比较此时反应器内硝化细菌的菌体数量,发现培养48 h的硝化细菌的丰度比例达到97%,明显高于培养12 h以及培养24 h的硝化细菌丰度比例(表2)。
2.3.2 基于T_RFLP技术的虾塘内微生物多样性分析
根据T_RFLP图谱 (图4) 中OTU数量,对投加硝化细菌前以及投加硝化细菌后的虾塘水样中的多样性指数 (Shannon Diversity H′) 进行了计算,结果见表3。
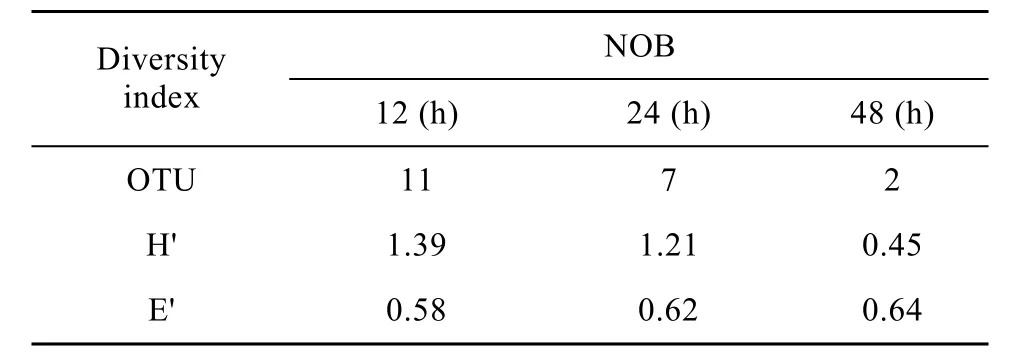
表1 基于T_RFLP图谱分析的微生物多样性指数分析Table 1 Analysis of microbial diversity based on T_RFLP profiles

表2 基于T_RFLP图谱的硝化细菌半定量分析Table 2 Semi quantitative analysis of NOB based on T_RFLP profiles

表3 基于T_RFLP图谱分析的微生物多样性指数分析Table 3 Analysis of microbial diversity based on T_RFLP profiles
从投加菌前后的多样性指数可以看出,虾塘投加菌硝化细菌48 h后,塘内细菌种类明显增加,从微生物多样性指数 (Shannon Diversity,H′) 来看,投加菌48 h后虾塘内微生物多样性大于投加菌前,变化幅度为 9%。通过表 4可以看出,投加硝化细菌后,水塘内该细菌数量占有绝对优势。
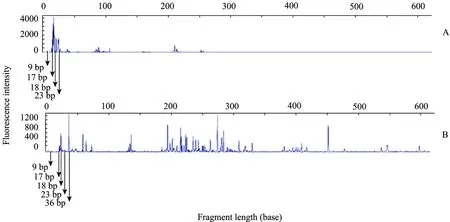
图4 利用细菌通用引物分析投加硝化细菌前后虾塘水中细菌16S rDNA的T_RFLP图谱Fig. 4 T_RFLP profiles based on bacteria16S rDNA with bacterial universal primers before and after adding nitrifying bacteria. (A) Hae Ⅲ-digesting T_RFLP profiles for bacteria in the shrimp ponds before adding nitrifying bacteria. (B) Hae Ⅲ-digesting T_RFLP profiles for bacteria in the shrimp ponds after adding nitrifying bacteria.

表4 基于T_RFLP图谱分析的虾塘水中细菌半定量分析Table 4 Semi quantitative analysis of bacteria based on T_RFLP profiles in the pool
2.4 基于T_RFLP技术对虾塘水中主要细菌种类进行快速定性分析
通过对投加硝化细菌前后都出现的 T_RF峰进行分析,其中投加硝化细菌前后都出现的片段为9、17、18、23、36 bp (图4),经检测,片段36 bp代表投加的富集硝化细菌种群 (Nitrobacter),与Terahara等[11]报道的废水中的硝化细菌片段类似。17 bp代表的微生物种类可能性较复杂,不能确定具体的种属,9 bp代表的微生物种类为短芽孢杆菌 Brevibacillus shida,23 bp代表微杆菌Microbacterium orla,18 bp代表的微生物可能是固氮弧菌Azoarcus indigen或者霍氏鲍特菌Bordetella holmesii。投加NOB 48 h后,硝化细菌在虾塘水内作为优势菌存在,从而可以确保对水中的亚硝酸盐持续降解的作用。
3 结论
在硝化细菌生长迟缓期、对数期、稳定期取样,分别进行T_RFLP检测,当反应器中硝化细菌进入稳定期时,细菌多样性最低,富集培养效果最高。添加稳定期硝化细菌至虾塘水中,从T_RFLP检测数据表明,投加硝化细菌前虾塘水内的细菌多样性小于投加后,并且硝化细菌可以作为优势菌存在于养殖水体中,利用T_RFLP技术对硝化细菌生物反应器中培养的硝化细菌进行实时监控,从而寻找富集最佳时机进行投加,提高了硝化细菌的产业化效率。T_RFLP技术与生物信息学技术结合,能够对环境中的微生物多样性进行实时动态的检测,是一种比较灵敏的微生物生态学研究方法。
REFERENCES
[1] Liu F, Wang M, Yang H, et al. Screening and Identification of purple non-sulfur photosynthetic bacteria purifying aquaculture water. Chin J Biotech, 2008, 28(8): 91−95.刘芳, 王敏, 杨慧, 等. 净化养殖水体紫色非硫光合细菌的筛选与鉴定. 生物工程学报, 2008, 28(8): 91−95.
[2] Wang LG, Ren TZ, Wang YC, et al. Effect of seaweed extract on nitrogen cycle in eutrophic water. Environ Sci Technol, 2006, 29(2): 14−17.王立刚, 任天志, 王迎春, 等. 海藻提取物对富营养化水体氮素循环影响研究. 环境科学与技术, 2006, 29(2): 14−17.
[3] Ju Z, Zhou CL, Dou J. Studies on the culture and application of a nitrite-oxidizing bacterium with high hitrification activity. Microbiol China, 2005, 32(5): 56−61.琚姝, 周长林, 窦洁. 高硝化活性亚硝酸盐氧化细菌的培养和应用研究. 微生物学通报, 2005, 32(5): 56−61.
[4] Hu JL, Lin XG, Zhu HY, et al. Isolation of soil ammonia-oxidizing bacteria. Soils, 2005, 37(5): 569−571.胡君利, 林先贵, 褚海燕, 等. 土壤氨氧化菌的分离方法研究. 土壤, 2005, 37(5): 569−571.
[5] Luo JF, Lin WT, Ren J, et al. T_RFLP technique and its application on community analysis of nitrifying bacteria. Microbiol China, 2008, 35(3): 456−461.罗剑飞, 林炜铁, 任杰, 等. T_RFLP技术及其在硝化细菌群落分析中的应用. 微生物学通报, 2008, 35(3): 456−461.
[6] Yu SL, Wu XL, Qian Y. Application and optimization of T_RFLP method for microbial community analysis. Chin J Appl Environ Biol, 2006, 12(6): 861−868.余素林, 吴晓磊, 钱易. 环境微生物群落分析的T_RFLP技术及其优化措施. 应用与环境生物学报, 2006, 12(6): 861−868.
[7] Fe´ray C, Volat B, Degrange V, et al. Assessment of three methods for detection and quantifcation of nitriteoxidizing bacteria and nitrobacter in freshwater sediments (MPN-PCR, MPN-Griess, immunofuorescence). Microb Ecol, 1999, 37(3): 208−217.
[8] Leser TD, Lindecrona RH, Jensen TK, et al. Changes in bacterial community structure in the colon of pigs fed different experimental diets and after infection with brachyspira hyodysenteriae. Appl Environ Microbiol, 2000, 66(8): 3290−3296.
[9] Peinhopf M, Rijnen L, Bockelmann W, et al. The surface microfora dynamics of bacterial smear-ripened Tilsit cheese determined by T_RFLP DNA population fngerprint analysis. Int Dairy J, 2005, 15(6/9): 785−794.
[10] Wen QX, Chen ZQ, Shi HC. T_RFLP detection of nitrifying bacteria in a fuidized bed reactor of achieving simultaneous nitrifcation-denitrifcation. Chemosphere, 2008, 71(9): 1683−1692.
[11] Terahara T, Hoshino T, Tsuneda S, et al. The microbial population dynamics at the start-up stage of wastewater treatment reactor by terminal restriction fragment length polymorphism analysis based on 16S rDNA and rRNA gene sequences. J Biosci Bioeng, 2004, 98(6): 425−428.
Analysis of microbial diversity of nitrifying bacteria by Terminal Restriction Fragment Length Polymorphism
Weitie Lin, and Yanan Zhu
School of Bioscience and Bioengineering, South China University of Technology, Guangzhou 510006, China
We analyzed the microbial diversity and quantity of nitrifying bacteria in the enrichment reactor by Terminal Restriction Fragment Length Polymorphism (T_RFLP), a cultured-independent molecular technique. The result indicated that nitrobacteria enriched the best, and the diversity index decreased 62.80% compared with the initial data. Nitrobacteria were predominant in the reactor. Meanwhile, we studied the microbial diversity before and after adding Nitrobacteria into shrimp ponds, and analyzed several major bacterial species that existed stably in the pond. According to the analysis by T_RFLP program, species including Brevibacillus brevis, Microbacterium lactium, Azoarcus indigens and Bordetella holmesii were the dominant bacteria in the ponds.
Terminal Restriction Fragment Length Polymorphism, nitrobacter, reactor, microbial community structure, microbial diversity
随着我国水产养殖规模的扩大以及养殖密度的大幅提高,养殖过程中广泛使用的饵料、抗生素以及产生的大量水生物排泄物对水体造成了严重污染,引发了一系列的养殖环境及食品安全问题[1]。其中,高浓度的亚硝酸盐是引起鱼虾患病甚至死亡的主要因素,硝化细菌 (Nitrobacter,NOB) 能够通过氧化还原作用将亚硝酸盐转化成无毒的硝酸盐[2]。因此,通过投加硝化细菌可以有效避免亚硝酸盐的毒害。目前,由于硝化细菌代时长、生长缓慢、平板培养菌落较小易受杂菌污染,因此,对其研究主要停留在传统的菌种分离、纯化和生理生化特性的基础上[3-4],难以实现对硝化细菌富集生物反应器内硝化细菌活性的准确研究,不利于硝化细菌投加菌的产业化发展。
December 23, 2009; Accepted: February 26, 2010
Weitie Lin. E-mail: wtlin@21cn.com
