人神经元素3基因重组逆转录病毒表达载体的构建及其包装细胞株的建立
2010-02-09楚元奎吕长荣陈冬梅曹晖窦忠英
楚元奎,吕长荣,陈冬梅,曹晖,窦忠英
西北农林科技大学动物医学院 陕西省农业分子生物学重点实验室 国家干细胞工程技术研究中心陕西分中心,杨凌 712100
神经元素3基因 (neurogenin3,ngn3) 是控制胰岛早期发育的关键性转录因子之一,它通过与胰岛素基因增强子元件结合,在胰腺的发育过程中起着非常重要的调控作用。胚胎发育生物学研究表明,胰腺内表达 ngn3基因的细胞可分化为胰岛内所有四种类型的内分泌细胞,被认为是胰岛内分泌祖细胞的标志之一[1]。外源性ngn3基因的表达可以促进胰腺导管细胞向胰岛 β细胞转化[2]。由此可见,导入外源性ngn3基因可作为促进干细胞向胰岛β细胞分化的一种有效策略。
本实验室长期从事胰腺祖细胞体外定向诱导分化为胰岛 β细胞方面的研究,已成功建立了表达胰腺十二指肠同源框 1基因 (pancreatic duodenal homeobox-1,pdx-1) 的人胎儿胰腺祖细胞系,并完成了相关的鉴定工作和初步诱导分化实验[3-4]。本研究旨在建立稳定表达人ngn3基因的包装细胞株,将其应用于随后人胎儿胰腺祖细胞体外定向诱导分化为胰岛 β细胞的研究中,以期能够提高其定向诱导分化效率。
1 材料与方法
1.1 材料
1.1.1 细胞株和人胎儿胰腺组织
PT67细胞由本中心保存;胰腺组织取自5~6月龄人流产胎儿 (杨凌示范区某医院提供),液氮中保存备用。
1.1.2 菌种与载体
大肠杆菌DH5α菌种、逆转录病毒载体pMSCV-neo由本中心保存;pMD18-T载体购自TaKaRa公司。
1.1.3 主要试剂
限制性内切酶EcoR I和Hpa I、T4 DNA连接酶、LA Taq聚合酶 (带2×GC Buffer I)、dNTPs、DL2000 DNA Marker和DNA Marker IV购自TaKaRa 公司;RevertAidTMFirst Strand cDNA Synthesis Kit 购自Fermentas公司;Trizol Reagent和转染试剂脂质体2000购自Invitrogen 公司;G418、DMEM培养基 (高糖) 与胎牛血清购自Gibco 公司;DNA片段快速胶回收试剂盒购自Bio Dev-tech公司;质粒小提试剂盒购自Sangon 公司;高纯度质粒中提试剂盒购自Promega 公司;Ngn3鼠多克隆抗体购自 Abcam公司 (Lot No:ab54743);SP-9000通用型免疫组化染色试剂盒购自北京中山生物技术有限公司。
1.2 方法
1.2.1 人 ngn3 基因的克隆与测序
根据已发表人 ngn3基因序列 (GenBank Accession No. BC126468),应用primer premier 5.0软件设计合成引物。上游引物 hNgn3-F:5′-CCGG AATTC ATGACGCCTCAACCCTCGG-3′,下游引物hNgn3-R:5′-CCGGTTAACTCACAGAAAATCTGA GAAAGCCAG-3′,在上下游引物的 5′端分别引入EcoR I与Hpa I的酶切位点,并加入保护碱基,由上海生工生物技术有限公司合成,下划线部分分别为EcoR I和Hpa I的酶切位点。用Trizol试剂提取5~6月龄人流产胎儿胰腺组织总 mRNA,反转录得到cDNA,以hNgn3-F与hNgn3-R为引物,在LA Taq酶作用下进行PCR扩增。反应体系为25 µL,各组分添加比例参照 2×GC Buffer I使用说明。反应参数为:94℃预变性5 min;94℃变性45 s,67℃退火45 s,72℃延伸1 min,循环35次;72℃延伸10 min。PCR产物预期大小为663 bp。PCR产物经DNA片段快速胶回收试剂盒回收后,连接到pMD18-T载体上 (命名为 T-ngn3),转化后小量提取该质粒,经酶切鉴定后送TaKaRa 生物公司进行测序。用BioXM 2.6软件对测序结果序列与 GenBank中的原序列进行同源性分析。
1.2.2 pMSCV-ngn3重组载体的构建
用内切酶EcoR I和Hpa I将pMSCV-neo质粒和测序正确的T-ngn3质粒双酶切,酶切产物进行1%琼脂糖凝胶电泳,回收酶切后的 pMSCV-neo载体片段(约 6.5 kb) 和ngn3基因片段,用T4 DNA连接酶连接后得到pMSCV-ngn3重组载体,重组载体经转化和质粒提取后,进行EcoR I和Hpa I双酶切鉴定,将鉴定结果为阳性的质粒送出测序。大量提取测序正确的阳性质粒,测定其核酸浓度,−20℃冻存备用。
1.2.3 PT67包装细胞G418最小致死量的测定
将PT67细胞以每孔2×104个细胞接种24孔板,每孔分别加入含0、100、200、300、400、500、600、700 mg/L G418的培养液,每个浓度梯度作3孔重复。期间每 3天换液1次,培养2周后,所有细胞全部死亡的孔所对应的G418浓度即是PT67细胞的G418最小致死量。
1.2.4 PT67-ngn3包装细胞株的建立
PT67包装细胞扩增培养液为含 15%胎牛血清的高糖DMEM培养液,细胞每3天按 1∶5的比例传代1次。转染前1天将PT67细胞按 2×105个/皿的密度接种于直径为60 mm的细胞培养皿中,培养24 h后用于转染 (约 70%~80%融合)。用脂质体2000转染试剂将pMSCV-ngn3质粒导入PT67细胞。转染后6 h换成含有15%胎牛血清的DMEM培养液继续培养,48 h后按1∶10的比例进行细胞传代,传代后24 h更换为G418筛选液对细胞进行筛选,筛选2周后得到许多具有G418抗性的细胞克隆 (命名为PT67-ngn3细胞)。扩增培养后对该细胞系进行免疫组化和 RT-PCR鉴定,并对其培养上清液进行RT-PCR鉴定以及透射电镜观察。
1.2.5 包装细胞株及其培养上清液的RT-PCR检测
应用 Trizol试剂提取包装细胞株及其培养上清液中的总RNA,总RNA经DNase I处理后,以Oligo (dT)18为引物用M-MLV逆转录酶进行反转录,得到cDNA,取1 µL cDNA进行RT-PCR检测。PCR检测引物为hNgn3-F/hNgn3-R。反应体系及参数同上。以未转染的PT67细胞做阴性对照。
1.2.6 包装细胞株的免疫组化检测
参照 SP-9000通用型免疫组化染色试剂盒说明对筛选前及筛选后的 PT67-ngn3包装细胞进行免疫细胞化学染色。一抗为鼠抗 Ngn3多克隆抗体(1∶200倍稀释),二抗为生物素标记的抗鼠多克隆抗体,DAB显色,镜下观察照相。并对G418筛选前后的Ngn3阳性细胞率进行比较分析。200倍镜下分别随机选取6个视野,计数Ngn3阳性细胞数,与总细胞数比较后得到Ngn3阳性细胞率,取其平均值进行分析。
1.2.7 包装细胞株培养上清液中病毒颗粒的透射电镜观察
将−70℃保存的培养上清液取出,25 000 r/min离心90 min浓缩后,迅速置于冰盒内,送往第四军医大学电镜室进行观察检测。
2 结果
2.1 人ngn3基因的克隆与测序
以流产人胎儿胰腺组织获得的cDNA为模板,hNgn3-F/hNgn3-R为引物进行 RT-PCR扩增,扩增产物经1%琼脂糖凝胶电泳后可见大小约663 bp的特异性条带 (图1)。PCR产物连入pMD18-T载体进行测序,测序结果经BioXM 2.6软件分析与GenBank公布的人 ngn3基因序列 (GenBank Accession No. BC126468) 完全相同。
2.2 pMSCV-ngn3重组载体的鉴定
将pMSCV-ngn3重组载体用EcoR I和Hpa I进行双酶切,结果得到663 bp和6.5 kb两个酶切片段(图 2),且测序结果证实 ngn3基因序列未发生突变。该结果证明人ngn3基因重组到了pMSCV-neo载体中。
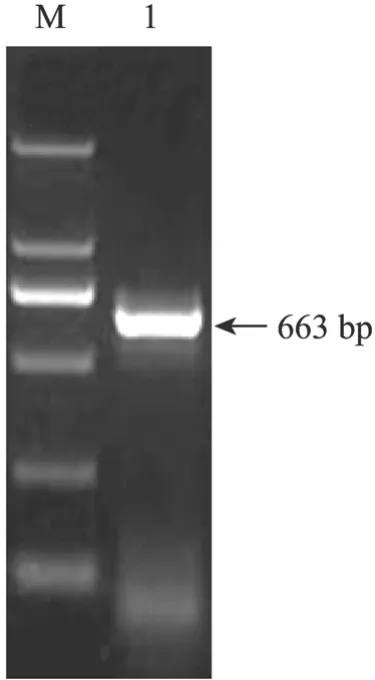
图1 人ngn3基因PCR产物的琼脂糖凝胶电泳Fig. 1 Agarose gel electrophoresis of human ngn3 gene PCR products. M: DL2000 marker; 1: human ngn3 gene PCR products.
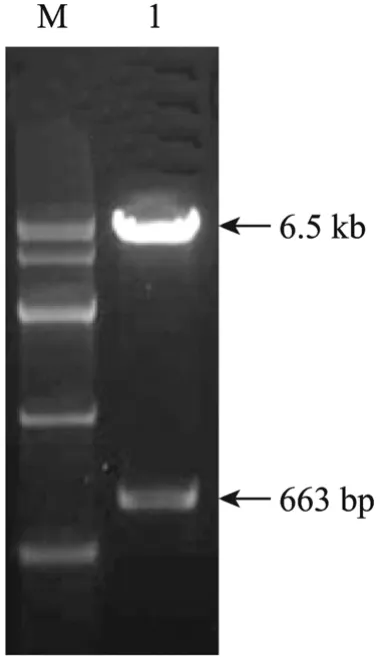
图2 pMSCV-ngn3重组载体的双酶切鉴定Fig. 2 Detection of pMSCV-ngn3 recombinant vector by double restriction enzyme digestion. M: DNA marker IV; 1: double restriction enzyme digestion products of pMSCV-ngn3 recombinant vector.
2.3 PT67-ngn3包装细胞株的建立及鉴定
PT67 细胞经不同浓度G418筛选,确定其最小致死浓度为 600 mg/L,选取该浓度的G418用于随后的细胞筛选。将pMSCV-ngn3重组载体导入PT67细胞内,传代后待细胞生长至 70%~80%融合时进行G418筛选 (图3A)。筛选3 d后细胞开始出现大量死亡,第6天时局部出现小的细胞克隆 (图3B),随着筛选的继续进行细胞克隆逐渐增大 (图3C、D)。2周后停止筛选,对其进行传代扩增及相关检测,将扩增后的细胞株命名为PT67-ngn3细胞株。
RT-PCR检测结果显示,转染后的包装细胞内有目的基因ngn3的表达,而未转染的包装细胞内则检测不到该基因表达 (图 4)。表明导入的目的基因在包装细胞内已经开始转录。
免疫组化结果显示,转染后的包装细胞内有目的蛋白Ngn3的表达,其定位于细胞核内 (图5),并且经过 G418筛选,Ngn3阳性细胞率由筛选前的34.8%增加到了 78.7% (图 6)。表明目的基因转录后翻译成了蛋白,表达于细胞核内;该包装细胞株经过G418筛选得到了进一步的纯化。
对 G418筛选后的包装细胞培养上清液分别进行 RT-PCR检测和透射电镜分析。透射电镜检测结果显示,培养上清液中含有包装后的病毒颗粒,该病毒颗粒呈圆形或椭圆形,具有典型的病毒颗粒形态 (图 7箭头所示);RT-PCR检测结果显示,包装后的病毒颗粒中含有目的基因 (图4)。
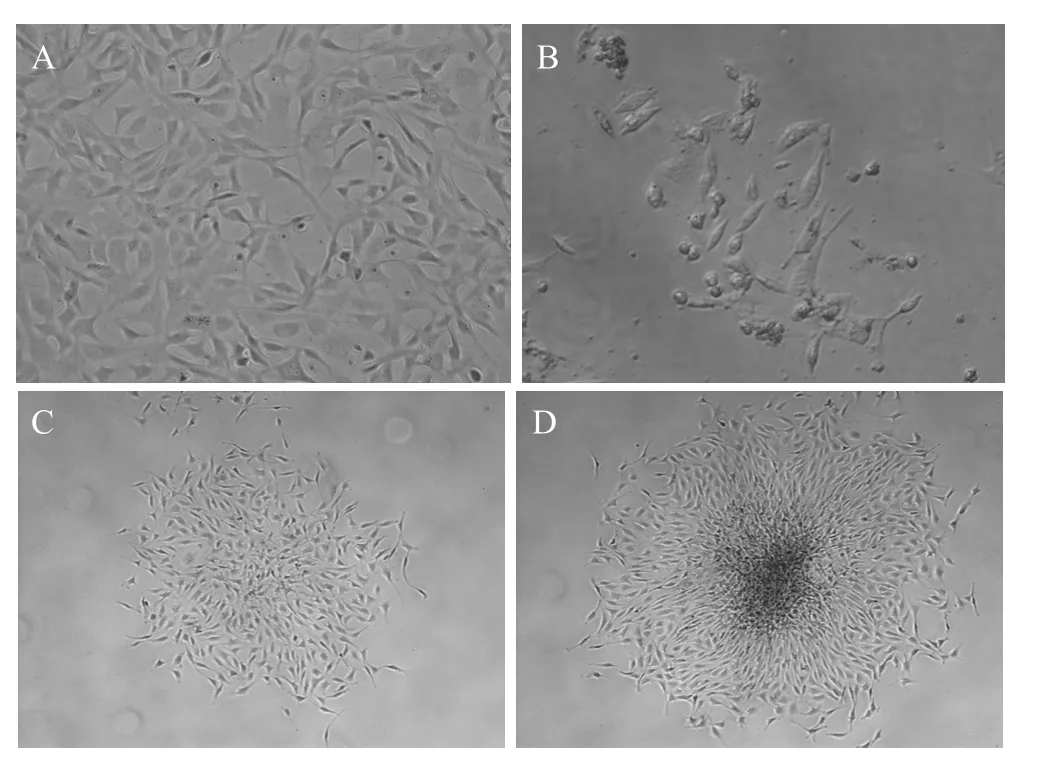
图3 PT67-ngn3包装细胞株的筛选Fig. 3 Screening of PT67-ngn3 packaging cells. (A) Before screening. (B) 6 days after screening. (C) 11 days after screening. (D) 14 days after screening. A, B magnificating 100×; C, D magnificating 50×.
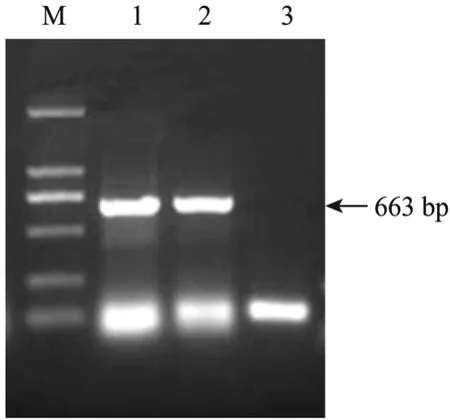
图4 PT67-ngn3包装细胞株及其培养上清液的RT-PCR检测Fig. 4 RT-PCR detection of PT67-ngn3 packaging cells and its supernatant. M: DL2000 DNA marker; 1: RT-PCR products of PT67-ngn3 packaging cells; 2: RT-PCR products of PT67-ngn3 packaging cells’s supernatant; 3: RT-PCR products of PT67 cells.
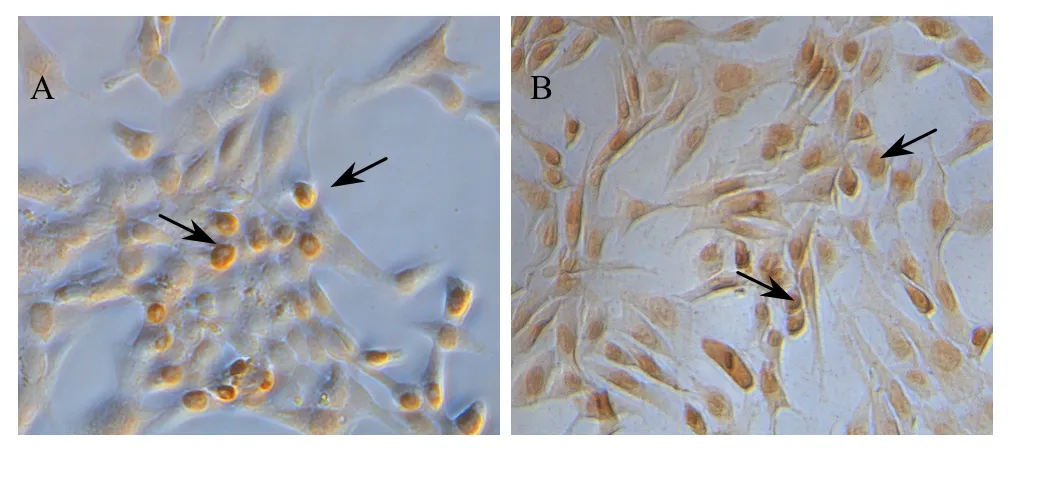
图5 PT67-ngn3包装细胞G418筛选前及筛选后的免疫组化染色 (Ngn3阳性细胞为核着色,如箭头所示,200×)Fig. 5 Immunohistochemical staining of PT67-ngn3 packaging cells before and after G418 screening. (A) Immunohistochemical staining of PT67-ngn3 packaging cells before G418 screening. (B) Immunohistochemical staining of PT67-ngn3 packaging cells after G418 screening. (Ngn3 positive cells are nucleus coloring, black arrows, magnificating 200×).
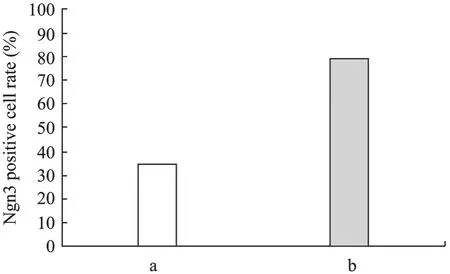
图6 G418筛选前后Ngn3阳性细胞的表达变化Fig. 6 Analysis of Ngn3 positive cell expression before and after G418 screening. a: Ngn3 positive cell rate before G418 screening; b: Ngn3 positive cell rate after G418 screening.
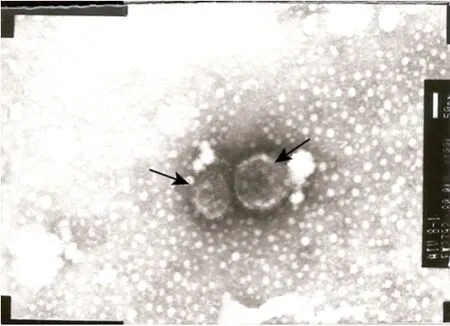
图7 pMSCV-ngn3逆转录病毒颗粒在透射电镜下的形态 (100 000×,箭头所示)Fig. 7 Morphology of retroviral pMSCV-ngn3 particles under transmission electron microscope. Magnificating 100 000×, black arrows.
以上结果综合表明,PT67-ngn3包装细胞株建立成功。
3 讨论
近些年来,干细胞体外定向诱导分化为功能性的胰岛素分泌细胞主要是采取添加可溶性诱导因子的方式,已经取得了一定的进展,但是仍然存在诱导分化效率不高,细胞未完全成熟分化等问题[5-6]。随着基因工程技术的发展,将与胰腺内分泌细胞发育和 β细胞分化以及功能完善相关的转录因子应用于干细胞体外定向诱导分化迅速成为了研究的热点,并为提高干细胞向胰岛 β细胞的分化效率提供了新的途径。近几年,pdx-1、ngn3和mafa等胰腺转录因子在该领域的应用已经取得了一些可喜的进展[7-8]。本实验选用的 ngn3基因属于碱性螺旋-环-螺旋 (bHLH) 结构型转录因子,是启动胰腺内分泌细胞分化所必需的关键转录因子,是 β细胞分化所必需的转录因子neuroD的激活因子[9]。ngn3通过启动下游一系列相关转录因子的表达,从而在胰岛内分泌细胞的定向分化过程中发挥着重要作用。
本实验从流产人胎儿胰腺组织成功克隆出了人ngn3基因开放阅读框序列,其测序结果与GenBank公布的人 ngn3基因序列 (GenBank Accession No. BC126468) 完全相同,与之前所用的普通Taq聚合酶和Buffer相比,GC buffer I和LA Taq聚合酶的应用不仅大大提高了扩增效率,而且得到了高度保真的人ngn3基因。这主要是由于ngn3基因是通过与胰岛素基因增强子元件结合来发挥作用的,其本身具有很高的 GC含量,因此对扩增条件的要求也较高,GC buffer I和LA Taq聚合酶的应用很好地解决了这一问题。
实验中所使用的逆转录病毒载体 pMSCV-neo来源于 Moloney小鼠白血病病毒,拥有鼠干细胞PCMV病毒来源的5′长末端重复序列 (5′ LTR),可使目的基因在干细胞和其他哺乳动物细胞中高效表达[10]。然而,逆转录病毒载体pMSCV-neo本身不具有感染能力,其感染能力需要经过包装细胞的包装才能获得。实验中所用的PT67细胞是目前较为广泛使用的包装细胞,用它制备的逆转录病毒可以感染人和其他哺乳动物的细胞,并且由它包装的病毒感染靶细胞后不能进行复制,因此具有很高的生物安全性[11]。本实验成功构建出了表达人ngn3基因的重组逆转录病毒载体 pMSCV-ngn3,通过脂质体法将其导入PT67包装细胞内,经G418筛选后,得到1株具有G418抗性的细胞株,RT-PCR及免疫组化检测证实该细胞株在mRNA水平和蛋白水平均稳定表达Ngn3,表明PT67-ngn3包装细胞株建立成功。对其培养上清液的RT-PCR检测及电镜观察结果表明,该包装细胞株将导入的重组逆转录病毒载体pMSCV-ngn3包装成了具有感染能力的病毒颗粒,并将其释放到了培养上清液中,表明得到的细胞株为高效表达人ngn3基因的产毒细胞株。
总之,PT67-ngn3高效产毒包装细胞株的成功建立,为下一步将ngn3基因应用于人胎儿胰腺祖细胞的体外定向诱导分化,提高其定向诱导效率奠定了基础。
REFERENCES
[1] Gu G, Dubauskaite J, Melton DA, et al. Direct evidence for the pancreatic lineage: Ngn3+cells are islet progenitors and are distinct from duct progenitors. Development, 2002, 129(10): 2447−2457.
[2] Heremans Y, Van De Casteele M, in’t Veld P, et al. Recapitulation of embryonic neuroendocrine differentiation in adult human pancreatic duct cells expressing neurogenin3. J Cell Biol, 2002, 159: 303−312.
[3] Xiao M, An LL, Yang XY, et al. Establishing a human pancreatic stem cell line and transplanting induced pancreatic islets to reverse experimental diabetes in rats. Sci China Ser C: Life Sci, 2008, 38(8): 699−707.效梅, 安立龙, 杨学义, 等. 人胰腺干细胞建系及移植诱导胰岛治疗大鼠糖尿病. 中国科学 C 辑: 生命科学, 2008, 38(8): 699−707.
[4] Zhao T, Qiao H, Wang Y, et al. Differentiation of human pancreatic stem cells into islet-like cell clusters in the treatment of diabetic rats. J Clin Rehabil Tissue Eng Res, 2007, 11(7): 1259−1262.赵婷, 乔海, 王赟, 等. 人胰腺干细胞诱导胰岛样细胞团及其治疗大鼠糖尿病的效果. 中国组织工程研究与临床康复, 2007, 11(7): 1259−1262.
[5] Ayse GK, Luis EF, Ana DL, et al. Limited capacity of human adult islets expanded in vitro to redifferentiate into insulin-producing β cells. Diabetes, 2007, 56: 703−708.
[6] Andreas L, Anna LN, Robyn AB, et al. Redifferentiation of insulin-secreting cells after in vitro expansion of adult human pancreatic islet tissue. Biochem Biophys Res Commun, 2005, 327: 581−588.
[7] Kaneto H, Nakatani Y, Miyatsuka T, et al. Pdx-1/VP16 fusion protein, together with NeuroD or Ngn3, markedly induces insulin gene transcription and ameliorates glucose tolerance. Diabetes, 2005, 54: 1009−1022.
[8] Qiao Z, Juliana B, Andrew K, et al. In vivo reprogramming of adult pancreatic exocrine cells to β cells. Nature, 2008, 455: 627−632.
[9] Gradwohl G, Dierich A, LeMeur M, et al. Neurogenin3 is required for the development of the four endocrine cell lineages of the pancreas. Proc Natl Acad Sci USA, 2000, 97: 1607−1611.
[10] Miller AD, Chen F. Retrovirus packaging cells based on 10A1 murine leukemia virus for production of vectors that use multiple receptors for cell entry. J Virol, 1996, 70(8): 5564−5571.
[11] Miller AD. Cell-surface receptors for retroviruses and implications for gene transfer. Proc Natl Acad Sci USA, 1996, 93(21): 11407−11413.
