氮、锰、硫缺乏对蛋白核小球藻Chlorella pyrenoidosa光合产氢及其生长的影响
2010-02-09张磊桑敏李爱芬张成武
张磊,桑敏,李爱芬,张成武
暨南大学 水生生物研究中心 热带亚热带水生态工程教育部工程研究中心,广州 510632
能源是人类社会生存与发展的重要物质基础。随着化石燃料的日益消耗殆尽,寻求并开发清洁无污染的绿色替代能源已成为科技工作者关注的重要课题[1]。氢作为一种理想的可再生能源,具有燃烧热值高、无污染和适用范围广等优点,已成为绿色能源开发的一个重要方向[2-3]。
绿藻体内具有可逆氢酶,能将光合作用中产生的部分质子还原为氢气[4]。早在 1942年,Gaffron和 Rubin就证实了绿藻斜生栅藻 Scenedesmus obliquus 可通过光合作用产氢[5],此后陆续报道其他许多绿藻具有光合产氢特性[6-7]。研究已知,绿藻的可逆氢酶对氧气十分敏感,1.5%的氧浓度即可使其迅速失活[8]。因此,人们对绿藻产氢研究更多关注其产氢机制以及如何提高产氢效率。目前研究较多的是莱茵衣藻Chlamydomonas reinhardtii光合产氢,Dennis报道,莱茵衣藻在缺磷和缺硫条件下,光合放氧能力显著下降[9]。2000年,Melis 教授提出了缺硫两步法制氢技术,将绿藻光合放氧与产氢过程从时间上分开,显著提高了藻细胞的产氢效率[10]。研究证实,硫、氮和锰等营养元素缺乏时,对微藻的光合作用具有较大影响[11-12]。氮素是组成氨基酸的必要成分之一,它的缺乏将直接限制光合膜蛋白以及包括叶绿素在内的其他色素分子的合成,最终影响光合放氧能力[11]。锰通过参与光解水过程,将直接影响光合放氧[12]。蛋白核小球藻 Chlorella pyrenoidosa 是绿藻门 Chlorophyta 小球藻属Chlorella中的一种单细胞绿藻,本实验室已有研究证实了缺硫条件能促进其光合产氢[13],因此,本研究对比了氮、锰或硫缺乏的营养条件对蛋白核小球藻光合产氢及其生长的影响,以期为微藻光合制氢技术的研发提供基础数据。
1 材料和方法
1.1 实验藻种
蛋白核小球藻 C. pyrenoidosa由暨南大学水生生物研究中心藻种室提供。
1.2 藻细胞培养
使用TAP[14]培养液,将活化后的藻细胞接种至2 L的三角瓶,培养温度为 (24±1)℃,光照强度约为100 µmol/(m2·s),光暗时间比为12 h/12 h,培养至对数生长末期转入产氢诱导实验。
1.3 产氢实验与诱导条件
以 TAP培养液为产氢对照组,分别设置缺氮(TAP-N)、缺锰 (TAP-Mn) 和缺硫 (TAP-S) 三个实验组。收集各实验组对数生长末期藻细胞,用培养液洗涤 2次后定容至250 mL反应器内 (藻液体积250 mL,上部空间24 mL),充氩气20 min后封闭反应器,暗诱导32 h后放入光照强度约为80 µmol/(m2·s)的光照培养箱内,每隔24 h测定产氢量。
1.4 氢气含量测定
采用排水法读取气体体积,用气相色谱检测气体组成,产氢过程中的氢气含量由气体组成百分比乘以气体体积测得。气相色谱仪型号为上海科创 GC 9800,色谱柱为 TDX-01,TCD热导检测器,汽化室温度为70℃,柱温为50℃,检测器温度为70℃。
1.5 光合与呼吸速率测定
光合与呼吸速率使用氧电极 (Hansatech Oxygraph,英国) 法测定。取2 mL藻液加入反应杯,100 r/min持续搅拌,在温度为25℃及440 µmol/(m2·s)的饱和光强下稳定1 min左右后测量光合速率,每次记录5 min,呼吸速率在黑暗条件下同等方法测得[15]。
1.6 叶绿素a含量测定
叶绿素a含量的测定参照文献[16]方法进行。
2 结果
2.1 氮、锰、硫缺乏对蛋白核小球藻产氢能力的影响
图1是蛋白核小球藻在4种条件下的产氢结果。由图 1可以看出,4种条件下蛋白核小球藻均能进行光合产氢,不同条件下藻的产氢能力有明显差异。对照组藻液的光合产氢持续时间最短,约 48 h,TAP-Mn和TAP-S产氢可持续72 h,TAP-N产氢持续时间最长,达96 h。表1是蛋白核小球藻在4种条件下的产氢总量。在3种诱导产氢条件中,TAP-N组产氢量最高,为 88.613 µL H2/mg Chla,是对照组产氢量的4.61倍。TAP-Mn的产氢量为46.256 µL H2/mg Chla,TAP-S产氢量最低,为24.380 µL H2/mg Chla,是 TAP-N的 27.5%。以上结果显示,缺氮可以较大程度地提高蛋白核小球藻的产氢效率。

图1 不同条件下蛋白核小球藻产氢的比较Fig. 1 Comparison of hydrogen evolution by C. pyrenoidosa under different conditions. Control: TAP; TAP-N: nitrogen deprived TAP; TAP-Mn: manganese deprived TAP; TAP-S: sulfur deprived TAP.

表1 不同条件下蛋白核小球藻的产氢总量Table 1 Total hydrogen yield of C. pyrenoidosa under different conditions
2.2 氮、锰、硫缺乏对蛋白核小球藻光合与呼吸速率的影响
图2所示的是蛋白核小球藻在光合产氢过程中光合与呼吸速率的变化趋势。将蛋白核小球藻在不同条件下的光合放氧进行比较可知,缺氮和缺硫条件对藻细胞光合放氧具有明显的抑制作用,而前者较后者更为强烈。将蛋白核小球藻转入产氢诱导后,4种条件下前24 h内藻细胞的光合放氧强度都保持稳定。TAP组光合放氧速率从24 h后开始迅速增加,48 h左右达到最大,最大值为74.619 µmol O2/(mg Chla·h),之后慢慢回落,约120 h后回到初始值以下;TAP-Mn组藻细胞的光合放氧速率则在前48 h内保持相对稳定,从48 h后开始迅速增加,72 h后增至最大,最大值为73.652 µmol O2/(mg Chla·h),之后缓慢回落;而 TAP-N和 TAP-S组藻细胞的光合放氧速率却从24 h后开始下降,分别于72 h和96 h降至最低,为16.927 µmol O2/(mg Chla·h)和12.551 µmol O2/(mg Chla·h) (表2)。
由图 2亦可看出,在封闭 120 h内,TAP、TAP-Mn和 TAP-S组的呼吸耗氧速率变化趋势相似,先上升后下降,其中TAP和TAP-S组在48 h左右呼吸达到最大值,分别为35.319 µmol O2/(mg Chla·h)和17.797 µmol O2/(mg Chla·h);TAP-Mn组呼吸最大值出现72 h左右,呼吸强度为27.892 µmol O2/(mg Chla·h)。而 TAP-N组的呼吸耗氧速率在产氢实验过程中一直处于增强状态,从初始值为2.200 µmol O2/(mg Chla·h) 增至120 h的40.183 µmol O2/(mg Chla·h) (表3),且72 h后一直较大程度高于其他实验组,说明缺氮条件在其胁迫后期对蛋白核小球藻的呼吸具有一定的促进作用。
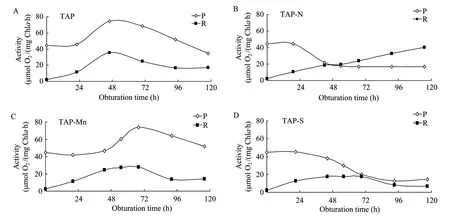
图2 蛋白核小球藻光合产氢过程中光合与呼吸速率的变化Fig. 2 Changes of photosynthesis (P) and respiration (R) rate in C. pyrenoidosa grown in different mediums at the progress of photo-hydrogen evolution. Alga was grown in TAP medium (A) and nitrogen deprived TAP medium (B), manganese deprived TAP medium (C), sulfur deprived TAP medium (D). Measurements were taken with an oxygraph system (Hansatech Instruments) at 25°C, beginning with the record of dark respiration (5 min) and followed by the light-saturated rate of photosynthesis (another 5 min).
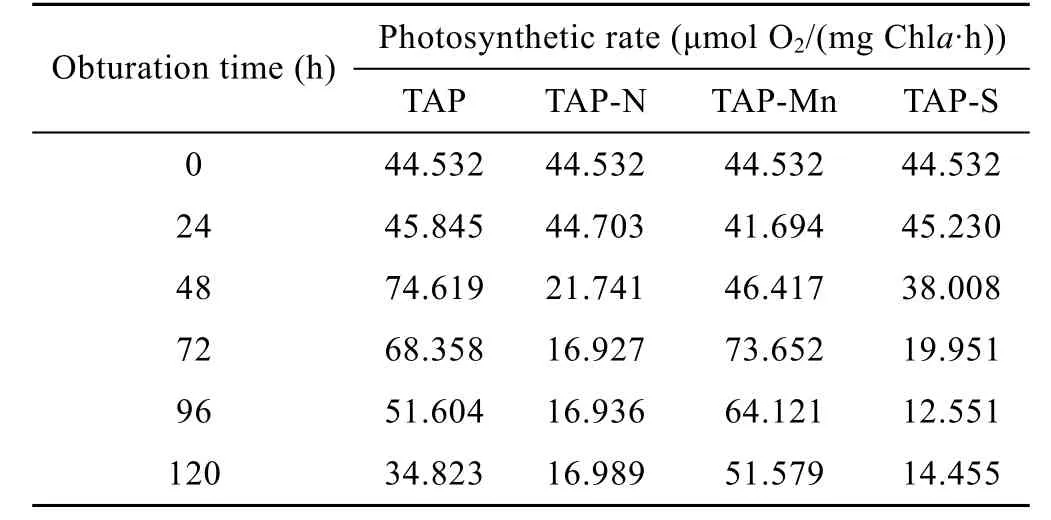
表2 蛋白核小球藻在不同条件下的光合速率Table 2 Photosynthesis rate of C. pyrenoidosa under different conditions

表3 蛋白核小球藻在不同条件下的呼吸速率Table 3 Respiration rate of C. pyrenoidosa under different conditions
绿藻产氢的关键因素之一在于厌氧环境的形成和维持,当藻细胞的光合放氧速率低于其呼吸耗氧速率时,藻液体系随即进入理论上的厌氧状态[10]。蛋白核小球藻在不同条件下的光合和呼吸速率变化结果表明,在其产氢过程中,TAP和TAP-Mn组藻细胞的光合放氧速率一直较大程度高于其呼吸耗氧速率 (图2A、2C),因而未能形成较好的厌氧环境;而TAP-N组光合放氧速率约48 h左右与呼吸耗氧速率持平,之后保持稳定状态,但却一直低于日益增强的呼吸耗氧速率 (图2B),据此推测其形成厌氧环境的时间约为48 h左右;而TAP-S组形成厌氧环境的时间较TAP-N长,藻细胞的光合放氧速率72 h后才与呼吸耗氧速率相接近 (图2D)。
2.3 氮、锰、硫缺乏对蛋白核小球藻生长的影响
蛋白核小球藻培养液在产氢过程中叶绿素 a含量变化如图3所示。由图3可以看出,蛋白核小球藻在 TAP培养液中正常生长,经过120 h产氢实验后,培养液中的叶绿素a含量为70.995 mg/L,比初始含量提高了4.03倍。氮、锰、硫缺乏对蛋白核小球藻的生长具有不同程度地抑制作用,3个实验组藻液叶绿素a的含量明显低于TAP组,其中缺氮和缺硫对蛋白核小球藻的生长影响最大,经过 120 h产氢实验,藻液的叶绿素 a含量分别从初始的20.796 mg/L和19.781 mg/L升到26.237 mg/L和22.449 mg/L。蛋白核小球藻在TAP-Mn培养液中有增长,叶绿素a含量由实验初期的19.81 mg/L提高到53.099 mg/L,是初始含量的2.68倍。

图3 蛋白核小球藻在光合产氢过程中叶绿素 a含量的变化Fig. 3 Changes of chlorophyll a content in C. pyrenoidosa at the progress of photo-hydrogen evolution.
3 讨论
封闭、充氮气和暗诱导可为藻培养体系提供一个相对低氧甚至厌氧的环境[17]。在这种前提条件下,蛋白核小球藻在TAP以及TAP-N、TAP-Mn和TAP-S中均能进行光照产氢。在最初的暗诱导阶段,4种培养液中藻细胞的光合放氧能力均未发生显著变化,文献报道莱茵衣藻[9]在硫缺乏24 h后光合放氧能力下降75%,与莱茵衣藻相比,蛋白核小球藻对营养元素缺乏的胁迫条件耐受能力较强。恢复光照后,不同实验组藻细胞的响应有所差异,TAP组随着光照条件的恢复,藻细胞的光合放氧速率迅速增大,48 h达到最大值,致使该体系中氧浓度迅速增加,氢酶受到抑制导致产氢过程停止,产氢过程从封闭开始仅持续了约48 h。
锰元素是TAP培养液中的一种微量元素[14],它作为光合膜上光系统Ⅱ放氧蛋白辅基,通过参与光解水反应影响藻类的光合放氧[12]。本实验证实锰的缺乏对蛋白核小球藻的光合放氧能力产生了一定影响,产氢期间TAP-Mn的光合放氧速率与TAP相比明显降低。缺氮和缺硫条件均能明显抑制蛋白核小球藻的光合放氧能力,其中,TAP-S组的光合放氧速率在封闭后72 h与其呼吸速率相近,而产氢仅持续72 h,推测可能是缺硫对藻体的生理状态影响较大,因而产氢过程未能持续更久。国内外已有研究报道,缺氮可限制藻细胞的光合作用和生长[11,18],本实验中 TAP-N组蛋白核小球藻的光合放氧速率下降迅速,在48 h左右就降到和其呼吸耗氧速度持平,这为蛋白核小球藻光合产氢创造了一个理论上的厌氧环境,促进了光合产氢。呼吸作用的增强为光合产氢提供持续性的电子供给[19],避免产氢后期由于 PSⅡ功能的衰弱而造成光合电子传递链的低效,这也是蛋白核小球藻在TAP-N中产氢比TAP-S效率高的原因之一。与TAP-N和TAP-S相比,在TAP-Mn中蛋白核小球藻的光合放氧受到的抑制较弱,究其原因,可能是藻细胞在一定时间内还有一定量的锰离子存在,这个推测还尚需进一步缺锰传代实验验证。
叶绿素 a含量的动态变化可以反映藻细胞的生长状况。在缺氮和缺硫的条件下,蛋白核小球藻的叶绿素 a含量随着产氢过程的进行保持相对稳定,在TAP-Mn和TAP中藻液的叶绿素a含量有较大幅度提高,说明缺锰条件对蛋白核小球藻生长影响较小,而缺氮和缺硫明显抑制了蛋白核小球藻的生长,这和 Hase等[20]报道的缺硫使莱茵衣藻停止生长的结果一致。以上结果表明,缺氮条件能显著抑制蛋白核小球藻的光合放氧及其生长,促进其呼吸作用,对藻细胞的光合产氢具有较大促进作用。
绿藻产氢是一个微妙而复杂的过程,消除氧气对氢酶活性的抑制作用是关键[17]。Melis教授利用了缺硫能抑制藻细胞光合作用的机理,将莱茵衣藻转入缺硫培养基中,约24 h后藻细胞的光合作用强度开始低于其呼吸作用,藻体系进入厌氧状态,诱导氢酶光合产氢,其结果显示该方法具有较高的产氢效率[10]。然而,本实验中的TAP-S组在封闭后的最初48 h内,光合产氢效率低于TAP组。推测其原因可能是随着产氢过程的进行,TAP中藻细胞数量增多且生理状态保持良好,光合电子传递比缺硫活跃[21],而在缺硫条件下,藻的光合放氧能力虽有所下降,但藻细胞的生理状态欠佳,细胞几乎停止分裂生长,造成产氢能力低下。上述结果提示,硫元素缺乏对不同藻种光合产氢的影响有差异。近年来亦有研究者探索绿藻新的产氢方法,如 Markov在2006年报道高光强胁迫亦可抑制莱茵衣藻光合放氧,而促进产氢反应,产量可达5.3 mL H2/(g dw·h)[22]。中国科学院大连化学物理研究所张卫研究组利用解偶联剂 CCCP调控扁藻 Platymonas subcordiformis产氢亦有较好结果,使扁藻的光合放氢量提高了近100倍[7]。因此探索新的产氢方法将是今后绿藻产氢的研究热点之一。氮元素是培养基中的大量元素,本研究结果显示对于蛋白核小球藻,缺氮法比缺硫法更具产氢效率,如果从诱导产氢的培养基成本考虑,缺氮法比经典缺硫法更经济,值得注意。本研究小组下一步将利用高效产氢藻株,进一步探讨氮元素缺乏对微藻光合产氢的影响以及藻细胞光合产氢的作用机制。
REFERENCES
[1] Mei H, Zhang CW, Yin DC, et al. Survey of studies on renewable energy production by microalgae. J Wu Han Bot Res, 2008, 26(6): 650−660.梅洪, 张成武, 殷大聪, 等. 利用微藻生产可再生能源研究概况. 武汉植物学研究, 2008, 26(6): 650−660.
[2] Happe T, Hemschemeier A, Winkler M, et al. Hydrogenases in green algae: do they save the algae’s life and solve our energy problems? TRENDS Plant Sci, 2002, 7(6): 246−250.
[3] Han ZG, Li AF, Long MN, et al. Microalgae hydrogen production: the ultimate answer to global energy crisis? Ecol Sci, 2003, 22: 104−108.韩志国, 李爱芬, 龙敏南, 等. 微藻光合作用制氢一能源危机的最终出路? 生态科学, 2003, 22: 104−108.
[4] Vignais PM, Billoud B, Meyer J. Classification and phylogeny of hydrogenases. FEMS Microbiol Rev, 2001, 25: 455−501.
[5] Gaffron H, Rubin J. Fermentative and photochemical production of hydrogen in algae. J Gen Physiol, 1942, 26: 219−240.
[6] Maione TE, Gibbs M. Hydrogenase-mediated activities in isolated chloroplasts of Chlamydomanas reinhardtii. Plant Physiol, 1986, 80: 360−363.
[7] Guan YF, Deng MC, Zhang W, et al. Studies of photohydrogen evolution by four marine green mcroalgae. Mar Sci, 2004, 28(9): 32−35.管英富, 邓麦村, 张卫, 等. 4种海洋绿藻光合放氢特征的研究. 海洋科学, 2004, 28(9): 32−35.
[8] Nallenbecka PC, Benemannb JR. Biological hydrogen production; fundamentals and limiting processes. Int J Hydrogen Energy, 2002, 27: 1185−1193.
[9] Wykoff DD, Davies JP, Melis A, et al. The regulation of photosynthetic electron transport during nutrient deprivation in Chlamydomonas reinhardtii. Plant Physiol, 1998, 117: 129−139.
[10] Melis A, Zhang LP, Forestier M, et al. Sustained photobiological hydrogen gas production upon reversible inactivation of oxygen evolution in the green alga Chlamydomonas reinhardtii. Plant Physiol, 2000, 122: 127−135.
[11] Liang Y, Jin YM, Tian CY. Effects of different nitrogen and phosphorus concentrations on the growth and chlorophyll florescence parameters of Pavloca viridis. Trans Oceanol Limnol, 2008, 1: 120−126.梁英, 金月梅, 田传远. 氮磷浓度对绿色巴夫藻生长及叶绿素荧光参数的影响. 海洋湖沼通报, 2008, 1: 120−126.
[12] Han GY, Li SQ, Tang CQ, et al. Progress on the structure of photosynthetic oxygen evolving complex and the mechanism of photosynthetic water oxidation. Prog Chem, 2004, 16(2): 184−193.韩广业, 李淑芹, 唐崇钦, 等. 光合放氧复合物结构及其放氧机理的研究. 化学进展, 2004, 16(2): 184−193.
[13] He LJ, Lei LM, Han BP, et al. Effects of sulfur and pH on photo-hydrogen production of the green alga Chlorella pyrenoidosa. J Trop Subtrop Bot, 2007, 15(6): 487−492.贺立静, 雷腊梅, 韩博平, 等. 硫和pH对蛋白核小球藻光照产氢的影响. 热带亚热带植物学报, 2007, 15(6): 487−492.
[14] Haris EH. The Chlamydomonas Sourcebook: A comprehensive Guide to Biology and Laboratory Use. San Diego: Academic Press, 1989: 575−580.
[15] Drath M, Kloft N, Batschauer A, et al. Ammonia triggers photodamage of photosystem II in the Cyanobacterium synechocystis sp. strain PCC 68031. Plant Physiol, 2008, 147: 206−215.
[16] Azov Y. Effect of pH on inorganic carbon uptake in algal cultures. Appl Environ Microbiol, 1982, 43(6): 1300−1306.
[17] Timmins M, Thomsa-Hall SR, Darling A, et al. Phylogenetic and molecular analysis of hydrogen producting green algae. Exp Bot, 2009, 60(6): 1691−1702.
[18] Erica B, Beardall J. Rapid ammonium and nitrate induced perturbations to Chla fluorescence in nitrogen-stressed Danaliella tertiolecta (Chloroyhyta). J Phycol, 2003, 39: 897−905.
[19] Cournac L, Mus F, Bernard L, et al. Limiting steps of hydrogen production in Chamydomonas reinhardtii and Synechocystis PCC 6803 as analysed by light-induced gas exchange transients. Int J Hydrogen Energy, 2002, 27: 1229−1237.
[20] Hase E, Otsuka H, Mihara S, et al. Role of sulfur in the cell division of Chlorella, studied by the technique of synchronous culture. Biochim Biophys Acta, 1959, 35: 180−189.
[21] Zhang LP, Happe T, Melis A. Biochemistry and morphological characterization of sulfur-deprived and H2-production Chamydomonas reinhardtii (green algae). Planta, 2002, 214: 552−561.
[22] Markov SA, Eivazova ER, Greenwood J. Photostimulation of H2production in the green alga Chlamydomonas reinhardtii upon photoinhibition of its O2-evolving system. Int J Hydrogen Energy, 2006, 31: 1314−1317.
