非致病性小肠结肠炎耶尔森菌ail基因克隆菌株的构建及其侵袭性研究
2011-01-24吉芳坤李中杰邱海燕肖玉春景怀琦段广才
吉芳坤 ,李中杰 ,邱海燕,肖玉春,景怀琦,段广才,王 鑫
小肠结肠炎耶尔森菌病是一种新的肠道传染病,呈世界性分布,是欧洲一些国家腹泻的主要病原,这些地区耶尔森菌引起的胃肠炎和严重腹泻比痢疾还多。1981年我国发现此病后,开展过全国性调查研究,分别从人群、动物和外环境分离出病原菌,证明耶尔森菌在我国的分布非常广泛[1]。小肠结肠炎耶尔森菌感染已经成为一个危害公众健康的严重问题,尤其与儿童肠道疾病密切相关,主要系通过与感染动物粪便接触或摄取被污染的食物感染,人类感染耶尔森菌后可表现出一系列不同症状,如:腹泻、肠系膜淋巴结炎、假阑尾炎、慢性回肠炎,严重者可导致败血症[2]。
组织侵袭和细胞内寄生是致病菌毒力机制的重要特征,尤其对于肠道致病菌来说显得更加重要[3]。目前已在小肠结肠炎耶尔森菌和假结核耶尔森菌中确定了3种侵袭相关基因:侵袭素基因(invasin,inv),粘附侵袭位点基因(attachment invasion locus,ail)和耶尔森菌粘附素A基因(yadA)。inv和ail基因都是在染色体上编码的,而yadA基因是由耶尔森菌的毒力质粒编码[4-5]。耶尔森菌的侵袭性主要还是由染色体基因决定的,因为当菌株的毒力质粒丢失时仍然具有侵袭性,而将毒力质粒转入非致病菌株后,并不能赋予其侵袭粘附的功能[6]。黄瑛等人通过对中国地区271株致病性小肠结肠炎耶尔森菌和12株参考株的ail基因进行序列分析,将ail基因序列分为3种序列型:高致病株(1b/O∶8)来源的A2型;低致病株(2/O∶9)来源的A1型;新发现序列型 A3型。分离自宁夏地区的致病株IE419(2/O∶9)单独形成的A3型有可能是A1型的突变株,其核酸序列已提交到 GenBank,序列号为 GU72220[7]。为确定新发现A3序列型ail基因在粘附侵袭能力上是否出现改变以及不同序列型ail基因的粘附侵袭功能是否存在差异,我们将3种序列型ail基因转入非致病性小肠结肠炎耶尔森菌中,通过体外组织粘附侵袭实验和其他分子生物学技术进行详细分析。
1 材料与方法
1.1 材料
1.1.1 菌株标本 代表3种不同序列型ail基因的致病性小肠结肠炎耶尔森菌:A2型代表菌株 Ye92010(1b/O∶8);A1型代表菌株 HA8629(2/O∶9);A3型代表菌株 IE419(2/O∶9)。Ye92010是从一名日本临床腹泻病人粪便标本中分离出的致病株;HA8629是在中国河南地区从腹泻病人标本中分离出来的致病株;IE419则是从中国宁夏地区鼠中分离出来的致病株。Y40是在中国江苏地区猪中分离出来的非致病株,为1A/O∶8生物血清型。
1.1.2 组织细胞 HEp-2细胞,人类喉癌上皮细胞;HT-29细胞,人类结肠癌上皮细胞。均来自本实验室。
1.1.3 质粒,感受态细胞 克隆质粒pMD18-T和JM109感受态细胞均购自 TaKaRa公司。质粒pMD18-T结构图见图1。
1.1.4 引物合成和DNA测序 引物以O∶8血清型致病性小肠结肠炎耶尔森菌的ail基因核酸序列为参考设计。重组质粒DNA测序由大连(宝生物)公司完成。

图1 pMD18-T质粒图谱Fig.1 Map of vectorpMD18-T
1.2 方法
1.2.1ail基因的克隆表达 根据已获得的O∶8血清型致病性小肠结肠炎耶尔森菌的ail基因的编码序列设计引物:
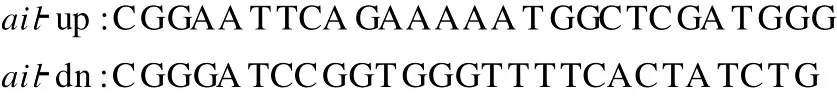
通过PCR扩增3种不同代表菌株 Ye92010(1b/O∶8)、HA8629(2/O∶9)、IE419(2/O ∶9)的ail基因,并转化大肠杆菌JM109。通过α-互补蓝白斑筛选阳性克隆,将经鉴定正确连接的重组质粒通过高压电穿孔仪转入非致病性小肠结肠炎耶尔森菌 Y40。克隆菌株经 IPTG诱导表达后,制备成电泳样品进行SDS-PAGE电泳分析。
1.2.2 体外组织细胞粘附侵袭实验 将培养至单层细胞的HEP-2和 HT-29细胞以0.25%胰酶(Hyclone)消化后通过细胞计数适度稀释使其浓度约为1.0×105cfu/mL。稀释后的细胞悬液在24孔细胞板中再次培养至单层细胞后以PBS清洗,分别加入800μL不含抗生素的MEM和1640培养液,并加入200μL预先备好的菌液(2.0×107cfu/mL)。作用4.5h后,以0.5%脱氧胆石酸钠充分裂解细胞以释放粘附在细胞表面和侵入到细胞内部的细菌。将裂解液适度稀释后涂板计数,并对初始菌量也进行计数。粘附效率以如下表示:涂板计数剩余的菌落数/初始菌量×100。涂板计数剩余的菌落数包括细胞周围粘附的细菌和侵入细胞内的细菌。同样地,侵袭效率可以如下公式表示:庆大霉素处理后剩余菌落数/初始菌量×100[8-9]。将作用4.5h后的细胞以 PBS清洗后,分别加入含庆大霉素(20μg/mL)的 MEM和 1640培养液,再次培养4h之后可由上述公式计算出其侵袭效率。
1.2.3 显微镜下形态学特征分析 被感染细胞以 PBS清洗后固定,Giemsa染液染色后,通过倒置显微镜(Olympus)观察不同菌株对细胞的粘附侵袭状况,放大倍数为10×40。
1.2.4 RT-PCR 提取各致病性小肠结肠炎耶尔森菌和克隆菌株的总RNA,经逆转录合成DNA。通过1%的琼脂糖凝胶电泳检测克隆菌株中的ail基因是否在受体菌中成功转录。
2 结 果
2.1ail基因的克隆表达
2.1.1 原核重组质粒的鉴定 对获得的克隆菌株进行PCR鉴定,显示各克隆菌株在1000bp左右的位置有一清晰的条带,与目的基因的大小基本相符,证明重组质粒构建成功,见图2。送往 TA KARA公司测序后显示序列连接正确,实验中所构建的克隆菌株见表1。

图2 PCR扩增目的片段 ail基因1-Marker依次为:Ye92010、HA8629、IE419、Y40、Y40-Y、Y40-H、Y40-I、阳性对照、MarkerFig.2 Amplification of the strains by PCR

表1 实验中构建的重组克隆菌株Table 1 Recombinant colonies constructed in this study
2.1.2 RT-PCR 提取小肠结肠炎耶尔森菌和克隆菌株的总 RNA,逆转录合成DNA,并以DNA为模板扩增而来的各PCR产物为阳性对照,确定克隆菌株中的ail基因成功转录。结果见图3。
2.2 组织细胞粘附侵袭实验:ail基因可以使原先无粘附侵袭特性的大肠杆菌表现出粘附侵袭的功能[10-11],因而ail基因序列的多态性可能会对其粘附侵袭功能产生影响,分别检测3种类型阳性克隆菌株对HEP-2 and HT-29细胞粘附侵袭特性。结果见表2。
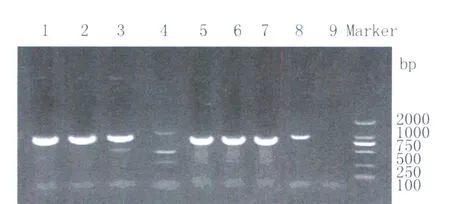
图3 RT-PCR扩增目的片段 ail基因1-Marker依次为:Ye92010、HA8629、IE419、Y40、Y40-Y、Y40-H、Y40-I、Ye92010(2)、空白对照、MarkerFig.3 Amplification of the strains by RT-PCR
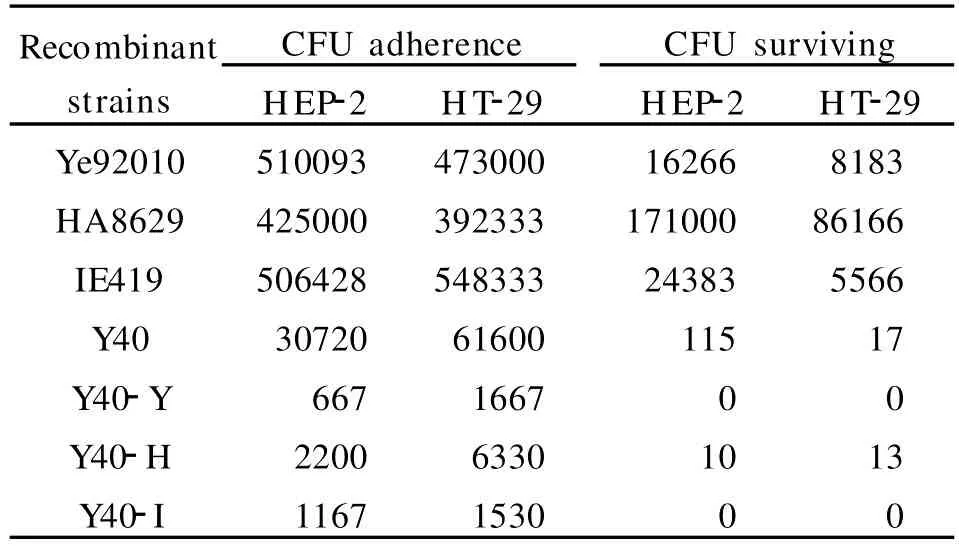
表2 重组克隆菌株对组织细胞的粘附性和侵袭性Table 2 Adhesion and invasion of recombinant strains to cultured cells
上表数据经spss17.0统计软件分析,结果显示:3种类型的克隆菌株在获得致病性菌株中的ail基因后,未表现出粘附侵袭的能力,且其固有的非特异性粘附功能出现了有统计学意义的下降。进一步做侵袭性实验后,显示阳性对照 Ye92010、HA8629、IE419,阴性对照 Y40,Y40转化克隆菌株3组之中克隆菌株与阴性对照之间无差异,两组数据与阳性对照间均存在明显差异。这说明将ail基因转入已证实无粘附侵袭性的非致病性小肠结肠炎耶尔森菌后,对其侵袭特性无明显影响,但却降低了其粘附效能。且观察3个阳性对照的数据,可发现HA8629的菌落侵袭水平明显高于 Ye92010和IE419,可能 HA8629是抗庆大霉素的耐药株。
2.3 显微镜下形态学特征分析 镜下观察不同菌株对细胞的粘附侵袭作用,见图4。
由下图可观察到:Ye92010细菌延细胞边缘走向清晰可见,排列成链状或杆状,HA8629、IE419镜下排列形态与 Ye92010基本一致,但是菌量较少。非致病性小肠结肠炎耶尔森菌阴性对照株 Y40背景清晰,菌少见。3种重组克隆菌株与非致病性阴性对照菌株 Y40保持一致,形态学上无差异。
3 讨 论
ail基因的核酸序列包含一个536bp的开放读码框架(ORF),编码一条由178个氨基酸组成的多肽,分子量为19 548Da[12]。此蛋白可以赋予小肠结肠炎耶尔森菌侵入上皮细胞的能力。体外组织侵袭实验显示,依据细胞种属的不同,Ail蛋白侵入细胞的能力有一定程度的差异,但是都可以较高水平的显示粘附的特性[8]。此外,还具有血清抵抗能力[10]。目前研究已经证实粘附侵袭位点基因(ail),只存在于流行病学上与疾病相关的致病性小肠结肠炎耶尔森菌中,而inv基因在耶尔森菌属其他种中也存在,这种结果显示ail基因可能在致病机制中起到更重要的作用,假结核耶尔森菌inv突变株感染小鼠模型证实了这种猜想[11]。来自高致病株8081c(1b/O∶8)的ail基因的转入可以赋予大肠杆菌粘附侵袭上皮细胞的功能,并且克隆菌株抵抗血清杀伤的能力可以达到大肠杆菌本菌的100倍以上[13]。
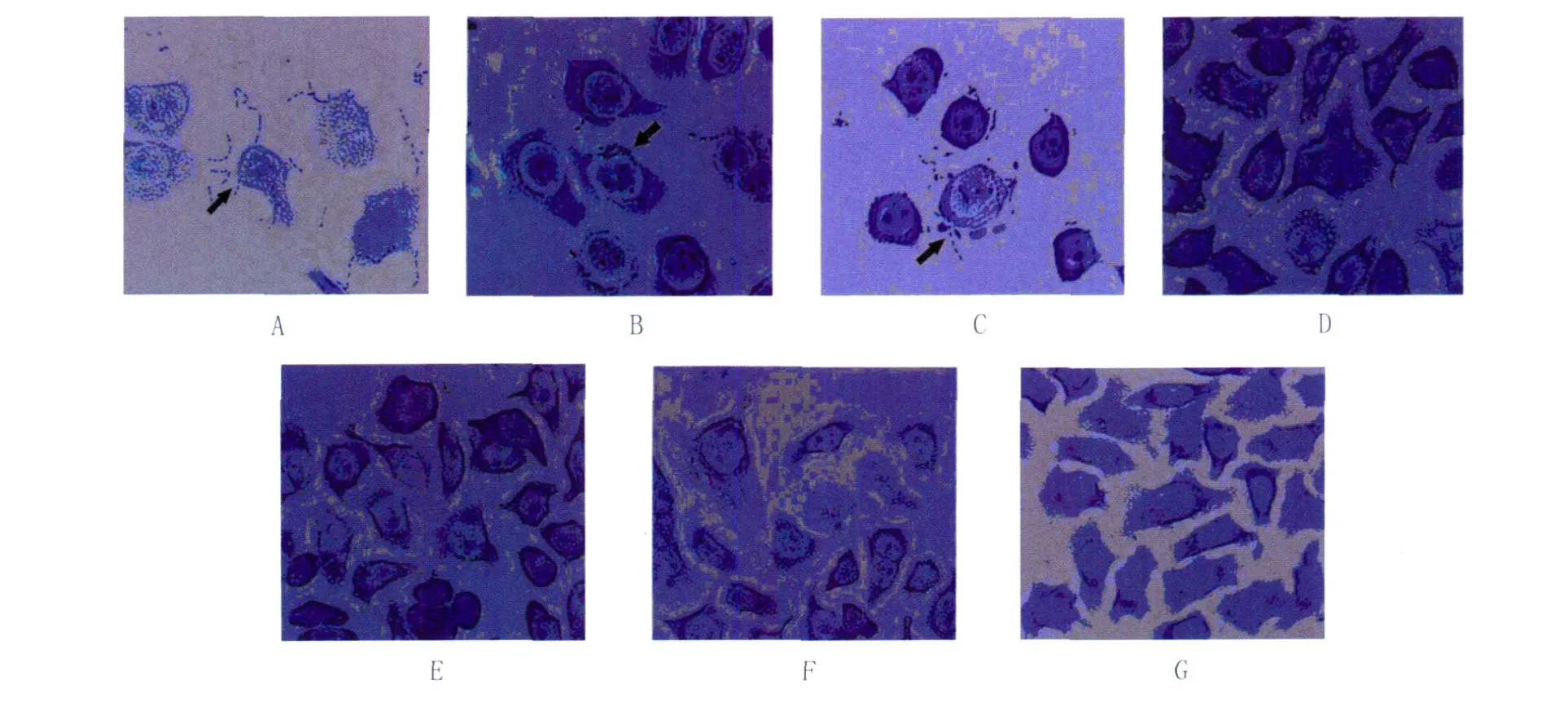
图4 不同菌株对 HEp-2细胞的粘附侵袭实验结果Fig.4 The invasion and adherence assays of the different strains to HEp-2 cellA:Ye92010,B:HA8629,C:IE419,D:Y40,E:Y40-Y,F:Y40-H,G:Y40-I
大部分流行病学上与疾病无关的非致病性小肠结肠炎耶尔森菌均缺乏对组织细胞的粘附侵袭作用[5,14]。曾有学者对转入ail基因后的非致病性小肠结肠炎耶尔森菌的侵袭性进行过研究,将有功能的ail基因整合到致病性ail突变菌株或E.coli菌株时均可以赋予受体菌侵袭的表型,而转入非致病性菌株中时并无相应的功能表型,其认为大肠杆菌与非致病性小肠结肠耶尔森的细胞背景不同,推测在非致病性菌株中可能缺乏一种和Ail蛋白协同作用的因子[10],同时,因为ail基因只存在于致病性小肠结肠炎耶尔森菌中,在非致病性小肠结肠炎耶尔森菌中缺乏ail基因的同源序列[8],转化后致病性ail突变菌株侵袭功能的重现和非致病性菌株中侵袭功能的持续缺失意味着在非致病性小肠结肠炎耶尔森菌表面结构上可能存在着某种影响重组Ail蛋白与组织细胞作用的因素,最终导致了克隆菌株中侵袭功能的不表达。而对于本次试验中克隆菌株非特异粘附效能的降低,有可能是ail基因的转入改变了非致病性小肠结肠炎耶尔森菌膜表面某些介导非特异性粘附功能的因子的表达或者重组Ail蛋白对非致病耶尔森菌表面介导非特异性粘附功能的因子产生了影响,而出现了整体非特异粘附效能的下降,在侵袭功能上两者则保持了一致性。因为耶尔森菌对机体细胞的侵袭是一个分为粘附和侵袭的两步过程,侵入细胞内的细菌是先通过粘附作用与细胞相互影响进而进入细胞内并与细胞外细菌共同作用致机体患病的[12]。以ail基因突变菌株感染小鼠后,检测病原菌向 Peyer结和其他组织器官迁移以及引起致死性感染的能力,结果显示,突变株没有产生可检测到的Ail蛋白,与野生株相比对CHO细胞的侵袭作用降低[15];Ail蛋白在感染疾病的早期,也就是粘附侵袭阶段起着重要的作用[8,10,15]。感染初期,介导的黏附表型的ail基因的缺失,有可能是非致病性小肠结肠炎耶尔森菌致病毒力缺失的一个重要因素。
综上所述,3种不同序列型ail基因转入非致病性小肠结肠炎耶尔森菌后,并未赋予其粘附侵袭的功能,有待于进一步研究分析3种序列型ail基因在粘附侵袭功能上的差异。但在本次研究中关于非致病性小肠结肠炎耶尔森菌ail基因转化克隆菌株的粘附性能反常性降低的发现,将有助于我们更加明确致病性耶尔森菌与宿主细胞之间的相互作用,阐明其粘附侵袭机制及致病机理。
[1]于恩庶.中国小肠结肠炎耶尔森菌病研究进展[J].中国流行病学杂志,2000,21(6):453-455.
[2]Hoogkamp-Korstanje JA.Yersinia inf ections[J].Ned Tijdschr Geneeskd,1996,140(3):128-130.
[3]Butzler J P,Cvjetanovic B,et al.Enteric infections due toCampylobacter,Yersinia,salmonella,and Shigella[J].Bull World Health Orgen,1980,58(4):519-537.
[4]Une T.Studies on the pathogenicity ofYersinia enterocolitica.I.Experimental infection in rabbits[J].Microbiol Immunol,1977,21(7):349-363.
[5]Miller VL,Farmer JJ3rd,Hill WE,et al.Theaillocus is found uniquely inYersinia enterocoliticaserotypes commonly associated with disease[J].Infect Immun,1989,57:121-131.
[6]Heeseman J,Laufs R.Construction of a mobilizableYersinia enterocoliticavirulence plasmid[J].JBacteriol,1983,155:761-767.
[7]Huan Y,Wang X,Cui Z,et al.Possible use ofailand foxA polymorphisms for detecting pathofenicYersinia enterocolitica[J].BMC Microbiology,2010,10:211.
[8]Miller VL,Falkow S.Evidence for two genetic loci inYersinia enterocoliticathat can promote invasion of epithelial cells[J].Infect Immun,1988,56:1242-1248.
[9]Di Biase AM,Petrone G,Conte MP,et al.Infection of human enterocyte-like cells with rotavirus enhances invasiveness ofYersinia enterocolitica andY.pseudotuberculosis[J].J Med Microbiol,2000,49:897-904.
[10]Pierson DE,Falkow S.Theailgene ofYersinia enterocoliticahas a role in the ability of the organism to survive serum killing[J].Infect Immun,1993,61:1846-1852.
[11]Rosqvist R,Skurnik M,Wolf-Watz H.Increased virulence ofYersinia pseudotuberculosis by two independent mutations[J].Nature(London),1988,334:522-525.
[12]Miller VL,Bliska JB,Falkow S.Nucleotide sequence of theYersinia enterocolitica ailgene and characterization of the Ail protein product[J].J Bacteriol,1990,172:1062-1069.
[13]Bliska J,Falkow S.Bacterial resistance to complement killing mediated by the Ail protein ofYersinia enterocolitica[J].Proc Natl Acad Sci USA,1992,89:3561-3565.
[14]Pierson DE,Falkow S.Nonpathogenic isolates ofYersinia enterocoliticado not contain functional inv-homologous sequences[J].Infect Immun,1990,58:1059-1064.
[15]Wachtel MR,Miller VL.In vitro and in viva characterization of an ail mutant ofYersinia enterocolitica[J].Infect Immun,1995,63:2541-2548.
