宁波地区海产品及环境中副溶血弧菌主要毒力及耐药性分析*
2011-01-24吴蓓蓓金培婕方维焕
吴蓓蓓,俞 盈,金培婕,方维焕
副溶血性弧菌(Vibrio parahaemolyticus,Vp)是常见的食物中毒病原菌,它在浙江省细菌性食物中毒中占60%~70%[1]。近年来,副溶血性弧菌食物中毒的发生率呈上升趋势[2],而且,随着食物中毒分离菌耐药性显示,细菌对常用抗菌药物逐渐产生耐药性,这些情况不仅严重威胁人类健康,还危害海水养殖业,给经济带来巨大损失。耐热直接溶血素(TDH)和 TDH-相关溶血素(TRH)被认为是副溶血性弧菌主要致病因子[3]。一般临床分离株均可产生与 TDH有关[4]的神奈川现象,而环境分离株很少呈现 KP阳性,但只要携带tdh或trh基因就可认为是毒力株[3]。部分副溶血性弧菌临床分离株产生引起乳鼠肠液蓄积的尿素酶[5],ureC基因是尿素酶基因簇中最稳定的结构基因。近期,研究发现另外的毒力因子——Ⅲ型分泌系统(T3SS)和Ⅵ型分泌系统(T6SS),T3SS与细胞毒性和肠毒性有关[6],T6SS与霍乱弧菌的致病性有关[7],但其究竟是否贡献副溶血性弧菌的致病力以及在副溶血性弧菌中的分布情况如何,还有待进一步的研究。
四环素类药物被美国CDC推荐[8]为弧菌严重感染时首选抗菌药物,其替代治疗方案是联合使用广谱头孢菌素类药物和多西环素或单独使用氟喹诺酮类药物,不允许使用多西环素及氟喹诺酮类药物的儿童可使用复方新诺明及氨基糖苷类药物。但是随着抗菌药物的广泛使用及滥用,越来越多副溶血性弧菌分离株显示对以上药物耐药,这为副溶血性弧菌感染的治疗带来极大困难,威胁人类健康。
本研究对浙江宁波地区海产品和养殖环境中的副溶血性弧菌分离株进行主要毒力相关基因、毒力表型及抗菌药物敏感性与耐药基因检测。
1 材料与方法
1.1 材料
1.1.1 菌株来源 2007年,赴宁波地区海产品养殖场进行系统的样品采集,收集样本115份,包括鱼类、贝类、南美白对虾与蟹类等经济海产品及养殖塘底泥和水。按国标法进行细菌分离[9]。经 PCR鉴定的90株副溶血性弧菌由本实验室保存;参考株ZS91、J R1由实验室保存;质控菌大肠埃希氏菌ATCC 25922由中国农业大学动物医学院药理及毒理研究室惠赠。
1.1.2 试剂Taq酶、10×PCR buffer、4×dNTP均购自北京鼎国生物技术有限责任公司;碱性蛋白胨水、TCBS琼脂培养基购自北京陆桥生物技术有限公司;莪妻氏琼脂培养基、尿素酶琼脂基础购自中国进出口商品检验技术研究所北京陆桥技术有限责任公司;抗菌药物标准品购自Sigma公司。
1.2 神奈川溶血试验将供试菌株在含3%NaCl的LB培养基中振荡培养至对数生长期,取10μL培养液加在莪妻氏琼脂培养基中培养24 h,判定是否呈β溶血。
1.3尿素酶试验 为提高检测效率,采用96孔板细菌培养法检测尿素酶表型。将供试菌株接种到含3%NaCl的LB液体培养基中37℃振荡培养10 h,取20μL培养液于尿素酶琼脂培养基(96孔培养板)中,每孔加入100μL灭菌的液体石蜡,培养24 h,观察培养基是否变色,呈玫瑰红色为阳性。
1.4 细菌基因组DNA的提取 参照Abolmaay改良方法[10]提取供试株细菌基因组DNA备用。
1.5 副溶血性弧菌主要毒力基因及耐药基因的PCR扩增 采用本实验室建立的各种毒力基因PCR检测体系,所用引物见表1。主要毒力基因及耐药基因的扩增均在30μL反应体系中进行,含1×PCR buffer,1.5 mmol/L MgCl2,0.16 mmol/L dNTPs,0.83μmol/L相应引物,47 U/mlTaq酶及3.3μL模板DNA。扩增条件为:95℃5 min;94℃45 s,58℃40 s,72℃50 s,30个循环 ;72℃10 min。trh基因采用巢式PCR法扩增,其中取1μL第一轮PCR产物作为第二轮PCR的模板,扩增条件均为:94℃3 min;94℃1 min,58℃50 s,72℃50 s,30个循环;72℃5 min。扩增产物用1%琼脂糖凝胶电泳检测,在凝胶成像系统下拍照成像。
1.6 副溶血性弧菌抗菌药物敏感性试验 将WHO推荐的肉汤微量稀释法进行改进,在96孔细菌培养板上进行倍比稀释,提高试验效率。判断标准参照美国临床实验室标准委员会(CLSI)标准[11]。每种药物两个平行,以大肠埃希菌ATCC 25922为质控菌。
2 结 果
2.1 副溶血性弧菌毒力表型及毒力相关基因检测结果
2.1.1副溶血性弧菌的溶血与尿素酶表型 90株副溶血性弧菌分离株中,KP现象除两株为阳性外其余均阴性,神奈川溶血试验部分结果见图1。尿素酶试验结果显示,在90株副溶血性弧菌分离株中尿素酶表型阳性仅有2株(2.2%),尿素酶试验部分结果见图2。

图1 副溶血弧菌环境分离株在莪妻氏培养基上呈现β-溶血环Fig.1 V.parahaemolyticusisolates from environment showed clearβ-hemolysin zone on Wagatsuma agar medium
2.1.2 毒力相关基因检测 对海产品和环境分离株的毒力基因进行了检测,90株分离株中,tdh、trh和ureC基因阳性株率分别为 2.2%、20%和12.2%,tdh+-trh+菌株占 1.1%。在 2株tdh+菌株中,未扩增到vscC2基因,在17株tdh--trh+菌株中亦未检测到vscC2基因,所有菌株中均未扩增到vscD2基因,只在61.1%(11/18)的trh+菌株中扩增出ureC基因,Ⅵ型分泌系统vp1408的检出率为17.8%。
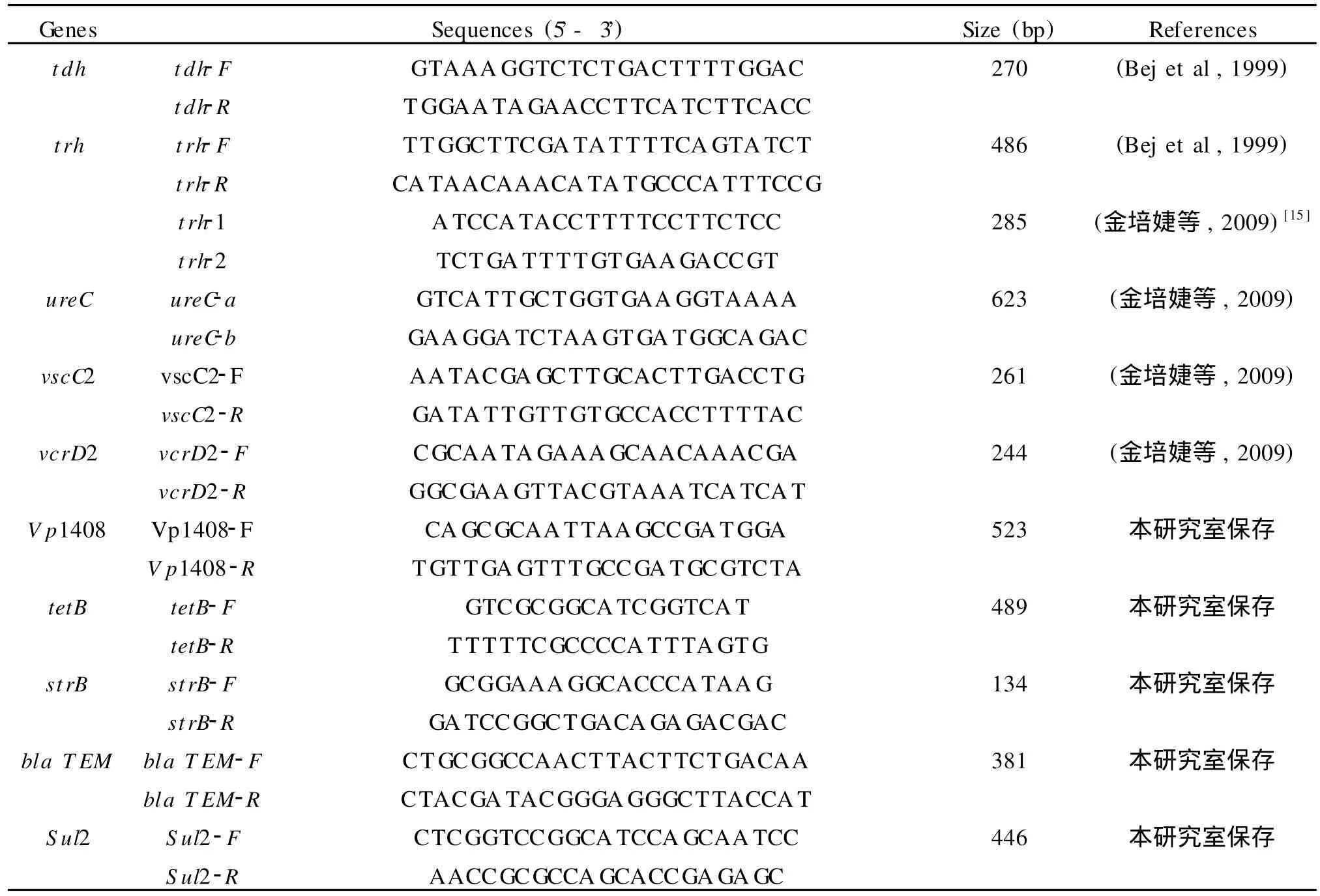
表1 PCR反应引物对、预扩增片段长度列表Table 1 List of PCR primers and amplicon sizes

图2 尿素酶表型图示Fig.2 Urease test of severalV.parahaemolyticus
2.2 副溶血分离菌体外抗菌药物敏感性试验 采用肉汤微量稀释法,对宁波分离的90株副溶血性弧菌复苏进行20种抗菌药物的药物敏感性试验,其中2株分离株未复苏成功,结果见表2。所有分离菌对氟喹诺酮类(诺氟沙星、氧氟沙星、环丙沙星、恩诺沙星)、氯霉素类(氯霉素、氟苯尼考)和四环素类药物敏感。对其他种类抗生素均呈不同程度的耐药,总体而言,超过95%的细菌对青霉素类、磺胺类药物耐药,对氨基糖苷类中链霉素和卡那霉素耐药率分别为72.7%和88.6%,对其他抗生素的耐药率相对较低。因此,宁波地区发生副溶血性弧菌感染时应尽量避免使用磺胺类药物、卡那霉素及链霉素,可选择性使用四环素类药物、氟喹诺酮类药物及氨基糖苷类药物中的阿米卡星或庆大霉素等。
88株副溶血性弧菌对20种抗菌药物多重耐药情况见图3。从图中可以看出,副溶血性弧菌的多重耐药情况比较严重,无对20种药物都敏感的菌株和单药耐药菌株,最多耐药10种,最少耐药2种,6耐以上的超过82%。其中,耐磺胺类药物的细菌占100%,耐磺胺类、青霉素类药物的有83株细菌,占所有菌株的94.3%,没有对磺胺类、头孢类、氨基糖苷类和四环素类药物均耐药的菌株,但对磺胺类、头孢类和氨基糖苷类耐药的80株,占所有菌株的90.9%,同时对氟喹诺酮类、氨基苷类、青霉素类、头孢类、磺胺类等都产生耐药性的耐药谱也存在。
2.3 副溶血性弧菌主要耐药基因检测结果 实验室建立了副溶血性弧菌主要耐药基因的检测体系,对宁波地区海产品和环境的副溶血性弧菌分离株磺胺类、头孢类、氨基糖苷类和四环素类药物的主要耐药基因进行检测,部分结果见图4。88株分离株耐药基因的普查显示,四环素类耐药基因tetB的检测率为0,头孢类耐药基因bla T EM的携带率为91.7%,磺胺类sul2和氨基糖苷类strB的检测率分别为16.7%和43.3%;其中,均不携带这4种耐药基因的分离菌有1株,至少携带1种耐药基因的46株,占52.2%,携带2种和3种耐药基因的分别占36.4%(32株)和10.2%(9株)。
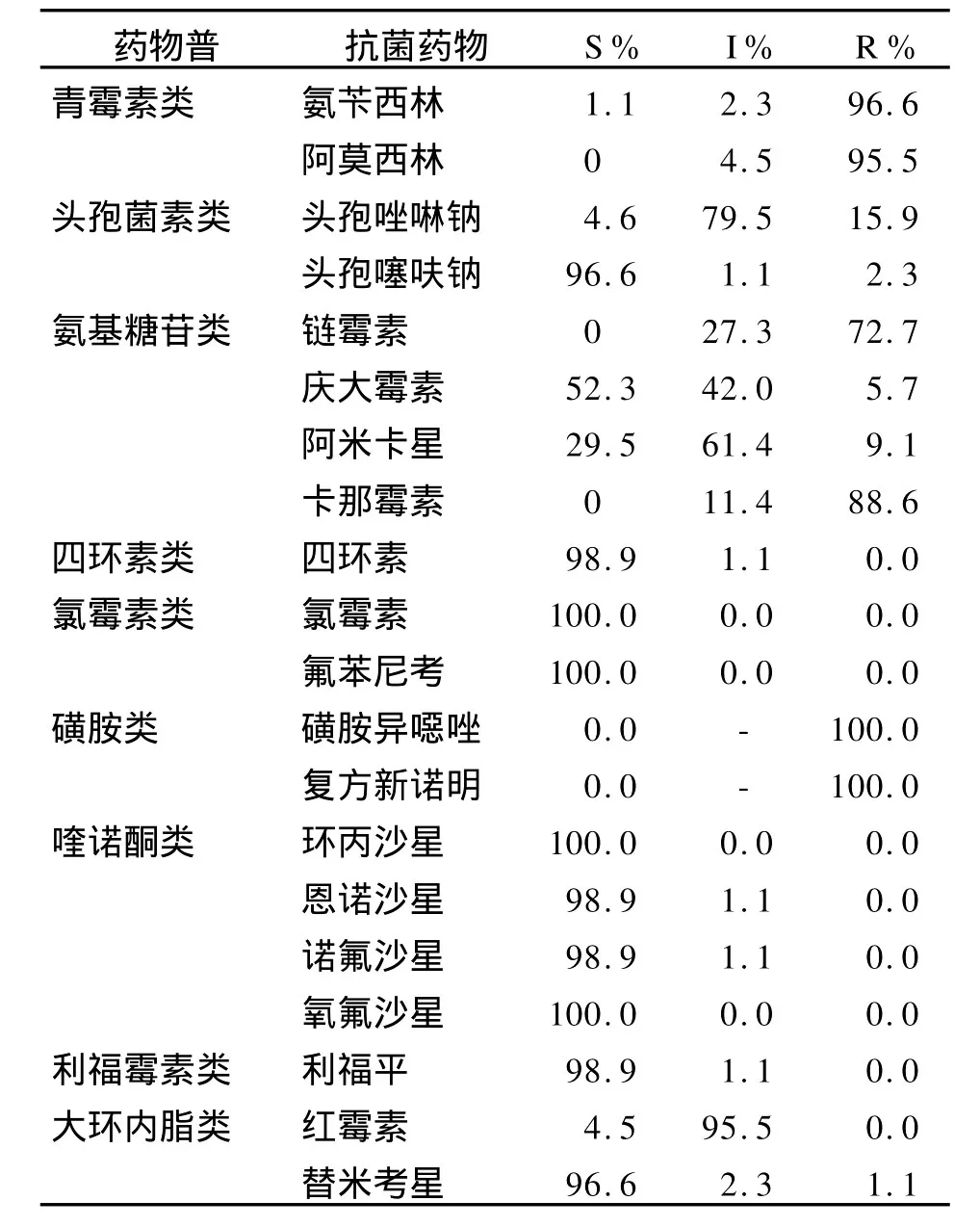
表2 宁波88株副溶血弧菌对抗菌药物敏感性试验Table 2 Antimicrobials susceptibility tests ofV.parahaemolyticusisolates from Nningbo
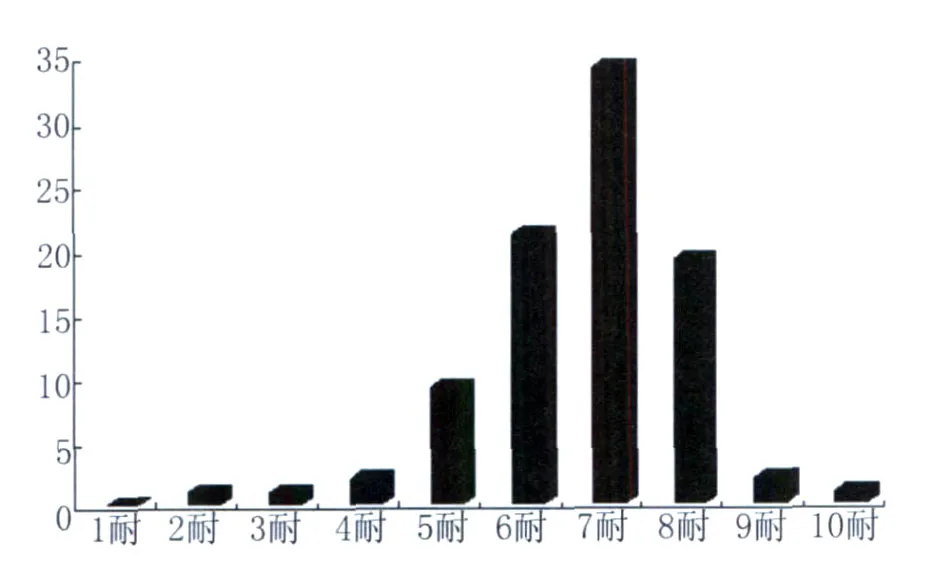
图3 宁波地区副溶血弧菌对20种药物的多重耐药情况Fig.3 Multi-drug resistance to Vibrio parahaemolyticus isolates from sea-foods and environment in Ningbo
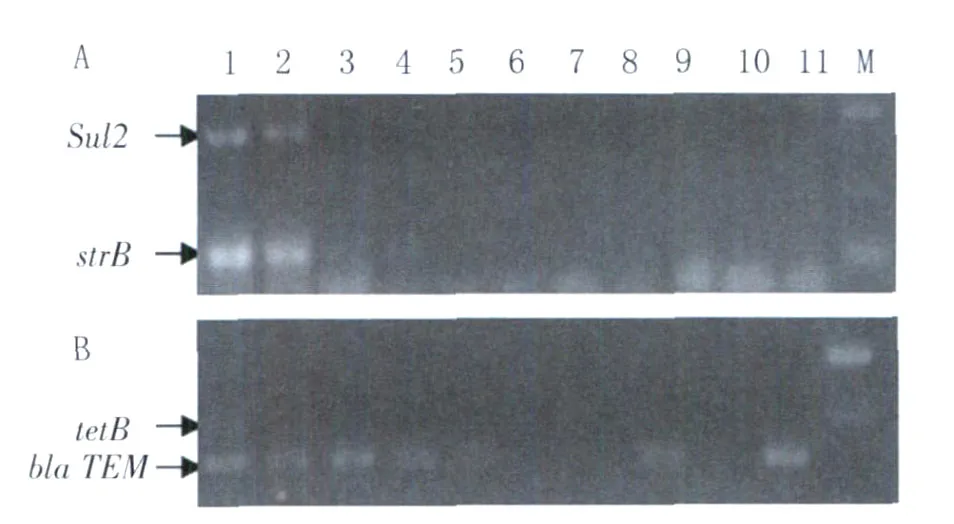
图4 部分副溶血弧菌海产品及环境分离株主要耐药基因的PCR检测A:sul2 andstrB基因电泳图M:DL2000 Marker;1:1:ZS91对照;2-11:部分检测样本;B:tetB and bla TEM g基因电泳图 M:DL2000;1:JR1对照;2-11:部分检测样本Fig.4 PCR identification of antibiotics resistance genes in several representativeV.parahaemolyticusisolatesA:sul2 andstrB genes M:DL2000;Lanes 1:ZS91;2-11:sea-foods and environment samples;B:tetB and bla TEM genes M:DL2000;Lanes 1:JR1;2-11:sea-foods and environment samples
3 讨 论
本实验室对浙江省沿海地区副溶血性弧菌的普查结果显示该菌广泛存在于海产品及其养殖环境中,2007年宁波地区的检出率达87%,从88株副溶血性弧菌环境分离株毒力相关基因检出情况来看,3个主要毒力基因tdh、trh和ureC的携带率分别达到2.2%、20%和12.2%,且有1株同时携带这3种基因,携带率与国外报道基本一致[12-13]。此外,所有检测菌株tdh基因型与 KP溶血表型一致,tdh-菌株的溶血表型阴性;2株tdh+的分离株 KP溶血表型阳性。tdh和 KP阳性菌株未检测到 T3SS2基因簇中外膜蛋白基因vscC2,亦未检测到内膜蛋白基因vcrD2,这与国外研究人员Makino等[6]提出的T3SS2存在于 KP阳性副溶血性弧菌中的观点不符,现象提示 T3SS2在海产品及环境分离株与临床株之间的基因结构可能存在差异,这种差异及其相关基因的功能本实验室正在进一步研究。在18株trh+分离株中只有 11株携带尿素酶结构基因ureC,但11株trh+-ureC+菌株并未显示尿素酶阳性,而2株尿素酶阳性的细菌亦未携带trh或ureC基因,结果说明菌株是否携带trh或ureC基因与其尿素酶表型是否阳性之间无必然联系。Ⅵ型分泌系统在霍乱弧菌中研究较多,与其致病性有关,2002年,Tagomori等[14]发现Ⅵ型分泌系统也存在于副溶血性弧菌 RIMD2210633的染色体Ⅰ上,基因编码为V P1386到V P1420。宁波地区海产品及环境副溶血性弧菌分离株中V p1408基因的调查显示其检出率为17.8%,说明Ⅵ型分泌系统在宁波地区副溶血性弧菌中的分布较广泛,但其究竟是否贡献副溶血性弧菌的致病力,本实验室正在研究。
副溶血性弧菌随着药物的广泛使用,耐药性越来越严重。2007年的宁波地区副溶血性弧菌分离株对喹诺酮类(诺氟沙星、氧氟沙星、环丙沙星、恩诺沙星)、氯霉素类(氯霉素、氟苯尼考)、四环素、头孢噻呋钠等药物敏感。对其他种类抗生素均呈不同程度的耐药,对青霉素类、磺胺类药物耐药率极高,超过95%。多重耐药情况比较严重,集中在6耐、7耐和8耐。耐药谱较窄,以耐磺胺类、青霉素类药物为主,占所有菌株的94.3%,没有对所有各类抗菌药物均耐药的细菌,也没有对美国CDC推荐使用各种抗菌药物(磺胺类、头孢类、氨基糖苷类和四环素类药物)均耐药的菌株,但对磺胺类、头孢类和氨基糖苷类耐药的有80株,占所有菌株的90.9%,对氟喹诺酮类、氨基苷类、青霉素类、头孢类、磺胺类等都产生耐药性的耐药谱也存在。因此,宁波地区发生副溶血性弧菌感染时应尽量避免使用磺胺类药物、卡那霉素及链霉素,可选择性使用四环素类药物、氟喹诺酮类药物及氨基糖苷类药物中的阿米卡星或庆大霉素等。
国内外对副溶血性弧菌耐药基因的研究很少,但对霍乱弧菌的耐药研究较多,鉴于霍乱弧菌和副溶血性弧菌同属,针对已报道霍乱弧菌对氨基苷类、头孢类、磺胺类和四环素类药物耐药的耐药基因,tetB基因能贡献细菌对四环素耐药,bla T EM基因贡献对青霉素类和头孢菌素类耐药,sul2和strB分别耐磺胺甲恶唑和链霉素。设计以上耐药基因引物,分别对88株分离株进行耐药基因普查。实验结果显示,四环素类耐药基因tetB的检测率为0,这与宁波地区分离菌对四环素的耐药表型完全一致;头孢类耐药基因bla T EM的携带率为91.7%,副溶血性弧菌对第一代头孢菌素类药物头孢唑啉中度耐药和耐药的占细菌的95.4%,对头孢唑啉高度耐药的均携带bla T EM基因,中度耐药的基本携带该基因,说明副溶血性弧菌中还有其他耐药基因贡献对头孢唑啉的耐药性,也有携带基因但对头孢唑啉敏感的分离菌,结果提示bla T EM对细菌的耐药性可能存在基因调控;磺胺类sul2和氨基糖苷类strB的检测率分别为16.7%和43.3%,结果说明还有其他耐药基因贡献对复方新诺明及链霉素耐药,究竟还有哪些耐药基因贡献细菌对头孢菌素类、磺胺类及链霉素耐药,还需要进一步研究。
[1]程苏云,梅玲玲,任锦玉,等.副溶血性弧菌质粒携带及生物学特性研究 [J].中国卫生检验杂志,2006,16(1):102-103.
[2]李晓艳,吕碧锋,潘海晖,等.529例副溶血弧菌中毒分析 [J].现代医药卫生,2008,24(5):778-779.
[3]hirai H,Ito H,Hirayama T,et al.Molecular epidemiologic evidence for association of thermostable direct hemolysin(TDH)and TDH-related hemolysin of Vibrio parahaemolyticus with gastroenteritis[J].Infect Immun,1990,58(11):3568-3573.
[4]Joseph SW,Colwell RR,Kaper JB.Vibrio parahaemolyticus and related halophilic Vibrios[J].Crit Rev Microbiol,1982,10(1):77-124.
[5]Cai Y,Ni Y.Purification,characterization,and pathogenicity of urease produced by Vibrio parahaemolyticus[J].J Clin Lab A-nal,1996,10(2):70-73.
[6]Makino K,Oshima K,Kurokawa K,et al.Genome sequence of Vibrio parahaemolyticus:a pathogenic mechanism distinct from that of V cholerae[J].Lancet,2003,361(9359):743-749.
[7]Pukatzki S,Ma A T,Sturtevant D,et al.Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system[J].Proc Natl Acad Sci USA.2006,103:1528-1533.
[8]Feifei Han,Robert D,Walker,et al.Antimicrobial Susceptibilities of Vibrio parahaemolyticus and Vibrio vulnificus Isolates from Louisiana Gulf and Retail Raw Oysters[J].Applied and Environmental Microbiology.2007,73:7096-7098
[9]Elliot EL,Kaysner CA,Ackson LJ,et al.Bacteriological Annual Manual Online(6th ed.)2001,Chapter.9
[10]Abolmaaty A,Vu C,Oliver J,et al.Development of a new lysis solution for releasing genomic DNA from bacterial cells for DNA amplification by polymerase chain reaction[J].Microbios,2000,101(4):181-189.
[11]National Committee for Clinical Laboratory Standards[J].Performance standards for antimicrobial disk and dilution susceptibility tests for bacteria isolated from animals.2006.Approved standard M31-A.National Committee for Clinical Laboratory Standards,Wayne,Pa.
[12]Hayat Mahmud Z,Kassu A,Mohammad A,et al.Isolation and molecular characterization of toxigenic Vibrio parahaemolyticus from the Kii Channel,Japan[J].Microbiol Res,2006,161(1):25-37.
[13]Raghunath P,Acharya S,Bhanumathi A,et al.Detection and molecular characterization of Vibrio parahaemolyticus isolated from seafood harvested along the southwest coast of India[J].Food Microbiol,2008,25(6):824-830.
[14]Tagomori K,Iida T,Honda,T.Conparison of genome structure of Vibrio,bacteria possessing two chromosomes[J].J Bacterol,2002,184(7):4351-4358.
[15]金培婕,吴蓓蓓,方维焕,等.浙江沿海地区海产品及环境中副溶血弧菌的分离与主要毒力基因分析[J].微生物学通报,2009,36(7):962-967
