耐多药结核分枝杆菌对喹诺酮类药物的耐药性与 gyr基因突变的初步研究*
2011-01-24赵丽丽赵秀芹刘志广万康林
赵丽丽,夏 强,2,赵秀芹,刘志广,万康林
耐药结核病尤其耐多药结核病(至少对异烟肼和利福平耐药)已成为严重的公共卫生问题[1]。我国的耐药结核病流行情况也较为严重,耐多药率为8.32%[2],对于MDR-TB病,目前通常采用二线抗结核药物进行治疗。由于喹诺酮类药物的不良反应小,价格低廉等优点,已被 WHO纳入耐MDR-TB病的临床治疗方案,成为联合治疗MDR-TB的核心药物之一。然而在我国,喹诺酮类药物投入临床时间较长、应用的抗菌范围较广,致使耐药形势日趋严重,因此,深入MDR-TB对喹诺酮类药物的耐药情况非常重要。
喹诺酮类药物主要作用于DNA促旋酶,该酶属于Ⅱ型拓扑异构酶,是由两个A亚基(GyrA)和两个B亚基(GyrB)组成的四聚体,A亚基由gyrA基因编码,可以切断、再结合和超螺旋化DNA链;B亚基由gyrB基因编码,含ATP水解功能区,能促进ATP水解,为A亚基解旋提供能量,DNA促旋酶能在原核细胞DNA复制过程中暂时切断DNA双链,引入负超螺旋结构,使DNA能够有效复制、转录和重组[3];但喹诺酮类药物能与DNA促旋酶作用形成药物-DNA-酶复合物从而抑制DNA促旋酶的活性,阻碍DNA复制,导致细菌死亡。以往的资料表明:gyr基因突变是导致结核分枝杆菌对喹诺酮类药物耐药的主要原因,其中,这些突变位点主要集中于喹诺酮耐药决定区(QRDR),即A亚基的第74-113位氨基酸,B亚基的第495-533位氨基酸[4]。本研究通过DNA直接测序对125株MDRTB临床分离株gyr基因喹诺酮类药物耐药决定区的突变情况进行分析,探讨MDR-TB对喹诺酮类药物耐药产生与gyr基因突变的关系。
1 材料与方法
1.1 标本来源 本试验所涉及的125株MDR-TB临床分离菌株由中国疾病预防控制中心传染病所结核室提供,其中福建77株(2005年31株,2007年23株,2009年23株),河南14株(2005年),四川19株(2006年),西藏15株(2006年)。参照菌株采用标准菌株 H37Rv(ATCC 27294),购于中国药品生物制品检定所。
1.2 药敏试验所用氧氟沙星(Ofloxacin)为Sigma产品,使用时按照厂家提供的纯度和效价计算用量,氧氟沙星在培养基的终浓度为2μg/mL[5]。药敏试验所用培养基的配方、制备,操作步骤和结果判断等均参照《结核病诊断实验室检验规程》[6]。
1.3 DNA制备 采用CTAB法[7],置-20℃保存备用。
1.4 PCR扩增
1.4.1 扩增gyrA基因耐药决定区:所用上游引物为:5’-TCGACTATGCGATGA GCGTG-3’,下游引物为 5’CGATGCGTAAACCGACCC-3’,扩增片段长度为860bp,涵盖编码gyrA的喹诺酮耐药决定区(第74-113位氨基酸)。PCR反应体系总体积为 20μL,其中,2 ×Taq PCR MasterMix 10μL(TIANGEN),DNA 模板 1μL(50 ng),Forward Primer(20 mmol/L)1μL,Reverse Primer(20 mmol/L)1μL,无菌双蒸水7μL;阴性对照反应体系中不加DNA模板,无菌双蒸水8μL,其他不变。反应条件:95℃5 min;95℃30 s,58.5℃30 s,72℃40 s,30次循环;72℃3min。
1.4.2 扩增gyrB基因耐药决定区 所用上游引物为 5’-CCGCTGTGATCTCGGTGAAG-3’,下游引物为5’AGACCCTTGTACCGCTGAATG-3’,扩增片段长度为780bp,涵盖编码gyrB的喹诺酮耐药决定区(第495-533位氨基酸),PCR反应体系总体积为 20μL,其中 ,2 ×Taq PCR MasterMix 10μL(TIAN GEN),DNA 模板 1μL(50 ng),Forward Primer(20 mmol/L)1μL,Reverse Primer(20 mM)1μL,无菌双蒸水 7μL;阴性对照反应体系中不加DNA模板,无菌双蒸水8μL,其他不变。反应条件:95℃5 min;95℃30 s,57℃30 s,72℃40 s,30次循环;72℃3min。
1.5 序列测定 PCR产物送北京擎科生物技术有限公司测序。
1.6 分析方法 使用MegAlign软件对基因测序结果进行分析。
2 结 果
2.1 药敏试验 结果判断参照《结核病诊断实验室检验规程》,根据耐药百分比判别[6]:耐药百分比=(含药培养基的菌落数/对照培养基的菌落数)×100%,若耐药百分比>1%为耐药(R),≤1%为敏感(S)。经药敏试验鉴定,125株MDR-TB中有50株对喹诺酮药物耐药,其余75株为敏感,质控菌株H37Rv药敏结果为敏感。
2.2gyrA和gyrBPCR检测 将125株MDRTB及H37Rv的gyrA和gyrB的QRDR分别进行PCR扩增,结果均为阳性,扩增片段长度分别为860bp 和 780bp,如图 1,图 2。
图1 PCR得到 gyrA的QRDRsM:DNA标准;1-6:菌株编号;7:阴性对照;8:H37RvFig.1 PCR product ofgyrAQRDRsM:DNA marker;1-6:the clinical isolates;7:negative control;8:H37Rv
2.3 基因测序分析
图2 PCR得到 gyrB的 QRDR1-6:菌株编号;7:阴性对照;8:H37Rv;M:DNA标准Fig.2 PCR product ofgyrBQRDR1-6:the clinical isolates;7:negative control;8:H37Rv;M:DNA marker
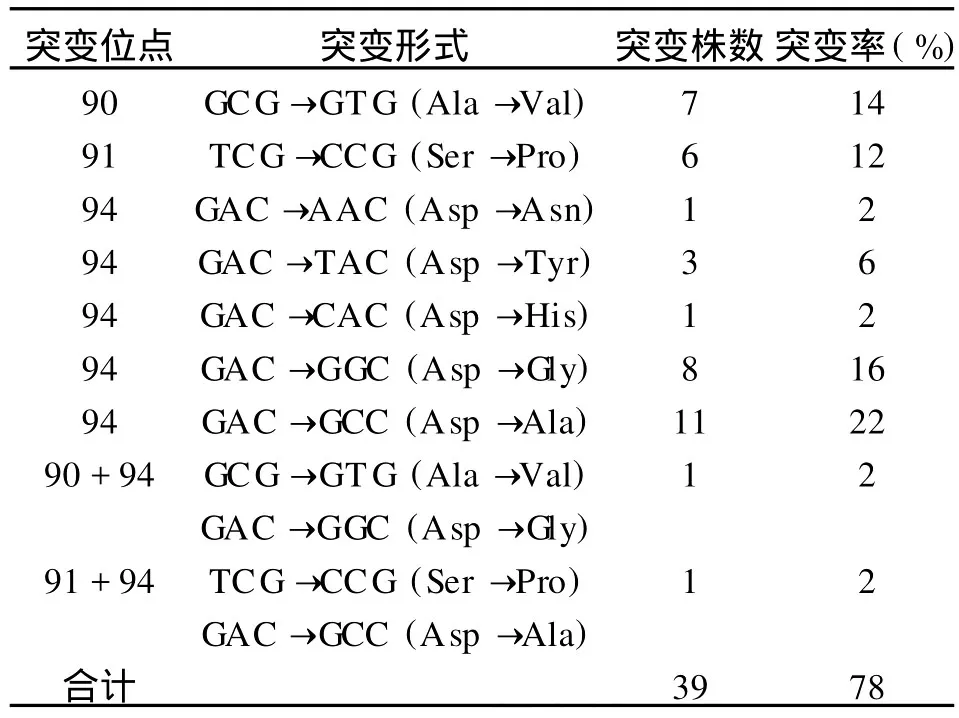
表1 耐喹诺酮MDR-TB临床分离株 gyrA基因突变特点Table 1 The characteristics ofgyrAgene mutations of quinolone resistant MDR-TB clinical isolates
2.3.1gyrA基因突变分析 H37Rv的gyrA基因未见突变。125株MDR-TB临床分离株的第95位点均由AGC→ACC。75株喹诺酮敏感菌株未见其他位点突变,50株喹诺酮耐药菌株有39株发生其他位点的突变:主要分布在90,91和94位点,其中有两株发生双位点突变,具体突变类型及突变率(突变的耐药菌株数/耐药菌株数)见表1。
2.3.2gyrB基因突变分析 H37Rv的gyrB基因未见突变,125株MDR-TB临床分离株中有5株发生突变,突变菌株均为喹诺酮耐药菌株,其中,4株伴随gyrA突变,具体突变类型及突变情况见表2。

表2 耐喹诺酮MDR-TB临床分离株 gyrb基因突变特点Table 2 The characteristics ofgyrBgene mutations of quinolone resistant MDR-TB clinical isolates
3 讨 论
喹诺酮类药物作为一类重要的抗结核药物,已被广泛用于MDR-TB的治疗,但我们的研究发现:125株MDR-TB中有50株对喹诺酮类药物耐药,耐药率高达40%,提示MDR-TB中,喹诺酮类药物的耐药情况比较严重,这可能与临床上长期、广泛和不规则地使用喹诺酮类药物有关。因此,建议在MDR-TB的治疗中,不能盲目使用喹诺酮类药物,应先进行该类药物的药敏检测并结合药敏试验结果指导用药。
MTB对喹诺酮类药物的耐药通常与gyr基因突变、药物外排泵或细胞壁的通透性有关,其中以gyr基因突变为主[8]。我们的结果也证实了这一点:在50株氯氟沙酮的 MDR-TB中,有40株gyr基因发生突变,其中39株gyrA基因发生突变,突变率为78%(39/50),与以往的文献报道接近[9-10],5株gyrB基因发生突变,但有4株伴随gyrA基因突变。
gyrA基因突变株中,以94位点较为常见,占gyrA基因突变的61.5%(24/39),其中有2株合并90或91位点的突变。gyrB基因突变主要位于500,506,534和539位点,但绝大多数都伴随gyrA基因突变。
此外,125株MDR-TB的gyrA基因95位点均由AGC突变为ACC,也进一步支持 SHI等[11-12]的观点:gyrA基因95位点突变与基因的遗传多态性有关,而与对喹诺酮类药物的耐药关系不大。
由此可见,MDR-TB对喹诺酮类药物的耐药主要与gyr基因突变有关,其中gyrA基因突变是gyr基因突变的主要形式,且特异性较高,可以考虑通过检测gyrA基因快速预测菌株对喹诺酮类药物的耐药表型;gyrB基因也会发生突变,但绝大多数都伴随gyrA基因突变,很少发生单独gyrB基因基因突变的情况。
[1]Aziz M A,Wright A,Laszlo A,et al.Epidemiology of antituberculosis drug resistance(the Global Project on Anti-Tuberculosis Drug Resistance Surveillance):an updated analysis[J].Lancet,2006,368(9553):2142-2154.
[2]中华人民共和国卫生部.全国结核病耐药性基线调查报告(2007-2008年)[R].北京:人民卫生出版社2010.
[3]Aubry A X,Pan S,Fisher L M,et al.Mycobacterium tuberculosisDNA gyrase:interaction with quinolones and correlation with antimycobacterial drug activity[J].Antimicrob Agents Chemother.2004,48(4):1281-1288.
[4]Dauendorffer JN,Guillemin I,Aubry A,et al.Identification of mycobacterial species by PCR sequencing of quinolone resistancedetermining regions of DNA gyrase genes[J].J Clin Microbiol.2003,41(3):1311-5.
[5]World Health Organization.Policy guidance on drug-susceptibility testing(DST)of second-line antituberculosis drugs[S].World Health Organization,Geneva,Switzerland,2008.
[6]中国防痨协会基础委员会.结核病诊断实验室检验规程[M].北京:中国教育文化出版社,2006.
[7]van Embden J D,Cave M D,CrawfordJ T,et al.Strain identification of Mycobacterium tuberculosis by DNA fingerprinting:recommendations for a standardized methodology[J].J Clin Microbiol,1993,31(2):406-409.
[8]Cambau E,Jarlier V.Resistance to quinolones in mycobacteria[J].Res Microbiol.1996,147(1-2):52-59.
[9]Mokrousov I,Otten T,Manicheva O,et al.Molecular Characterization of Ofloxacin-ResistantMycobacteriumtuberculosisStrains from Russia[J].Antimicrobial Agents and Chemotherapy,2008,52(8):2937-2939.
[10]安慧茹,王巍,李洪敏,等.结核分枝杆菌耐喹诺酮分子机制的研究[J].中国抗生素杂志,2005,30(2):103-106.
[11]SHI R,ZHANG J,LI C,et al.Emergence of Ofloxacin Resistance inMycobacterium tuberculosisClinical Isolates from China as Determined bygyrAMutation Analysis Using Denaturing High-Pressure Liquid Chromatography and DNA Sequencing[J].Journal of Clinical Microbiology,2006,44(2):4566-4568.
[12]Guillemin I,Jarlier V,Cambau E,et al.Correlation between quinolone susceptibility patterns and sequences in the A and B subunits of DNA Gyrase inMycobacterium[J].Anitimicrobial agents and chemotherapy,1998,42(8):2084-2088.
