猪繁殖与呼吸综合征病毒E+M+N基因重组腺病毒的构建
2011-01-24李宝玉柳纪省
徐 娜,李宝玉,柳纪省
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)俗称猪蓝耳病,是由病毒引起的一种高度接触性传染病,可导致母猪晚期流产、早产、死胎、木乃伊胎等繁殖障碍和仔猪严重的呼吸道症状及高死亡率。PRRSV是一种有囊膜的单股正链RNA病毒,基因组长约15kb,有8个不同程度的开放阅读框(ORFS),即 ORF1-ORF7。该病毒具有3个重要的结构蛋白,即 E蛋白,M蛋白和N蛋白,这3种蛋白分别由病毒基因ORF5,ORF6和ORF7编码。其中E蛋白具有良好的抗原性和免疫原性,有6个抗原决定簇,其中有一个是血清型特异性线性中和决定簇,能在猪体内诱导产生中和抗体,在体外可中和病毒的感染。此外,在PRRSV感染的巨噬细胞和干细胞中,E蛋白可以诱导细胞凋亡,参与病毒粒子结合病毒受体的过程。M蛋白在所有的PRRSV株间高度保守,其聚集于粗面型内质网上,并与 E蛋白形成异源二聚体。通过对感染猪康复血清的Western免疫印迹分析,M蛋白具有很强的免疫原性,感染10d即可激发可检测的抗体应答[1-2],表达的重组M蛋白可以作为血清学试验的靶抗原[3]。N蛋白是一种碱性磷酸蛋白,自身以二硫键形成同源二聚体。N蛋白构成病毒的主要抗原,免疫原性极强,N蛋白有6个疏水区和5个抗原决定簇,包括对所有毒株保守的共同决定簇和北美型或欧洲型特异性决定簇[4],其主要的抗原决定簇主要分布在蛋白的中央。
目前控制PRRSV感染尚无特效药物,生产中应用的有弱毒疫苗和灭活疫苗,弱毒疫苗稳定性差,安全和效力不可靠,易返强。灭活疫苗免疫剂量大、免疫次数多、免疫力产生期较长,不适合仔猪免疫。因此研制安全、稳定、高效的新型PRRSV疫苗迫在眉睫。研究表明以腺病毒为表达载体的基因工程疫苗具有良好的应用前景。腺病毒载体具有稳定性、对外源DNA的高容量、宿主范围广以及可以产生高滴度后代等优点,在基因治疗、基因工程疫苗的开发上具有广泛的应用。本试验构建了包含有E+M+N基因的腺病毒质粒,并转染293细胞实现了病毒的包装,为 PRRSV活载体疫苗的研究奠定了基础。
1 材料与方法
1.1 病毒、细胞及载体 猪繁殖与呼吸综合征病毒美洲毒株由中国农业科学院惠赠;PMD18-T载体购自大连宝生物(Takara)公司;大肠杆菌菌株JM109等为中国农业科学院兰州兽医研究所传染病室保存,腺病毒穿梭载体(pAdTrack-CMV)、人5型腺病毒骨架载体(pAdEasy-1)、大肠杆菌BJ5183、DH10B菌株购于上海杰美生物技术公司。
1.2 主要试剂及工具酶 病毒总RNA提取试剂盒购自promega公司;xbaI,HindⅢ,KpnI,xhoI等限制性内切酶;反转录酶AMV,T4 DNA连接酶和 Taq DNA聚合酶,RNA酶抑制剂(RNAsin),DNA回收试剂盒,质粒快速提取试剂盒购自大连宝生物(Takara)公司;PmeI,PacI限制性内切酶购自Biolab公司;脂质体Lipofectamine2000TM购自 Invitrogen公司。
1.3 引物设计与合成 设计合成 E基因5’和3’端分别带有KpnI和xbaI限制性酶切位点的引物,分别命名为 E1和E2;合成 M基因5’和3’端分别带有xbaI和HindⅢ限制性酶切位点的引物,分别命名为M1和M2;同时设计合成N基因5’和3’端分别带有HindⅢ和xhoI限制性酶切位点的引物,分别命名为N1和N2。引物序列如下:

1.4 PRRSV RNA的提取 按照RNA提取试剂盒说明,从细胞培养毒液中提取RNA。
1.5 目的基因的制备 将提取的总RNA分别用引物 E2、M2、N2,在AMV反转录酶的作用下于42℃进行反转录制备cDNA。然后以 cDNA 为模板,E1、E2;M1、M2;N1、N2为引物分别扩增 E、M和N基因。胶回收纯化双链cDNA,连接PMD18-T载体,分别筛选含 E、M和N基因片段的阳性重组质粒,分别命名为 PMD18-T/E,PMD18-T/M,PMD18-T/N,酶切和 PCR鉴定后送大连宝生物有限公司测序。
1.6 重组腺病毒穿梭载体的构建 将PMD18-T/E质粒经KpnI、xbaI双酶切,PMD18-T/M质粒经xbaI、HindⅢ双酶切,PMD18-T/N质粒经HindⅢ、xhoI双酶切后形成带有粘性末端的目的基因。同时,将腺病毒穿梭载体pAdTrack-CMV经KpnI、xhoI双酶切得到线形化的载体。使用 T4 DNA连接酶对上述产物进行粘端连接。按常规方法将连接产物转化大肠埃希氏菌JM109,在含卡那抗性的琼脂平板上筛选,挑选克隆后,提取质粒。采用酶切、PCR扩增等方法鉴定,得到阳性重组质粒,命名为pAdTrack-CMV/E+M+N。
1.7 重组腺病毒质粒的构建 将骨架载体pAdEasy-1转化大肠杆菌BJ5183,制备携带腺病毒骨架载体的感受态菌。将重组穿梭载体pAdTrack-CMV/E+M+N经PmeI线形化后电转化感受态菌,电转后将细胞在LB培养液中37℃复苏1h,取适量的细胞涂入含50mg/mL卡那霉素的培养皿中,37℃培养16~20h,挑选卡那抗性克隆,小量提取质粒DNA,用0.8%琼脂糖凝胶进行电泳迁移率分析,并进行酶切图谱分析。将所得的重组腺病毒质粒以上述同样条件电转入宿主菌DH10B,在此宿主菌内可获得大量高质量的质粒,挑选目的克隆,命名为pAd/E+M+N。
1.8 转染 HEK-293细胞获得重组腺病毒 从含有pAd/E+M+N质粒的DH10B菌液中提取重组腺病毒质粒4μg,PacI酶切线性化,乙醇沉淀灭菌,超纯水溶解沉淀,用脂质体Lipofectamine2000TM转染试剂进行转染。
1.9 病毒的传代培养 待细胞病变明显时,收集并离心收获细胞,弃上清,用约500μL的 PBS重悬细胞,37℃/-70℃反复冻融3次,12 000r/min离心10min,弃沉淀,将上清转入一新的1.5mL的离心管中,保存于-70℃,此即为初代重组腺病毒。
1.10 重组腺病毒的稳定性试验 取4、6、8、10代病毒上清20μL,加入蛋白酶 K于 56℃作用 1h,取 2μL为模板进行PCR扩增,以检测重组病毒的稳定性。
1.11 重组腺病毒的 TCID50的测定 待96孔细胞培养板中的细胞长满之后,用DMEM细胞培养基10倍系列稀释第10代病毒液从10-2至10-11,每个稀释度接种8个孔,每孔接种100μL病毒稀释液。同时设定两排孔用维持液做对照。37℃5%CO2温箱培养3~7d,计数每个稀释度细胞的病变孔数。并按 Reed-Muench法计算病毒 TCID50。计算公式如下:
距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数)
1g TCID50=距离比例×稀释度对数之间的差+高于50%病变率的稀释度的对数
2 结 果
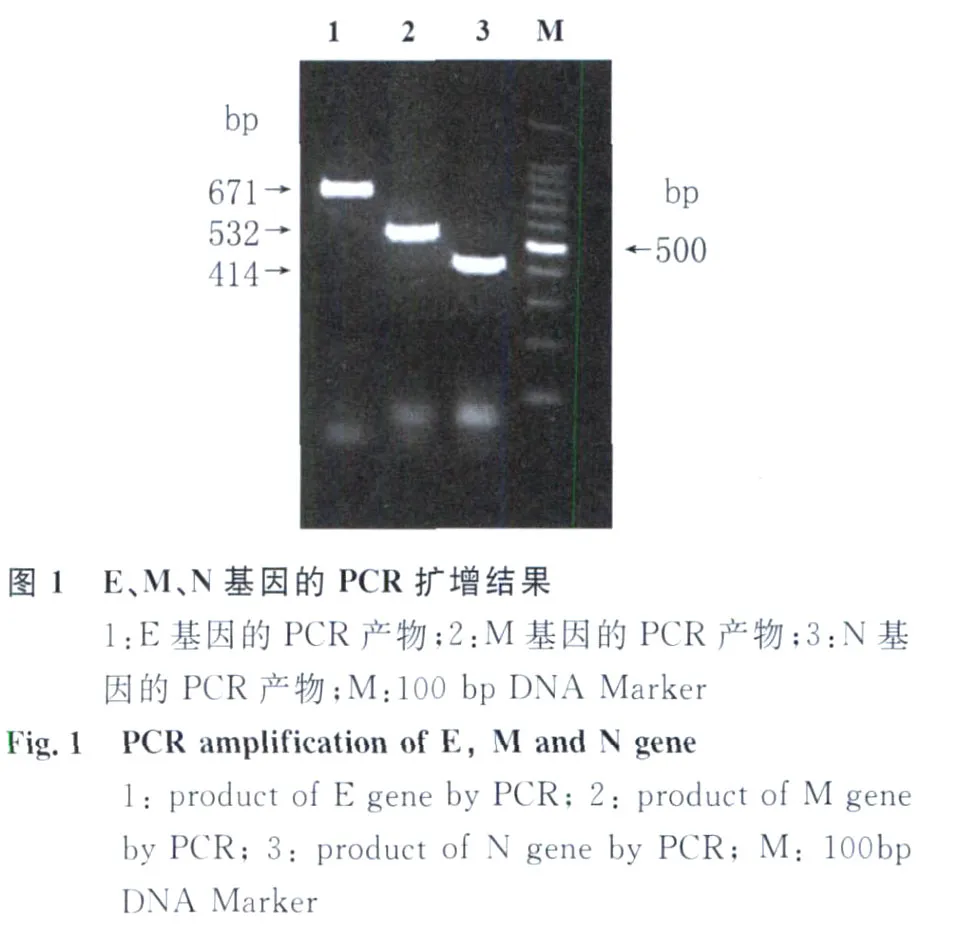
2.1 目的基因 PCR扩增产物经琼脂糖凝胶电泳分析表明,分别扩增出与 E、M和N基因相应的约671bp,532bp,414bp大小的特异片段见图1。
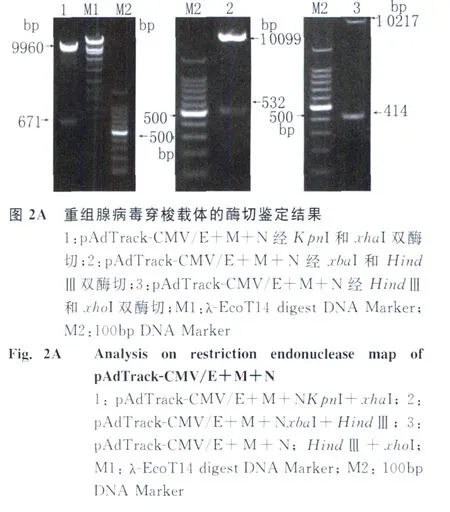
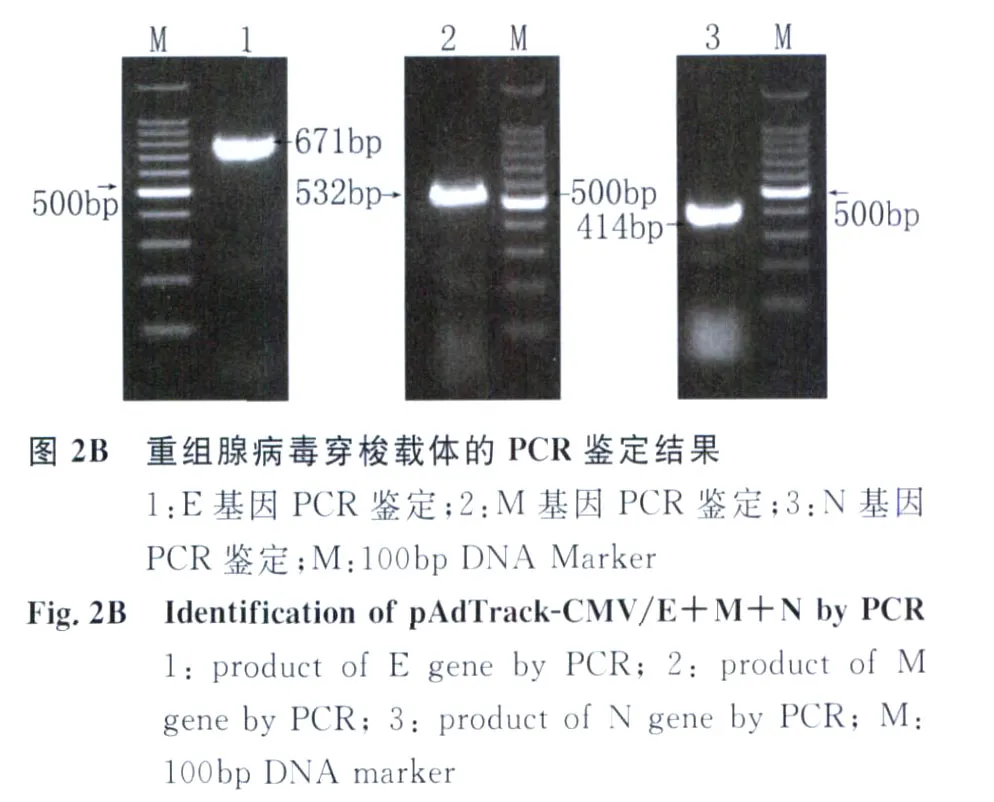
2.2 重组腺病毒穿梭载体的构建 将所获得的含有E、M和N基因的腺病毒穿梭质粒分别用KpnI和xhaI双酶切,xbaI和HindⅢ双酶切,HindⅢ和xhoI双酶切后,释放出来的片段分别与 E、M、N基因相符见图2A,PCR鉴定也出现同样大小的片段见图2B,证明重组腺病毒穿梭载体已构建成功。
2.3 获得复制缺陷型腺病毒质粒 将重组穿梭质粒线性化后,电转化感受态菌,挑取阳性克隆,小量提取质粒,0.8%琼脂糖凝胶电泳,可见重组腺病毒质粒与pAdEasy-1大小相似。限制性内切酶酶切后可见约4.5kb和33kb的条带,其结果与预期相符见图3。
2.4 重组腺病毒的鉴定 将PacI酶切线性化的重组腺病毒质粒转染生长良好的低代次293细胞,可产生重组腺病毒。用此重组腺病毒再次感染低代次293细胞,3~5d后可见细胞病变(CPE),病变细胞肿胀、变圆、聚集,部分病变细胞脱落见图4,与正常细胞比较,可见明显的病变。

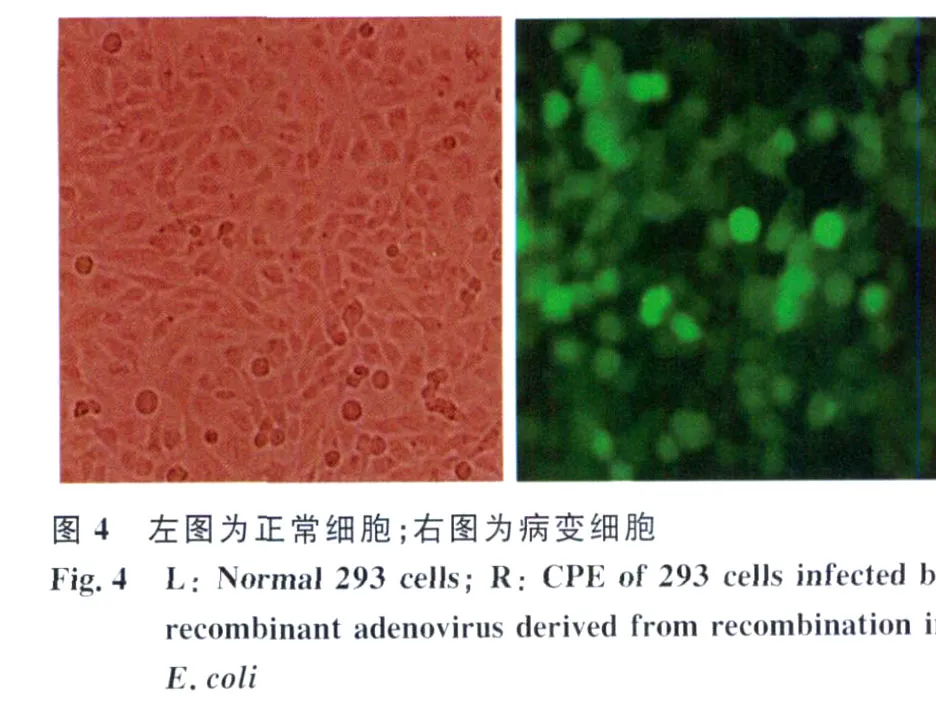
2.5 重组腺病毒的稳定性试验 将病变的细胞连续传至4、6、8、10代,分别提取各代细胞的总DNA,以此为模板进行外源基因的PCR扩增,结果显示每代细胞提取的DNA都能扩增出目的基因,说明重组腺病毒能够稳定遗传。
2.6 重组腺病毒的 TCID50测定 将第10代重组腺病毒传代细胞做接毒处理,6d后可明显观察到细胞病变的情况见图5,将病变细胞做进一步统计可知重组腺病毒的 TCID50为1.5×107。
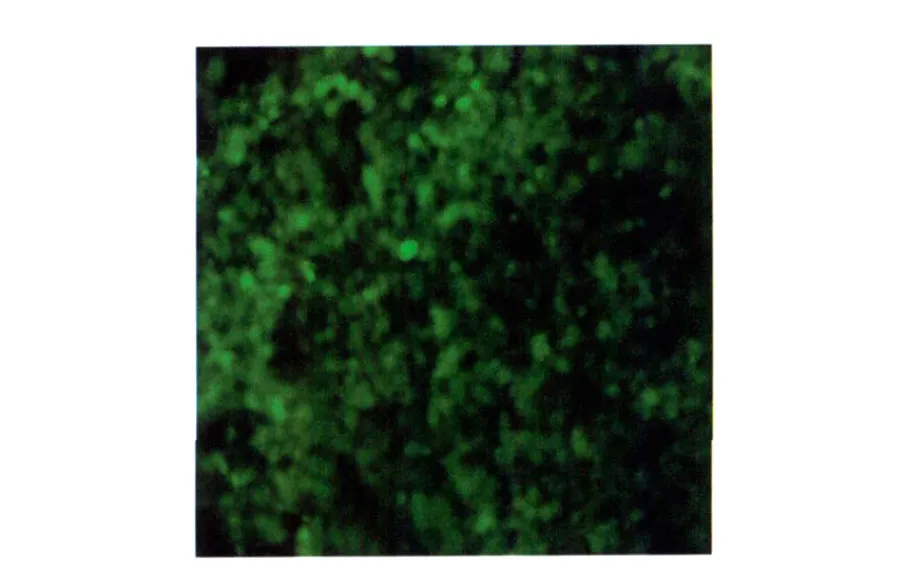
图5 接毒后产生病变的 HEK-293细胞Fig.5 Lesions resulting from inoculation to HEK-293 cell
3 讨 论
3.1 活载体疫苗应用动物病毒弱毒或无毒株如痘苗病毒、疮疹病毒、腺病毒等作为载体,插入外源抗原基因构建重组活病毒载体,转染病毒细胞而产生的。它避免了PRRS灭活疫苗和弱毒疫苗的缺陷,可同时启动机体的细胞免疫和体液免疫,而且还可构建多价疫苗,活载体疫苗成为近年来研究的热点之一。Jiang等[5]构建了表达 PRRSV修饰的 GP5和M融合蛋白的重组伪狂犬病病毒rPRV-GP5m-M,试验结果表明,重组疫苗 rPRV-GP5m-M免疫猪产生了PRRSV特异性中和抗体和高水平的淋巴细胞增值反应。攻毒试验结果表明,重组疫苗免疫猪产生的体温变化不明显,出现了短期的病毒血症,在鼻和口咽刮取物以及组织中的病毒含量较低。表明重组伪狂犬病病毒rPRV-GP5m-M对预防PRV和PRRSV感染可能是一个比较理想的候选疫苗。据报道以伪狂犬病毒基因缺失标志疫苗株 TK-/gG-/LacZ+为亲本株,通过同源重组,构建了表达PRRSV主要免疫原性蛋白GP5的重组伪狂犬病毒TK/gG/GP5+,将重组病毒免疫Balb/c小鼠,经过2次免疫后,有50%的小鼠产生了 GP5特异性ELISA抗体。
3.2 腺病毒载体具有宿主范围广,对人致病性低;在增殖和非增殖细胞中感染和表达基因;基因组相对稳定;能有效进行增殖,滴度高;与人类基因同源;不整合到染色体中,无插入致突变性;能在悬浮培养液中扩增;能同时表达多个基因等优点。构建重组腺病毒工作中的限速步骤是将目的基因整合入腺病毒基因组中。以前大都是将外源基因插入以质粒形式存在的腺病毒穿梭载体上,而后用真核细胞内质粒间同源重组的方式得到重组腺病毒。这种方法虽然有效,但同源重组效率低,不能完全避免野生型病毒的产生,需进行噬斑纯化,实验周期长。利用大肠杆菌细胞内同源重组的方法构建重组腺病毒显示了优越性。
3.3 本试验从PRRSV毒株中分别扩增E、M和N基因,并在三者之间导入2A序列,使一个阅读框同时表达三种不同的免疫蛋白,避免了融合表达对蛋白活性的影响。然后将外源基因定向插入到腺病毒穿梭载体中,经过大肠杆菌内同源重组获得重组复制缺陷性腺病毒,由于pAdTrack-CMV含有 GFP基因,同源重组后能在293细胞中大量表达 GFP,可在荧光显微镜下检测到荧光蛋白基因 GFP。最后经过病变的观察,证明基因能够稳定的表达,从而为猪繁殖与呼吸综合征病毒复制缺陷型腺病毒活载体疫苗的研制奠定基础。
[1]Yoon KJ,Zimmerman JJ,Swenson SL,et al.Characterization of humoral immune response to porcine reproductive and respiratory syndrome(PRRS)virus infection[J].J Vet Diagn Invest,1995,7:305-312.
[2]Loemba HD,Mounir S,Mardassi H,et al.Kinetics of humoral immune response to the major structural proteins of the porcine reproductive and respiratory syndrome virus[J].Arch Virol,1996,141:751-761.
[3]Meng XJ,Paul PS,Halbur PG,et al.Sequences comparison of open reading frames 2 to 5 of low and high virulence United states isolates of porcine reproductive and respiratory syndrome virus[J].J Gen Virol,1995,76:3181-3188.
[4]Dea S,Gagnon CA,Mardassi H,et al.Antigenic variability of porcine reproductive and respiratory syndrome as defined by monoclonal antibodies to the matrix protein[J].J Clin Microbiol,1996,34:1488-1493.
[5]JIANG P,J IANG W M,LI Y F,et a1.Humoral immune response induced by oral administration ofS.typhimuriumcontaining a DNA vaccine against porcine reproductive and respiratory syndrome virus[J].Vet Immunol Immunopathol,2004,102(3):321-328.
