紫花牡荆素调控PI3K/AKT通路对肝癌细胞增殖和凋亡的影响*
2024-04-01赵海清覃玉梅
赵海清 覃玉梅
广西壮族自治区南溪山医院(广西壮族自治区第二人民医院)药学部 (广西 桂林, 541000)
肝细胞癌是常见的消化系统恶性肿瘤,我国是肝细胞癌的高发国,肝细胞癌的发病率和死亡率分别居恶性肿瘤的第4位和第2位[1,2]。虽然近些年肝细胞癌的放疗、介入治疗、靶向治疗等治疗手段取得了长足进步,患者的生命周期得到一定延长,但肿瘤最终会发生复发及转移,进而导致死亡率居高不下。磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)信号通路激活介导的癌细胞增殖在肝细胞癌发生发展、复发转移中均发挥重要作用,PI3K/AKT通路是研究肝细胞癌发病机制、发现肝细胞癌新治疗手段的重要靶点[3]。近年来,植物来源的化合物因其潜在的抗肿瘤特性而备受研究者关注。紫花牡荆素是从马鞭草科植物的干燥成熟果实蔓荆子中提取得到的黄酮类化合物,在非小细胞肺癌、胶质瘤中均通过抑制PI3K/AKT通路激活的方式发挥抑癌作用[4,5]。为初步揭示紫花牡荆素在肝细胞癌中的抑癌作用及机制,本研究以肝癌细胞株HepG2、Hep3B为对象,分析紫花牡荆素调控PI3K/AKT通路对肝癌细胞增殖和凋亡的影响及分子生物学机制。
1 材料与方法
1.1 细胞株 肝癌细胞株HepG2、Hep3B购自上海通派生物科技公司。
1.2 试剂及仪器 紫花牡荆素购自上海纯优生物科技公司,SC-79购自上海瀚香生物科技公司,结晶紫购自美国Sigma公司,CCK8细胞增殖活力检测试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒购自武汉伊莱瑞特生物科技公司,B淋巴细胞瘤-基因(Bcl-2)、细胞色素C(CytC)、Bcl-2相关X蛋白(Bax)、裂解型caspase-3(Cleaved caspase-3)、p-PI3K、p-AKT、β-actin特异性一抗购自美国Abcam公司。细胞培养箱购自上海一恒科学仪器有限公司,倒置显微镜购自深圳市西尼科光学仪器公司,流式细胞仪购自北京赛泰克生物科技有限公司。
1.3 方法
1.3.1 细胞培养及分组 HepG2、Hep3B细胞常规进行贴壁培养、胰蛋白酶消化及传代。将消化后的细胞调节密度至2.5×106个/ml,按照2 ml/孔接种在6孔培养板中分组处理。对照组用不含药物的培养基处理,不同浓度紫花牡荆素组用含有不同浓度(10 μmol/L、20 μmol/L、40 μmol/L、80 μmol/L)紫花牡荆素的培养基处理,溶剂对照组用含有体积分数0.1% DMSO的培养基处理,溶剂+40 μmol/L紫花牡荆素组用含有体积分数0.1% DMSO及40 μmol/L紫花牡荆素的培养基处理,SC-79+40 μmol/L紫花牡荆素组用含有5 μmol/L SC-79(含有体积分数0.1% DMSO)及40 μmol/L紫花牡荆素的培养基处理。每组均连续处理48 h。
1.3.2 CCK8法检测细胞活力 HepG2、Hep3B细胞按照5×103个/孔接种在96孔培养板内,分组处理48 h后采用CCK8试剂盒检测细胞活力,在酶标仪中检测490 nm处的光密度(OD)值。
1.3.3 细胞平板克隆实验 消化收集分组处理48 h的HepG2、Hep3B细胞,按照1×104个/孔接种在6孔培养板内,继续培养2周,肉眼观察到克隆形成后用4%多聚甲醛固定细胞30 min,用0.1%结晶紫染液染色30 min,在显微镜下观察克隆数。
1.3.4 Annexin V-FITC/PI法检测细胞凋亡 消化收集分组处理48 h的HepG2、Hep3B细胞,取1×105个细胞,加入500 μl缓冲液冲重悬,采用Annexin V-FITC/PI试剂盒进行Annexin V-FITC染色和PI染色15 min,而后在流式细胞仪上检测Annexin V-FITC阳性、PI阴性的细胞早期凋亡比例作为细胞凋亡率。
1.3.5 western blot检测蛋白表达 采用裂解液提取分组处理48 h的HepG2、Hep3B细胞中的蛋白,按照20 μg蛋白/孔将样本加入聚丙烯酰胺凝胶中进行电泳,而后电转移至硝酸纤维素膜,将膜放入5%脱脂牛奶、室温封闭1 h,洗膜后将膜在Bcl-2一抗(1∶500稀释)、CytC一抗(1∶1 000稀释)、Bax一抗(1∶600稀释)、Cleaved caspase-3一抗(1∶400稀释)、β-actin一抗(1∶5 000稀释)中4℃孵育过夜。次日洗膜后将膜放入1∶2 000稀释的辣根过氧化物酶二抗,室温孵育1 h。最后,洗膜并在凝胶成像系统中进行化学发光,得到蛋白条带,根据条带的光密度值、以β-actin为内参,计算Bcl-2、CytC、Bax、Cleaved caspase-3的表达水平。
1.4 统计学方法 采用SPSS 23.0软件对数据进行统计学分析,实验数据均为计量资料,以均数±标准差表示,多组间比较采用单因素方差分析,有统计学差异的计量资料通过LSD-t法两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度紫花牡荆素对HepG2、Hep3B细胞活力的影响见表1。

表1 不同浓度紫花牡荆素对HepG2、Hep3B细胞活力的影响
2.2 40 μmol/L紫花牡荆素对HepG2、Hep3B细胞克隆形成率及凋亡率的影响 见表2。

表2 对照组与40 μmol/L紫花牡荆素组细胞克隆数、凋亡率的比较
2.3 40 μmol/L紫花牡荆素对HepG2、Hep3B细胞中PI3K/AKT通路的影响 见图3、表3。

图1 对照组与40 μmol/L紫花牡荆素组细胞克隆的结晶紫染色

图2 对照组与40 μmol/L紫花牡荆素组细胞凋亡的流式细胞术检测图

图3 对照组与40 μmol/L紫花牡荆素组细胞中p-PI3K、PI3K、p-AKT、AKT的表达

表3 对照组与40 μmol/L紫花牡荆素组p-PI3K、p-AKT表达的比较
2.4 40 μmol/L紫花牡荆素对HepG2、Hep3B细胞中线粒体增殖相关蛋白的影响 见图4、表4。

图4 对照组与40 μmol/L紫花牡荆素组细胞中线粒体增殖相关蛋白的表达

表4 对照组与40 μmol/L紫花牡荆素组线粒体增殖相关蛋白表达的比较
2.5 AKT激动剂SC-79对40 μmol/L紫花牡荆素抑制HepG2、Hep3B细胞中PI3K/AKT通路的影响 见图5、表5。

图5 3组细胞中p-PI3K、PI3K、p-AKT、AKT的表达

表5 3组细胞中p-PI3K、p-AKT表达的比较
2.6 AKT激动剂SC-79对40 μmol/L紫花牡荆素抑制HepG2、Hep3B细胞增殖的影响 见图6、7及表6。

图6 3组细胞克隆的结晶紫染色

图7 3组凋亡的流式细胞术检测

表6 3组细胞克隆数及凋亡率的比较
2.7 AKT激动剂SC-79对40 μmol/L紫花牡荆素调控HepG2、Hep3B细胞中线粒体增殖相关蛋白表达的影响 见图8、表7。
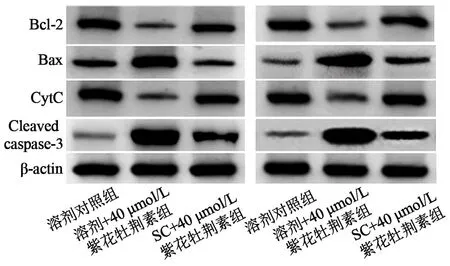
图8 3组细胞中线粒体增殖相关蛋白的表达

表7 3组线粒体增殖相关蛋白表达的比较
3 讨论
肝细胞癌发生发展、复发转移过程中癌细胞增殖失控并伴有细胞凋亡紊乱是重要的生物学特征,针对癌细胞的增殖和凋亡进行干预以抑制细胞增殖、诱导细胞凋亡是治疗癌症、预防复发和转移的有效途径。近些年,多种纯天然的植物来源化合物在恶性肿瘤治疗中的价值受到广泛关注,紫花牡荆素是一种黄酮类化合物,来源于蔓荆子,在心血管系统及呼吸系统中发挥抗炎、抗菌、止痛作用[6,7]。恶性肿瘤相关的研究证实紫花牡荆素具有抑制癌细胞增殖、促进癌细胞凋亡的抗癌生物学活性[8-10]。
本研究通过细胞实验对紫花牡荆素抑制肝癌细胞增殖的作用展开探索,以HepG2和Hep3B两种肝癌细胞株为实验对象,用不同浓度紫花牡荆素处理后均观察到紫花牡荆素以浓度依赖性的方式降低两种肝癌细胞的细胞活力,表明紫花牡荆素对肝癌细胞的增殖具有抑制作用,其中40 μmol/L紫花牡荆素抑制增殖的作用最明显,与该药物在其他恶性肿瘤细胞中抑制癌细胞增殖的作用相似[8-10]。癌细胞的增殖失控多伴有凋亡紊乱,本研究的结果显示:40 μmol/L紫花牡荆素抑制两种肝癌细胞的克隆形成,增加两种肝癌细胞的凋亡率,这一结果与紫花牡荆素降低肝癌细胞活力的作用一致,表明紫花牡荆素具有抑制肝癌细胞增殖的作用。
线粒体是细胞中与增殖及凋亡调控密切相关的细胞器,Bax和Bcl-2是一对调控线粒体膜CytC通透性的分子,前者增加通透性,后者降低通透性,从线粒体进入细胞浆的CytC能够启动级联反应、促进pro caspase-3裂解为cleaved caspase-3并促进细胞凋亡[11,12]。已有研究报道,紫花牡荆素调控非小细胞肺癌细胞、结直肠癌细胞中线粒体增殖相关蛋白Bax、Bcl-2、CytC、Cleaved caspase-3的表达[4,8]。本研究的结果显示40 μmol/L紫花牡荆素使两种肝癌细胞中Bax、Cleaved caspase-3的表达增加,Bcl-2、CytC的表达降低,提示紫花牡荆素对肝癌细胞增殖和凋亡的调控作用与其调控线粒体增殖蛋白表达相关。
恶性肿瘤的增殖、凋亡等生物学环节受到多样的生物信号网络及信号通路调控,其中PI3K/AKT是经典的促增殖、抗凋亡通路。肝细胞癌中PI3K/AKT通路显著激活[13,14],多种抗肿瘤药物通过抑制PI3K/AKT通路的途径抑制肝癌细胞的增殖[15,16]。本研究中,40 μmol/L 紫花牡荆素处理两种肝癌细胞后细胞中p-PI3K、p-AKT的表达水平显著降低,提示紫花牡荆素可能通过抑制PI3K/AKT通路抑制肝癌细胞增殖、促进肝癌细胞凋亡。进一步设计逆转实验,40 μmol/L 紫花牡荆素处理的同时联用AKT激动剂SC-79,SC-79使p-AKT表达增加并削弱紫花牡荆素抑制细胞增殖、促进细胞凋亡的作用,表明紫花牡荆素对肝癌细胞增殖和凋亡的调控作用部分由抑制PI3K/AKT通路介导。
综上所述,本研究的细胞实验结果表明紫花牡荆素通过抑制PI3K/AKT通路抑制肝癌细胞增殖。本研究的不足之处是仅仅设计了离体细胞实验,未能通过动物实验分析紫花牡荆素对肝癌细胞增殖的抑制作用。尽管如此,本研究的以上细胞实验还是为今后发现肝细胞癌新的治疗药物提供了依据及思路。
