基于电子鼻和顶空气相色谱-离子迁移谱分析不同干燥方式对羊肚菌挥发性化合物的影响
2024-04-01孙海斓裴龙英袁荣欣赵立艳
孙海斓,裴龙英,陈 瑶,袁荣欣,陈 潇,赵立艳,*
(1.南京农业大学食品科技学院,江苏南京 210095;2.新疆理工学院食品科学与工程学院,新疆阿克苏 843100)
羊肚菌(Morchellaspp.)属羊肚菌科(Morchellaceae),羊肚菌属(Morchella),由菌伞和菌柄两部分组成,菌伞表层无规则褶皱形如羊肚,菌柄呈圆柱状中空,在我国民间具有麻子菌、羊肚菜、鸡蛋花和狼肚菌等别称[1]。羊肚菌的生长环境复杂,在我国的甘肃、湖南、云南、青海、新疆、四川、山西等地均有种植[2]。近年来,随着羊肚菌栽培技术的发展和产业链条的完善,我国羊肚菌栽培面积和栽培产量逐年增长,发展势头迅猛[3]。据统计,2021 年我国羊肚菌人工栽培面积已达24.7 万亩[4]。作为一种珍贵的药食两用真菌,羊肚菌质脆可口,味道鲜美,同时富含多糖、蛋白质、膳食纤维和多酚等多种营养物质[5-6],具有抗氧化[7]、抗肿瘤[8]、免疫调节[9]、降血压[10]、抗菌消炎[11]等多种功效,具有良好的发展前景。
新鲜羊肚菌含水量高、易腐烂变质、不耐贮存,因此市场上以干羊肚菌流通为主。干燥是羊肚菌主要的初加工技术之一,其操作便捷成本低,可在延长产品货架期同时降低运输损失[12-13]。在现有的研究中,羊肚菌干燥方式主要为热风干燥和真空冷冻干燥等,不同的干燥处理方式会对羊肚菌风味产生不同影响[14],然而风味也是影响消费者购买产品的主要因素,因此研究干燥处理对羊肚菌风味影响显得尤为重要。相比较自然风干或晒干等方式,热风干燥和真空冷冻干燥效率更高,更适合工业化加工生产。但是,目前关于不同干燥方式对羊肚菌及羊肚菌不同部位的风味研究较少,羊肚菌是一种风味独特的食用菌非常适用于调味料产品开发,比较探究不同干燥方式下羊肚菌不同部位的风味差异可为羊肚菌菌伞和菌柄的分级加工利用提供依据,促进羊肚菌资源高值化利用和精细化加工,对羊肚菌产业发展具有重大意义。
电子鼻是一种基于模拟人嗅觉系统来分析样品气味轮廓的仪器,具有操作简单、快速无损的检测特点,但不能实现样品气味的具体定性分析。近年来顶空气相色谱-离子迁移谱 (headspace gas chromatography-ion mobility spectroscopy,HS-GC-IMS)技术因前处理简单、灵敏度高、无损和高通量检测等特点,被广泛应用于食品风味分析研究,可实现对样品中具体挥发性化合物的鉴定分析[15]。
因此本实验以新鲜羊肚菌为研究对象,进行真空冷冻干燥和热风干燥处理,采用电子鼻结合顶空气相色谱-离子迁移谱技术分析不同干燥处理前后菌柄和菌伞的挥发性气味化合物差异,并通过相对气味活度值(relative odor activity value,ROAV)法分析不同挥发性气味化合物对样品的气味贡献程度,深入了解不同干燥处理对羊肚菌风味品质的影响,以期为羊肚菌精深加工产品的开发利用提供一定理论基础。
1 材料与方法
1.1 材料与仪器
新鲜羊肚菌 产自云南省丽江市永胜县(春季采摘);C4~C9酮类标准品 上海西格玛奥德里奇贸易有限公司;实验用水为超纯水。
Millipore-Q 纯水仪 美国Millipore 公司;DHG-9123A 电热恒温鼓风干燥箱 上海精宏实验设备有限公司;PB 602-N 电子天平 上海梅特勒-托利多仪器有限公司;JYL-C022E 料理机 九阳股份有限公司;LyoBeta 15 真空冷冻干燥机 西班牙Telstar 科技公司;HWS28 型电热恒温水浴锅 上海一恒科技有限公司;PEN3 电子鼻系统 德国AIRSENSE 公司;FlavourSpec®风味分析仪 德国GAS 公司。
1.2 实验方法
1.2.1 原料预处理 挑选无病虫害、外形饱满的新鲜羊肚菌,去掉表面灰尘及其他杂质,清洗后按菌伞和菌柄分级,并分别切块(1 cm×1 cm)混匀,取适量用作鲜样备用,新鲜羊肚菌菌伞和菌柄样品分别编号为XS、XB,其余作干燥处理。
1.2.2 干燥实验 参考张毅航等[16]方法稍作修改,具体如下。热风干燥:取适量新鲜羊肚菌菌伞和菌柄块状样品,于50 ℃干燥箱中干燥至水分含量低于12%(羊肚菌干品水分含量的控制参考GB 7096-2014《食品安全国家标准 食用菌及其制品》中理化指标规定,下同),取出后快速打粉90 s,并过60 目筛备用,经热风干燥后的羊肚菌菌伞和菌柄样品分别编号为RS、RB。
真空冷冻干燥:取适量新鲜羊肚菌菌伞和菌柄样品,预冻后转移至真空冷冻干燥机中,在冷阱温度-50 ℃和真空度10~12 Pa 条件下连续干燥保证样品最终水分含量低于12%,取出后快速打粉90 s,并过60 目筛备用,经真空冷冻干燥后的羊肚菌菌伞和菌柄样品分别编号为DS、DB。
1.2.3 电子鼻检测 分别准确称取干重为0.200 g不同羊肚菌样品于20 mL 顶空瓶中,50 ℃水浴中加热15 min,取出置于室温下平衡15 min 后待测。电子鼻测定参数设置[17]:室温25 ℃,传感器自动清洗时间为180 s,传感器归零时间为5 s,样品准备时间为5 s,样品测定时间为120 s,样品测定时间间隔为1 s,进样流量为300 mL/min,每个样品重复测定3 次。PEN3 型电子鼻各个传感器的响应物质和灵敏度如表1 所示。

表1 PEN3 传感器性能描述Table 1 Performance descriptions of PEN3 sensor
1.2.4 挥发性风味物质的GC-IMS 检测
1.2.4.1 样品前处理 分别称取研磨充分干重为0.200 g 的不同羊肚菌样品,置于20 mL 顶空固相瓶中密封,进行GC-IMS 检测。
1.2.4.2 HS-GC-IMS 条件 参考Hou 等[18]稍作修改。顶空进样条件:50 ℃下顶空孵化15 min,转速350 r/min;80 ℃下进样500 μL,速度10 mL/min,不分流模式。
GC-IMS 条件:色谱柱温度为75 ℃,载气为高纯氮气(纯度≥99.999%),载气初始流速为2 mL/min 保持2 min;8 min 内逐步增大流速至10 mL/min;10 min 内,逐步增大流速至50 mL/min;最后10 min内,将流速逐步增加至150 mL/min;IMS 温度为45 ℃,漂移气流速为150 mL/min,分析时间共为30 min。
1.2.5 相对气味活度值(relative odor activity value,ROAV) 参考刘登勇等[19]方法,引入ROAV 参数来评价各个挥发性风味化合物对样品气味的贡献程度。该参数设定对各个样品气味贡献最大组分的ROAVstan=100,其余组分ROAV 计算如下:
式中:Cri为各个挥发性气味化合物的相对含量(%);Ti为各个挥发性气味化合物的气味阈值(mg/kg);Crstan为对各样品总体气味贡献最大的组分的相对含量(%);Tstan为对各样品总体气味贡献最大的组分的气味阈值(mg/kg)。
1.3 数据处理
采用SPSS 20.0 软件和Excel 2019 对数据进行统计学分析,采用Origin 2021 软件对实验结果绘图。利用Winmuster 分析软件对电子鼻采集到的数据进行PCA 分析;利用FlavourSpec®风味分析仪配套的分析软件对GC-IMS 结果进行分析,利用GCIMS 内部的NIST 数据库和IMS 数据库,根据气相保留时间和离子迁移时间差异对样品中的挥发性气味成分进行二维定性分析;利用LAV(laboratory analytical viewer)软件获得的各个已定性挥发性化合物的峰强度,根据峰面积归一法计算样品中各个挥发性气味化合物的相对含量,进行定量分析。
2 结果与分析
2.1 电子鼻分析不同干燥方式下羊肚菌中挥发性化合物
2.1.1 电子鼻雷达图分析 如图1 所示,根据电子鼻传感器对不同干燥方式下羊肚菌不同部位样品的挥发性气味物质的响应值大小绘制出雷达图。由图1可知,各组样品对W5S、W6S、W2S、W3S 这4 个传感器的响应值差别较小,难以区分。在W1S、W1W、W2W 这3 个传感器上,新鲜羊肚菌样品的响应值最大且均大于干燥后羊肚菌样品的响应值,说明新鲜羊肚菌样品的中可能含有更多的烷类、硫化物、萜烯等挥发性气味物质。此外,新鲜羊肚菌菌伞的响应值高于菌柄;而在W2W 传感器上,真空冷冻干燥样品的响应值大于热风干燥,说明相比较热风干燥,真空冷冻干燥更能保留新鲜羊肚菌样品中的芳烃化合物或含硫类化合物。在W1C、W3C、W5C 这3 个传感器上,热风干燥和真空冷冻干燥羊肚菌样品的响应值明显大于新鲜羊肚菌样品,且热风干燥羊肚菌菌伞样品的响应值均最大,推测可能干燥后羊肚菌样品中的烯烃和芳香类化合物的含量升高。王永伦等[20]探究了自然干燥、冷冻干燥和热风干燥三种方式下真姬菇的电子鼻气味轮廓差异,发现不同干燥方式下气味轮廓相似,但不同干燥方式下干燥样品的传感器响应值差异明显,其中自然干燥后样品中W5S 和W1W传感器响应值最低,热风干燥和真空冷冻干燥样品相对接近,这是因为自然干燥在长时间的光照下影响了挥发性气味化合物的形成。然而仅从传感器响应值大小很难区分不同干燥样品,需要进一步处理传感器信号值,探究不同样品的内在差异。
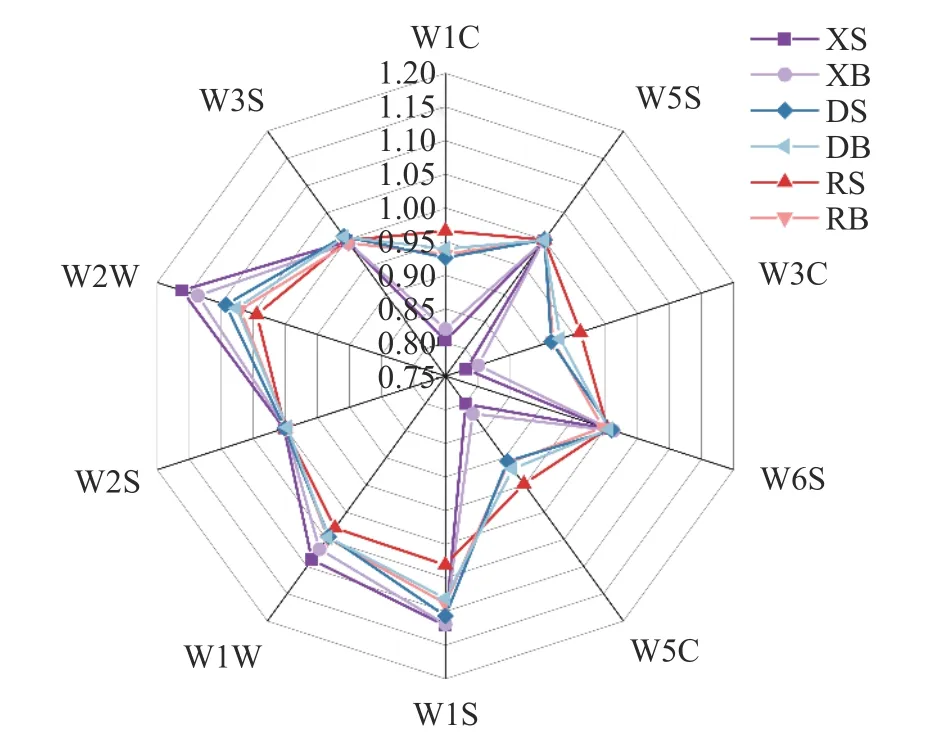
图1 不同干燥方式下羊肚菌不同部位电子鼻雷达图Fig.1 Electronic nose radar map in different parts of Morchella esculenta under different drying methods
2.1.2 电子鼻PCA 分析 主成分分析(principal component analysis,PCA)是一种有效的降维方式,能够最大限度保留原始数据信息,并对观测值进行重新分组。为进一步评价不同干燥方式下羊肚菌不同部位样品间的差异,基于电子鼻传感器数值进行了主成分分析。如图2 所示,第一主成分(PC1)和第二主成分(PC2)的累计贡献率为97.81%(>85%),说明实验方法可行且两种主成分包括羊肚菌样品挥发性气味化合物的大部分信息[15]。新鲜羊肚菌样品与干燥处理羊肚菌样品在PC1 上距离较大,说明干燥后羊肚菌电子鼻气味轮廓变化明显,电子鼻检测可明显区分干燥前后羊肚菌样品。而真空冷冻干燥菌伞样品与新鲜羊肚菌样品间的距离最近,说明真空冷冻干燥样品的气味化合物与新鲜样品最为接近,相比热风干燥,真空冷冻干燥有利于保留新鲜羊肚菌样品的原有气味化合物,这与孟令帅等[21]研究真空冷冻干燥、热风干燥和微波干燥3 种干燥方式对竹荪的香气品质影响的结论相一致,真空冷冻干燥对竹荪样品的风味影响最小。热风干燥和真空冷冻干燥的菌伞样品之间能够明显区分,而两种干燥方式下菌柄样品之间有一定的重合,区分度较低。

图2 不同干燥方式下羊肚菌不同部位电子鼻PCA 得分图Fig.2 PCA score plot of electronic nose data in different parts of Morchella esculenta under different drying methods
值得注意的是,电子鼻检测分析仅能够得到各组样品的整体气味轮廓,可以说明不同干燥方式下羊肚菌不同部位样品间的挥发性气味化合物存在差异,但是不能具体到确定化合物[22]。因此本研究进一步采用了HS-GC-IMS 技术分析了不同干燥方式下羊肚菌样品中具体的挥发性化合物。
2.2 HS-GC-IMS 分析不同干燥方式下羊肚菌中挥发性化合物
2.2.1 不同干燥方式下羊肚菌挥发性化合物GCIMS 差异对比图谱分析 如图3 所示,利用Reporter插件绘制不同羊肚菌样品中挥发性化合物的气相色谱离子迁移谱差异图。图3 中横坐标为离子迁移时间、纵坐标为气相色谱保留时间,1.0 处为RIP 峰,峰的右侧每一个光斑代表一种挥发性化合物,光斑亮度大小表示物质含量[23]。如图3 所示,以新鲜羊肚菌菌伞样品为对照,其余样品谱图对相同的物质做颜色抵消,如果某个物质含量高于对照组则显现红色,低于对照组则显现蓝色。由图3 可知,相比较对照组(新鲜羊肚菌菌伞样品),干燥后羊肚菌样品中出现红色和蓝色区域,说明不同干燥处理对羊肚菌挥发性气味化合物的组成和含量影响明显,干燥后损失了部分化合物,同时长时间的干燥处理也促进了部分挥发性气味化合物的生成[24]。值得注意的是,新鲜羊肚菌菌柄样品与菌伞样品之间也存在较大差异,而热风干燥和真空冷冻干燥两种方式下挥发性化合物组成较为接近,这与电子鼻结果一致。

图3 不同干燥方式下羊肚菌不同部位中挥发性化合物的GC-IMS 差异对比图谱Fig.3 GC-IMS difference comparison maps of volatile compounds in different parts of Morchella esculenta under different drying methods
2.2.2 不同干燥方式下羊肚菌中挥发性风味化合物指纹图谱分析 利用GC-IMS 对样品中的挥发性气味成分进行二维定性分析,其中包括部分高浓度的气味化合物的二聚体组分,利用单体和二聚体可更加精准定性化合物[25]。以定性后二维谱图的峰信号利用Gallery 插件绘制出不同干燥方式下羊肚菌样品中挥发性气味化合物的指纹图谱,其中每行代表一个样品,每列对应一种挥发性化合物,每个光斑代表一种化合物,光斑颜色由红到蓝代表其含量由高到低。从指纹图谱中可以更好看出样品间挥发性气味化合物的差异,由图4 可知,经过干燥处理后,新鲜羊肚菌中有9 种醇类化合物、4 种酯类、2 种醛类和2 种酮类化合物含量明显减少(图4 中红色框区域)。这与张毅航等[16]研究结果相一致,经过热风和冷冻干燥处理后猴头菇菌盖和菌柄中的醇类和醛类化合物损失较多。与新鲜羊肚菌样品相比,经真空冷冻干燥和热风干燥后有11 种挥发性化合物含量明显增加(图4中绿色框区域),主要为酮类、吡嗪类化合物。葛帅等[26]研究干燥方式对小米辣风味影响也有类似发现,其中热风干燥和红外干燥后小米椒中2,6-二甲基-4-庚酮和2,5-二甲基吡嗪等酮类和吡嗪类化合物含量增加。这可能是由于热风干燥较高温度的环境促进了美拉德反应生成风味物质。此外,两种干羊肚菌菌伞和菌柄挥发性化合物指纹图谱的变化趋势一致。
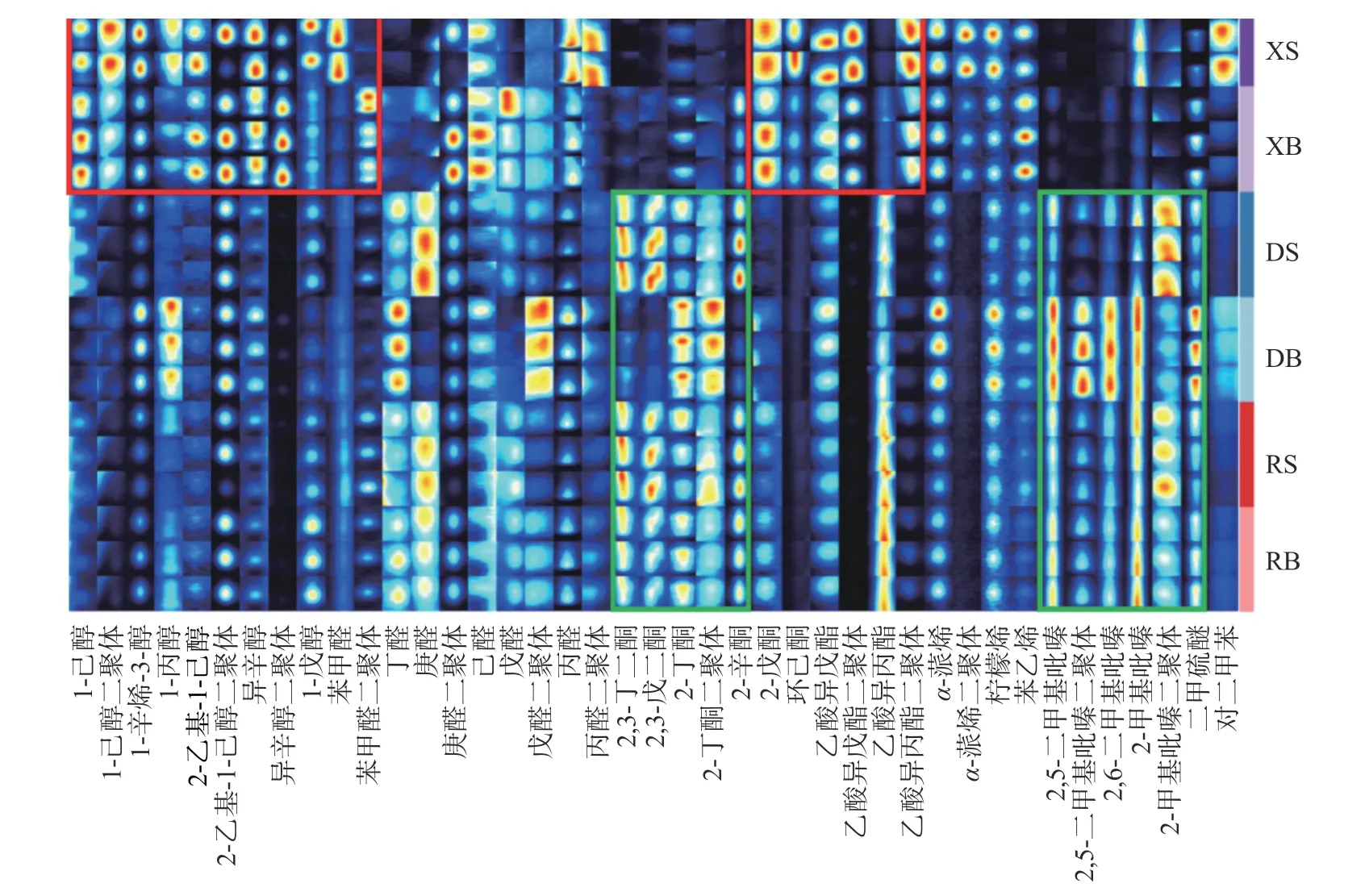
图4 不同干燥方式下羊肚菌不同部位中挥发性化合物的GC-IMS 检出成分指纹图谱Fig.4 Fingerprints of volatile flavor compounds in different parts of Morchella esculenta under different drying methods by GC-IMS
2.2.3 不同干燥方式下羊肚菌中挥发性风味化合物定性分析 如表2 所示,利用自带分析软件LAV(laboratory analytical viewer)获得的各个已定性挥发性化合物的峰强度,根据峰面积归一法计算样品中各个挥发性气味化合物的相对含量[27-28]。由表2 可知,经GC-IMS 共鉴定出羊肚菌中41 种挥发性风味物质,包括9 种醇类、10 种醛类、7 种酮类、4 种酯类、4 种烯类、5 种吡嗪类、1 种含硫化合物和1 种芳香烷烃类。新鲜羊肚菌菌伞和菌柄样品中,醇类含量最高,其次为酯类和醛类,占总挥发性化合物的86.01%和84.82%。干燥后,醇类和酯类化合物总含量显著降低(P<0.05),酮类和吡嗪类化合物总含量显著提高(P<0.05)。
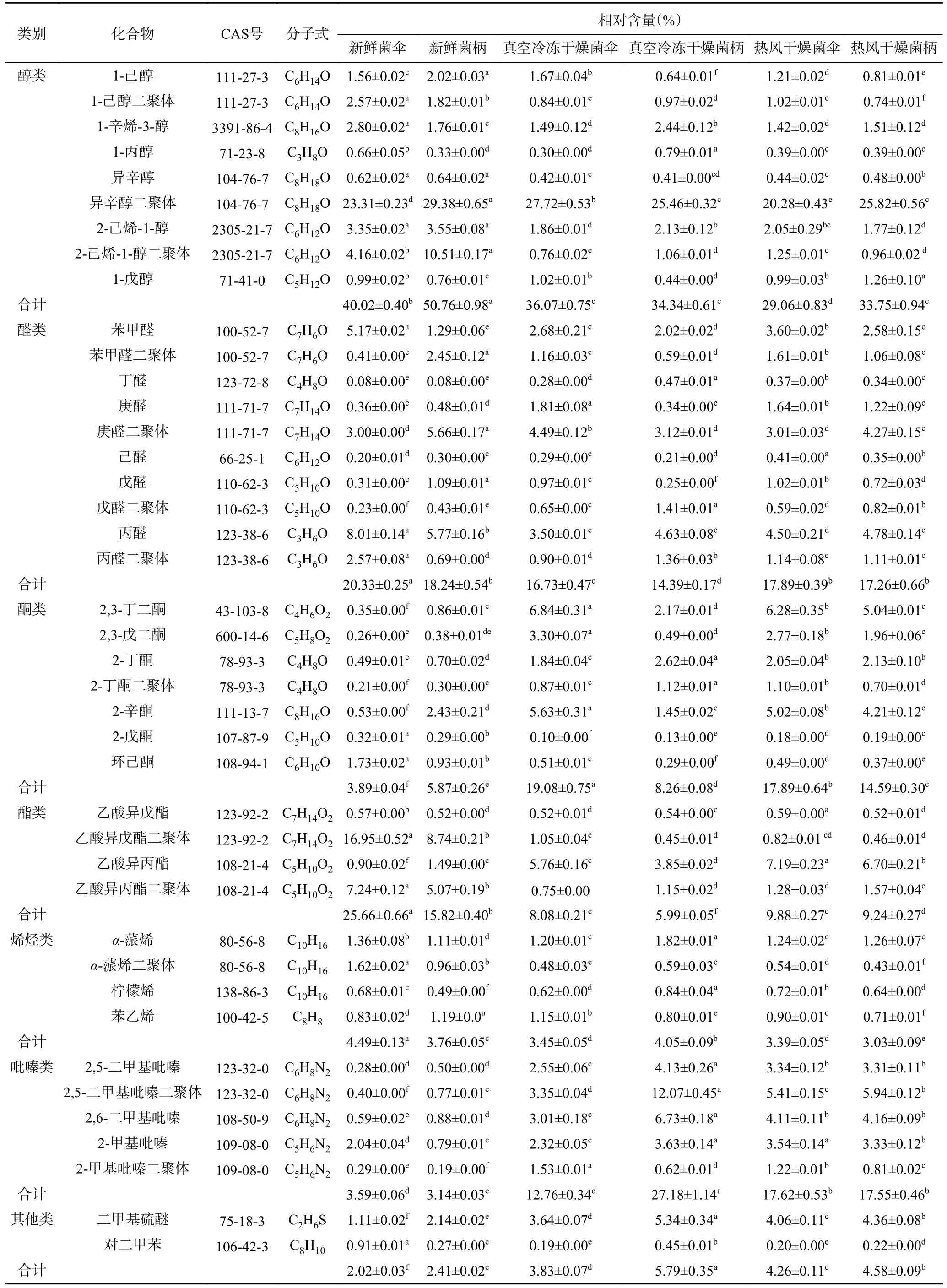
表2 不同干燥方式下羊肚菌不同部位中挥发性化合物的组成及相对含量Table 2 Composition and relative content of volatile compounds in different parts of Morchella esculenta under different drying methods
经两种干燥处理后,羊肚菌中挥发性气味化合物的含量和组成发生显著变化。其中醇类化合物在各个羊肚菌样品中含量丰富,尤其是新鲜羊肚菌菌伞和菌柄样品中。其中异辛醇和1-辛烯-3-醇是八碳类化合物,这类物质被认为是食用菌特色“蘑菇”气味的主要贡献者[29],经过干燥后其含量降低,说明干燥处理会对羊肚菌中部分醇类风味物质含量造成损失,其中真空冷冻干燥对醇类化合物的保留略优于热风干燥,这与张毅航等[16]研究热风干燥和真空冷冻干燥对猴头菇风味物质影响结果相一致。
醛类化合物阈值较低,对羊肚菌风味贡献较大,通常C5~C9醛类化合物主要来自于不饱和脂肪酸的氧化反应[30]。醛类的挥发性强但热稳定性差,经过干燥处理后丙醛的含量明显降低;苯甲醛(苦杏仁和麦芽味)和庚醛(果香味)等含量大幅增加,亚油酸的氧化和异亮氨酸参与的美拉德反应可产生苯甲醛[31]。
酮类挥发性化合物常具有果香味,相比新鲜羊肚菌样品,经过干燥处理后羊肚菌中酮类化合物总含量大幅增加。热风干燥样品中2,3-丁二酮、2-辛酮和2,3-戊二酮等酮类化合物的含量明显高于真空冷冻干燥的样品,可能的原因是高温条件下更容易发生脂类和醛类物质的氧化,从而形成酮类挥发性化合物,这类物质具有果香味且阈值较低[32]。
酯类挥发性化合物常具有果香和花香味,一般由醇和有机酸的非酶催化或微生物的酶促催化反应产生[33]。新鲜羊肚菌中富含乙酸异丙酯和乙酸异戊酯,且菌伞中含量高于菌柄,经两种干燥处理后酯类化合物含量大大减少。
烯烃类挥发性化合物常易氧化分解产生烷烃、醇类等化合物,干燥后羊肚菌烯烃类化合物总含量下降。其中α-蒎烯(松香味)在真空冷冻干燥的样品中的含量要高于热风干燥的样品,这可能是因为烯烃类化合物在热风干燥处理中受热易与酸发生水合反应造成损失,因此在冻干样品中保存较好[34],这一结果也与电子鼻结果相对应。
一般而言,吡嗪类化合物常具有坚果和烤香味,可由美拉德反应或微生物代谢产生[35],干燥后羊肚菌中2-甲基吡嗪、2,5-二甲基吡嗪和2,6-二甲基吡嗪等的含量均上升,可能是干燥过程中加热促进了吡嗪类物质转化。此外,本研究在羊肚菌中还检测到一种含硫化合物(二甲基硫醚),经干燥后其含量上升,含硫化合物常可通过含硫氨基酸经美拉德反应中Strecker 降解或微生物代谢产生[36]。
2.2.4 不同干燥方式下羊肚菌中关键性风味化合物分析 各个挥发性化合物能被感知到的最低浓度称为“气味阈值”,挥发性化合物对样品气味的贡献程度不仅与其含量有关,还与其阈值有关。因此,为了进一步了解不同干燥处理前后羊肚菌的关键气味化合物,采用相对气味活度值(ROAV)评价各个挥发性化合物对样品整体气味形成的贡献程度,ROAV≥1 说明该物质为关键气味成分,对羊肚菌样品整体气味贡献度大;0.1≤ROAV<1,说明该物质为修饰性气味化合物,对羊肚菌整体气味起修饰作用[38]。表3为各个样品中计算ROAV≥0.1 的挥发性化合物和香气描述。如表3 所示,羊肚菌样品中共有21 种化合物的ROAV≥0.1,对样品香气具有贡献作用。干燥前后样品中ROAV 存在较大变化,其中新鲜羊肚菌样品中有6 种挥发性气味化合物ROAV≥1;干燥后羊肚菌样品中有9 种挥发性气味化合物ROAV≥1,经两种干燥处理后,新产生了苯甲醛、己醛和2,3-戊二酮3 种关键气味化合物,据报道苯甲醛具有苦杏仁味和麦芽味,己醛具有苹果味,2,3-戊二酮具有黄油和果香味,推测其可能是干燥后赋予羊肚菌更浓厚的气味来源[19]。干燥前后样品中有6 种共同关键气味化合物,分别为1-辛烯-3-醇、庚醛、丙醛、2-辛酮、乙酸异戊酯和二甲基硫醚,其中1-辛烯-3 醇是赋予羊肚菌典型蘑菇味的来源,同时其他的醛、酮和酯类等挥发性化合物具有果香和酯香味,这些关键化合物之间的相互作用共同组成了羊肚菌独特的香气。值得注意的是,乙酸异戊酯的ROAV 在干燥处理后大幅度下降,而二甲基硫醚、1-辛烯-3 醇、2,5-二甲基吡嗪和2,6-二甲基吡嗪等ROAV 值明显增大,说明经过真空冷冻干燥和热风干燥后可能损失了部分酯香味,但同时洋葱味、蘑菇味、坚果和焦香味的贡献更大。此外,羊肚菌的菌伞和菌柄的关键气味化合物的气味贡献度存在差异,两种干燥处理后菌伞中关键气味化合物的ROAV 值均高于对应菌柄的ROAV 值,这也与之前菌伞中较高的物质含量相对应。

表3 不同干燥方式下羊肚菌不同部位中挥发性化合物的ROAV 和香气描述Table 3 ROAV and odor description of volatile compounds in different parts of Morchella esculenta under different drying methods
根据上述分析得到的不同干燥方式下羊肚菌样品中9 种关键气味化合物的相对含量进行PCA 分析,结果如图5 所示。PC1 的贡献率为56.2%,PC2的贡献率为30.0%,累计贡献率为86.2%(>85%),新鲜羊肚菌与干燥后羊肚菌样品能够完整区分开,两种干燥方式后羊肚菌菌柄也可区分,菌伞有部分重叠。新鲜羊肚菌菌伞和菌柄之间差异可归因于二甲基硫醚(洋葱味);其中2-辛酮和2,3-戊二酮是有气味贡献的差异标志物,可将新鲜羊肚菌与热风干燥和真空冷冻干燥的羊肚菌菌伞区分开来。

图5 不同干燥方式下羊肚菌不同部位中关键风味化合物的PCA 双标图Fig.5 Bioplot of PCA of key volatile flavor compounds in different parts of Morchella esculenta under different drying methods
3 结论
本研究利用电子鼻和HS-GC-IMS 技术对真空冷冻干燥和热风干燥处理后的羊肚菌菌伞和菌柄的挥发性气味化合物进行分析,发现两种干燥处理前后样品气味存在明显差异,且电子鼻可有效区分干燥前后样品。通过HS-GC-IMS 分析,不同样品中共检测出41 种挥发性风味物质,其中新鲜羊肚菌中醇类、酯类和醛类化合物含量丰富,干燥后,醇类和酯类化合物损失,而酮类和吡嗪类化合物总含量显著增加(P<0.05)。此外,相同干燥方式下羊肚菌菌伞中酯类和醛类化合物显著高于菌柄(P<0.05)。进一步结合ROAV 分析共鉴定出21 种对样品气味有贡献的化合物,其中新鲜羊肚菌样品中有6 种关键气味化合物包括1-辛烯-3-醇、庚醛、丙醛、2-辛酮、乙酸异戊酯和二甲基硫醚,它们赋予羊肚菌典型蘑菇味同时具有果香和酯香味,干燥后样品新增加了苯甲醛、己醛和2-辛酮3 种关键气味化合物。
综上,真空冷冻干燥和热风干燥对新鲜羊肚菌的气味特征存在明显影响,真空冷冻干燥更利于保留新鲜羊肚菌样品中的醇类和烯烃类化合物;而热风干燥更利于保留新鲜样品中的酯类化合物,同时有助于促进醛类和酮类化合物生成。在实际生产中可根据需求选择具体干燥方式,但本实验仅探究了单一的干燥方式对羊肚菌风味影响,今后还可以进一步探究真空冷冻干燥联合热风干燥等多种不同联合干燥方式对羊肚菌气味特征的影响。本研究有助于深入了解不同干燥方式处理后羊肚菌风味特征,可为羊肚菌的精细化加工和风味食品的进一步开发利用提供理论依据。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
