不同生长时期酸枣果肉多糖相对分子质量分布和单糖组成及抗氧化活性研究
2024-04-01李国龙唐志书宋忠兴袁书会刘红波史鑫波陈佳昕
王 磊,李国龙,唐志书,,3,*,宋忠兴,袁书会,刘红波,史鑫波,陈佳昕
(1.长春中医药大学药学院,吉林长春 130117;2.陕西中医药大学,陕西中药资源产业化省部共建协同创新中心/秦药特色资源研究开发国家重点实验室(培育),陕西咸阳 712083;3.中国中医科学院研究生院,北京 100700)
酸枣(Ziziphus jujubaMill.var.spinosa(Bunge)Hu.ex H.F.Chou)为鼠李科枣属落叶小乔木,其种子酸枣仁具有养心补肝,宁心安神等功效,是中医药临床治疗失眠的首选品,酸枣果肉为酸枣仁生产过程中的副产品。酸枣果肉含有多种化学成分[1],如多糖、有机酸、多酚、甾醇、黄酮以及多种微量元素和大量维生素等,具有抗氧化、免疫调节、抗癌和保肝活性[2-5]。据报道约每30 kg 酸枣鲜果仅可产出酸枣仁药材1 kg[6],仅少量酸枣果肉作食品应用,如酸枣汁、酸枣糕、酸枣面等[7-9]。每年有大量的酸枣果肉作为废弃组织被丢弃,造成极大的资源浪费,导致酸枣的资源利用率低下。
近年来,随着人们对健康生活的向往以及养生观念的提高,多糖的保健作用引起人们的广泛关注,研究发现很多植物多糖具有抗菌、抗氧化和保肝等多种生物活性[10-12]。随着对植物多糖的研究逐步深入,发现在器官水平、细胞水平到分子水平,均有不同程度的免疫调节作用[13];同时发现多种植物多糖具有抗氧化活性[14-16],目前已有80 多种植物多糖被成功提取并有望广泛地应用于医药和保健食品的研究和开发中[17]。植物多糖的结构是影响其生物活性的关键因素,确定多糖的一级结构能够清楚地了解其生物活性及其机制[18]。
虽然现今药食同源类中药多糖在功能性保健食品方面应用较少,但以药食同源类中药多糖为天然原料研发功能性保健食品具有巨大潜力[19]。酸枣果肉中含有丰富的多糖,有研究报道酸枣果肉中多糖有增强小鼠的肌力、记忆力、食欲等作用[20-21]。有研究表明植物多糖的生物活性和营养价值与其生长过程中的含量、相对分子质量及单糖组成密切相关[22-23]。目前,对酸枣果肉中多糖相关研究大多针对其提取方式和生物活性[24-25],而有关生长过程中酸枣果肉中多糖含量、相对分子质量、单糖组成等初级结构及抗氧化活性变化规律尚未见报道,本研究通过对不同时期野生型和种植型酸枣果肉多糖(Ziziphus jujubaflesh polysaccharide,ZJFP)进行多糖含量、抗氧化能力、相对分子质量和单糖组成进行研究分析,探究酸枣果肉中多糖含量及其单糖组成变化、抗氧化活性在不同生长时期的变化规律,以期为进一步研究酸枣果肉多糖结构与其功能活性的关系和抗氧化功能食品的开发奠定基础。
1 材料与方法
1.1 材料与仪器
酸枣样品 采自陕西咸阳淳化县北仲山酸枣种植基地(N34°45'36'',E108°30'6''),经陕西省中药资源产业化省部共建协同创新中心宋忠兴主任药师鉴定为鼠李科枣属植物酸枣Ziziphus jujubaMill.var.spinosa(Bunge)Hu ex H.F.Chou 的果实,本次研究选取基地外野生和基地内种植的不同生长时期的酸枣,共采摘五次共十批样品,分别为7 月7 日、8 月7 日、9 月7 日、9 月25 日、10 月7 日采摘的鲜果;三氟乙酸、葡萄糖对照品、岩藻糖对照品、鼠李糖对照品、阿拉伯糖对照品、半乳糖对照品、木糖对照品、甘露糖对照品、核糖对照品、葡萄糖醛酸对照品Sigma 公司;甘露糖醛酸对照品 南通飞宇生物科技有限公司;普鲁兰DXT3K、普鲁兰DXT21K、普鲁兰DXT130K、普鲁兰DXT600K、普鲁兰DXT 820K、普鲁兰DXT3755K、1-二苯基-2-三硝基苯肼(DPPH)、半乳糖醛酸对照品、古罗糖醛酸对照品上海源叶生物科技有限公司;其余试剂均为国产分析纯;水 为纯化水。
ICS5000 离子色谱、Thermo Multiskan GO 多功能酶标仪、Forma 88000 超低温冰箱、Reacti-thermo 氮气吹扫仪、U3000 凝胶色谱 美国Thermo 公司;OPTILAB T-rex 示差检测器 美国Wyatt 公司;UV-2600 紫外可见分光光度计 日本岛津公司;Sartorius CPA225D 十万分之一电子分析天平 德国赛多利斯公司;SRA12N60 冷冻干燥机 上海舍岩仪器有限公司。
1.2 实验方法
1.2.1 酸枣果肉粗多糖提取 酸枣样品自然阴干,除去果核,得到酸枣果肉。然后精密称取干燥至恒重的酸枣果肉细粉0.25 g,置圆底烧瓶中,加入80%乙醇150 mL,加热回流1 h,趁热过滤,留残渣,残渣用80%热乙醇洗涤3 次,每次10 mL,将残渣及滤纸置于烧瓶中,加入150 mL 水,加热回流1 h,趁热过滤,留滤液,残渣及烧瓶用热水洗涤4 次,每次10 mL,合并滤液及洗液,浓缩,-80 ℃冰箱预冻12 h,于冷冻干燥机-60 ℃条件下干燥24 h,得酸枣果肉粗多糖[26]。
1.2.2 总多糖含量测定 参照查娜等[27]酸枣果肉多糖含量测定方法,配制质量浓度为0.1 mg/mL 的无水葡萄糖对照品溶液,使用苯酚-硫酸法进行显色,在490 nm 波长处测定吸光度,得到标准曲线为y=0.0167x-0.0015(R2=0.9991)。x 为葡萄糖质量浓度,y 为吸光度。
1.2.3 ZJFP 相对分子质量分布测定
1.2.3.1 多糖对照品溶液配制 取不同规格的普鲁兰多糖适量[26],精密称定,用0.1 mol/L NaNO3水溶液(含0.02% NaN3,w/w)溶解,配成平均相对分子质量(Mw)为6.10×105Da 的对照品溶液(A),Mw 分别为2.10×104、3.75×106Da 的对照品混合溶液(B)和Mw 为3.65×103、1.31×104、8.21×105Da 的对照品混合溶液(C),定容至浓度为1.0 mg/mL。
1.2.3.2 高效凝胶色谱分析 称取适量“1.2.1”项下多糖溶解在0.1 mol/L NaNO3水溶液(含0.02%NaN3,w/w)中,配制终浓度为1.0 mg/mL 的多糖溶液,并通过孔径为0.45 μm 的过滤器过滤后上机检测[28]。采用凝胶排阻色谱柱(Ohpak SB-805 HQ、Ohpak SB-804 HQ、Ohpak SB-803 HQ,300 mm×8 mm)串联。柱温45 ℃,进样量100 μL,流动相A(0.02% NaN3,0.1 mol/L NaNO3),流速0.5 mL/min,洗脱梯度为等度,洗脱时间为100 min。
将多糖对照品溶液进行分析,以时间为横坐标,示差信号值为纵坐标。以l g(Vh)流体力学体积为纵坐标(y),洗脱体积Vel 为横坐标(x),得线性回归方程为y=-0.8158x+15.233(R2=0.9946),计算ZJFP的Mw。
1.2.4 ZJFP 中的单糖组成种类及含量测定
1.2.4.1 ZJFP 完全酸水解物的制备 取干净的色谱瓶,称取适量多糖样品,加入1 mL 2.0 mol/L 三氟乙酸溶液,121 ℃加热2 h[29]。通氮气,吹干。加入甲醇清洗,再吹干,重复甲醇清洗2~3 次。加入水溶解,转入色谱瓶中待测。
1.2.4.2 单糖对照品溶液配制 准确称取所需标准品后,加水配成10 mg/mL 标准溶液母液单标,然后取适量标准品母液单标混合配制成最高指标浓度为60、50、40 μg/mL 的标准品混标,根据需要将其稀释1.25、1.66、2.5、5、10、50、100 倍。
1.2.4.3 离子色谱分析条件 根据文献[30],采用Dionex™ CarboPac™ PA20(150 mm×3.0 mm,10 μm)液相色谱柱;进样量为5 μL。流动相A(H2O),流动相B(0.1 mol/L NaOH),流动相C(0.1 mol/L NaOH,0.2 mol/L NaAc),流速0.5 mL/min;柱温为30 ℃;洗脱梯度:0 min A 相/B 相/C 相(95:5:0,V/V/V),26 min A 相/B 相/C 相(85:5:10,V/V/V),42 min A 相/B 相/C 相(85:5:10,V/V/V),42.1 min A 相/B 相/C 相(60:0:40,V/V/V),52 min A 相/B 相/C 相(60:40:0,V/V/V),52.1 min A 相/B 相/C 相(95:5:0,V/V/V),60 min A 相/B 相/C 相(95:5:0,V/V/V)。
1.2.5 不同生长时期ZJFP 的DPPH 自由基清除能力测定 取不同时期ZJFP 干品,配制成质量浓度为1.0 mg/mL 的多糖溶液。取多糖2.0 mL,加入2.0 mL 浓度为0.02 mol/mL 的现配DPPH 乙醇溶液,混合均匀,于37 ℃下避光反应30 min,测定517 nm 处吸光度[31]。VC作阳性对照。按公式计算DPPH 自由基清除能力。以乙醇代替DPPH 溶液为对照组A0,水替代样品作空白组AP,多糖样品组为AS。
1.3 数据处理
所有样品进行3 次测定,显著性差异采用SPSS 18.0 统计软件进行单因素方差分析,Origin 2019b 对数据进行绘图分析,色谱数据利用软件Chromeleon 处理。
2 结果与分析
2.1 不同时期酸枣果肉中多糖含量
对采集的酸枣果肉进行多糖含量测定,结果见图1。野生型ZJFP 的含量为44.01±2.18~66.05±0.98 mg/g;种植型ZJFP 含量为41.08±2.27~59.66±2.97 mg/g,酸枣果肉中多糖含量与生长期密切相关,生长前期酸枣膨大消耗多糖,中期果实大小稳定后多糖开始积累。野生型ZJFP 在7 月7 日至8 月7 日之间含量显著下降(P<0.05),在8 月7 日至10 月7 日之间进行积累;种植型ZJFP 在7 月7 日至9 月7 日之间含量显著下降(P<0.05),在9 月7 日至10 月7 日之间进行积累。

图1 不同时期和种植方式ZJFP 含量Fig.1 ZJFP content in different stages and different planting methods
2.2 ZJFP 相对分子质量分布
将多糖对照品溶液进行分析,以时间为横坐标,示差信号值为纵坐标,结果见图2。将ZJFP 溶液在1.2.3 项色谱条件下进行分析,根据保留时间可以将ZJFP 分为P1、P2、P3、P4 四个组分,其中P1、P2 峰面积较大,保留时间较长,平均Mw 分别为5.23×106、10.03×104Da;P3、P4 峰面积较小,保留时间较短,平均Mw 分别为2.03×102、0.39×102Da,见图3。
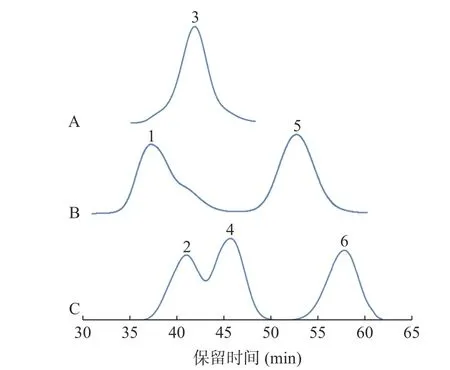
图2 普鲁兰多糖对照品高效凝胶色谱图Fig.2 High performance gel chromatogram of Pullulan reference substance
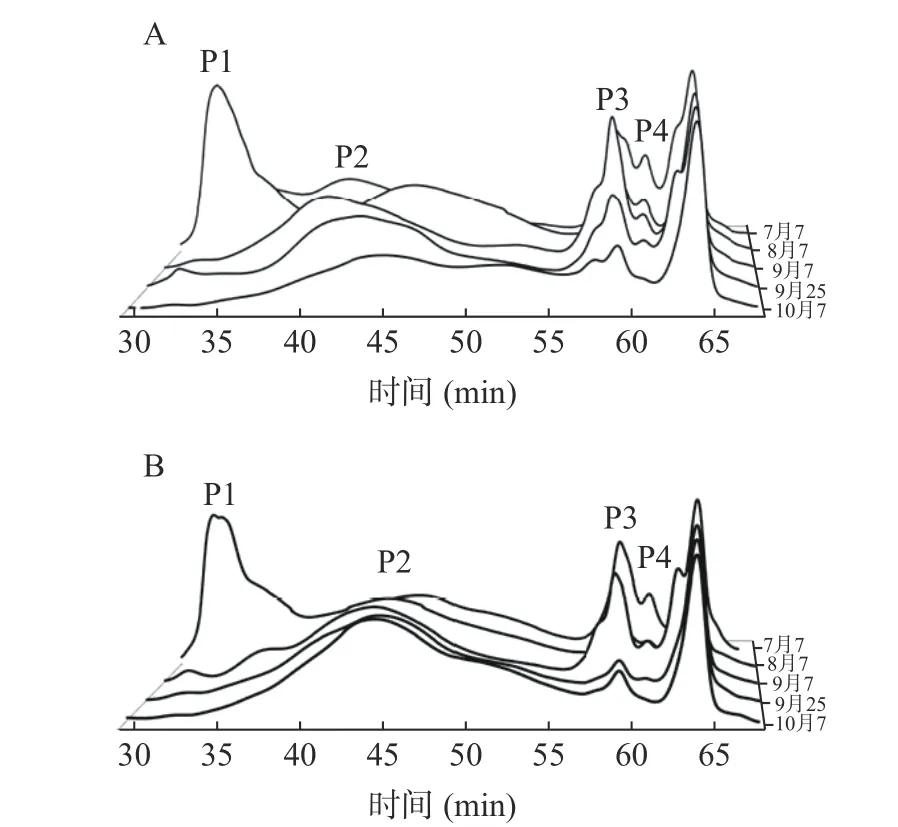
图3 不同时期ZJFP 高效凝胶色谱图Fig.3 High performance gel chromatogram of ZJFP at different stages
随着酸枣果实的生长,野生型ZJFP 的P1、P4两个组分含量逐步降低,P3 组分先降低后稳定,P2 组分占比逐渐增大;种植型ZJFP 的P1 和P4 两个组分的含量逐步降低,P3 组分含量先升高后降低、P2 组分含量逐步升高。随着酸枣的成熟,果肉多糖中相对分子量较大的P1 组分逐渐消耗,P2 组分占比增大的相对分子质量发生变化,种植型ZJFP 相对分子质量为4.46×105~5.84×106Da,野生型ZJFP相对分子质量为6.90×105~6.12×106Da,见表1。
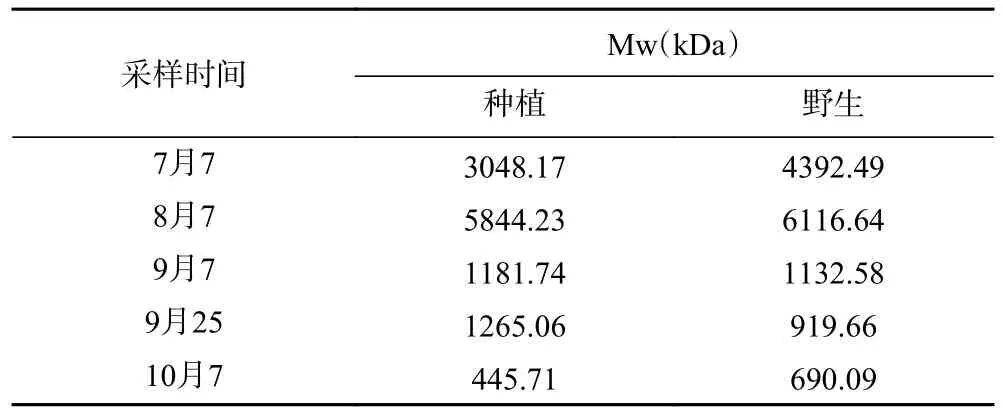
表1 不同时期ZJFP 相对分子质量Table 1 Relative molecular weight of ZJFP in different stages
2.3 ZJFP 中的单糖组成及含量分析
将“1.2.4”下制备的多糖酸水溶液采用离子色谱系统进行分析,通过对比标准单糖图谱可知,两种类型ZJFP 酸水解液均有9 种单糖共有峰,按保留时间依次鉴定为岩藻糖、阿拉伯糖、鼠李糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸、甘露糖醛酸,见图4。酸枣果肉多糖的单糖组成数据处理时,采用外标法定量,测定不同浓度标品制定标准曲线,线性关系信息见表2。
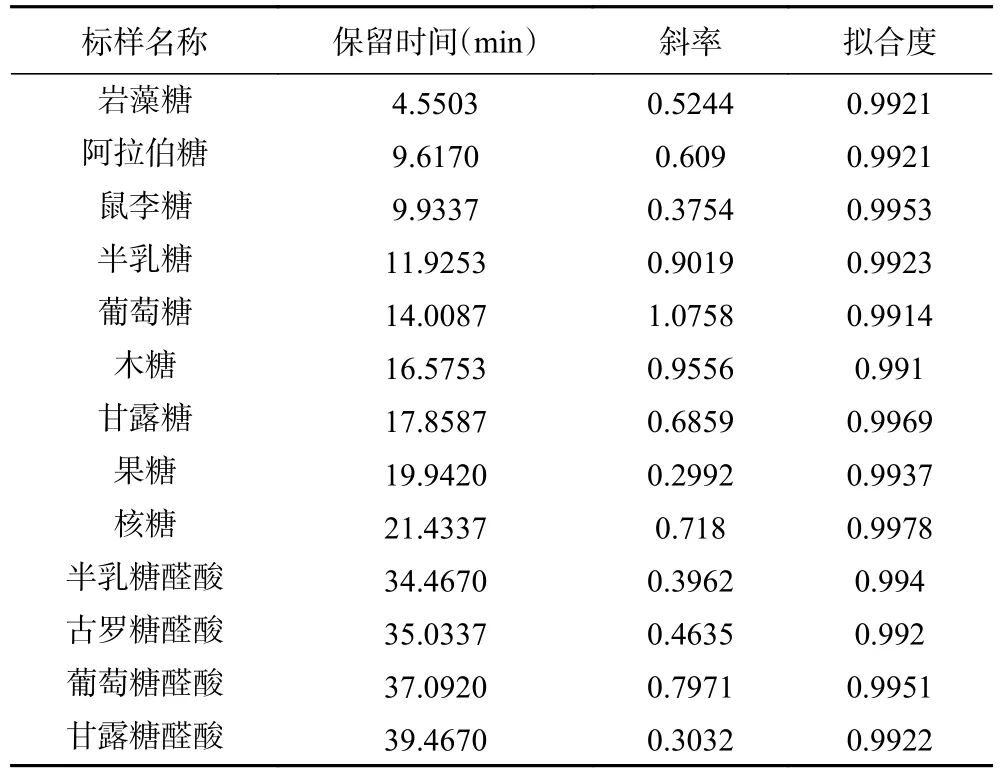
表2 各单糖标曲信息Table 2 Standard curve information of each monosaccharide
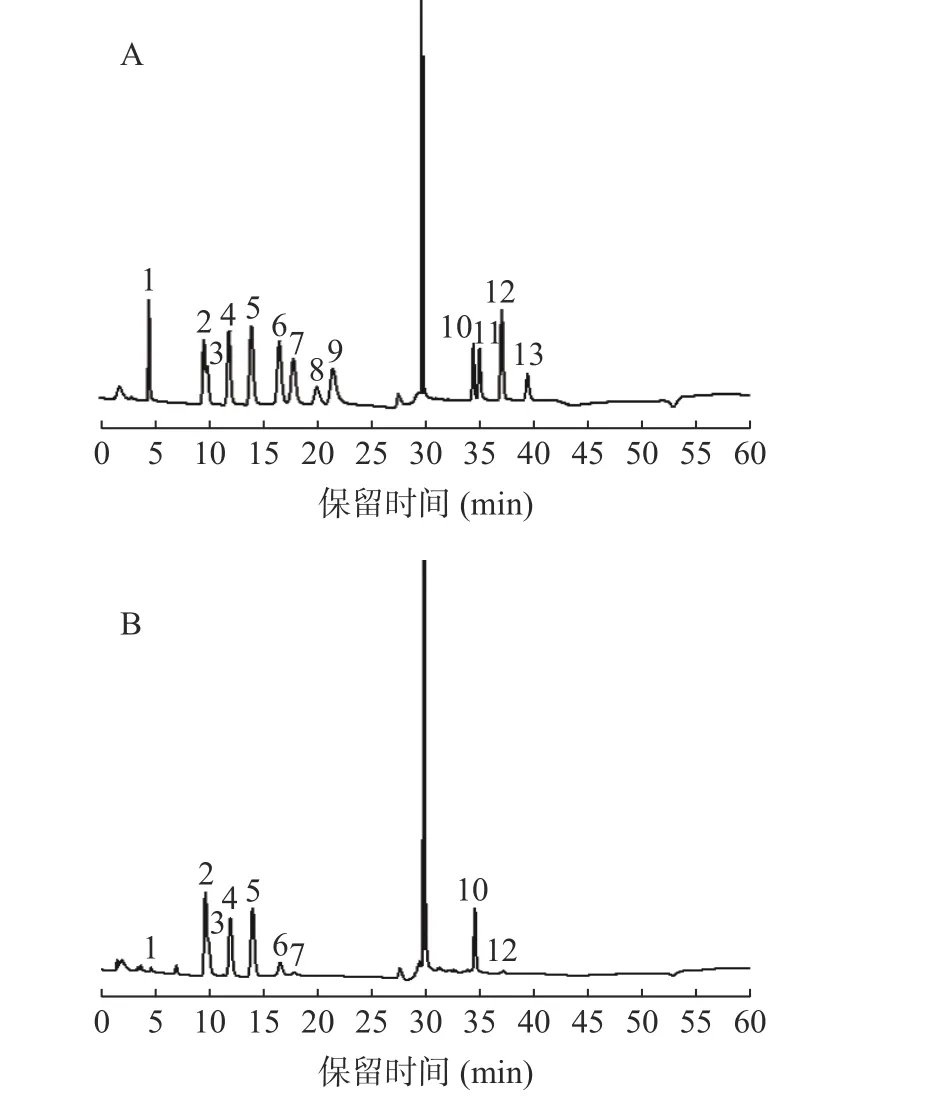
图4 单糖对照品(A)及酸枣果肉多糖(B)中各单糖组成离子色谱图Fig.4 Ion chromatogram of sugar components in monosaccharide control sample (A) and ZJFP (B)
根据所得标准曲线,计算样品中岩藻糖、葡萄糖醛酸、阿拉伯糖、鼠李糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸的含量。种植型ZJFP 中9 种单糖平均含量分别是0.93、0.94、35.09、36.68、25.25、29.86、5.36、4.25、23.41 mg/g,野生型ZJFP 中9 种单糖平均含量分别是1.06、1.06、36.72、43.73、29.27、23.57、5.90、3.66、33.86 mg/g。从图5 中可以看出,两种类型ZJFP 中9 种单糖平均含量最高的是鼠李糖,其次是阿拉伯糖,其中岩藻糖与葡萄糖醛酸含量基本相同,所占比例仅0.4%。两种类型酸枣在发育过程中阿拉伯糖、葡萄糖、半乳糖醛酸、岩藻糖和葡萄糖醛酸五种单糖在多糖中占比增大,鼠李糖、半乳糖、木糖和甘露糖在多糖中占比减少。野生型ZJFP 中半乳糖醛酸占比高达25.00%、葡萄糖醛酸占比也可到1.08%;种植型ZJFP 中半乳糖醛酸占比则为16.26%,葡萄糖醛酸占比为0.64%。种植型酸枣相对与野生型酸枣其ZJFP 中葡萄糖占比较大,可达22.51%,野生型仅为14.10%。

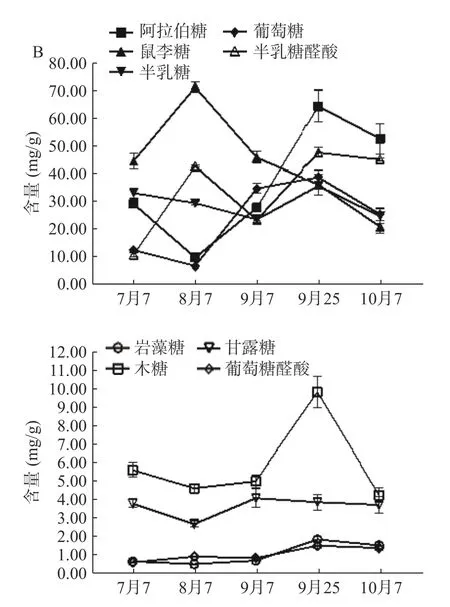
图5 不同时期ZJFP 中各单糖的含量变化Fig.5 Changes in the content of polysaccharides and monosaccharides in ZJFP at different stages
2.4 不同生长时期ZJFP 的DPPH 自由基清除能力测定
从图6 中可以看出,ZJFP 浓度为1.0 mg/mL时,野生型ZJFP 的DPPH 自由基清除率为41.80%~65.36%,在7 月7 日至8 月7 日显著下降(P<0.05),从65.36%降至41.80%,8 月7 日至9 月7 日之间显著上升(P<0.05),自41.80%升至52.46%,9 月7 日至10 月7 日,清除能力无显著变化(P>0.05);种植型ZJFP 的DPPH 自由基清除率在47.40%~60.25%,于7 月7 日至8 月7 日之间显著下降(P<0.05),自60.25%降至47.40%,8 月7 日至10 月7 日间,清除能力无显著变化(P>0.05)。对不同时期ZJFP 含量与DPPH 自由基清除能力进行相关性分析,结果发现不同时期ZJFP 含量与其DPPH 自由基清除能力显著相关(P<0.01),见表3。

表3 ZJFP 含量和DPPH 自由基清除率相关性Table 3 Correlation between ZJFP content and DPPH radical scavenging rate
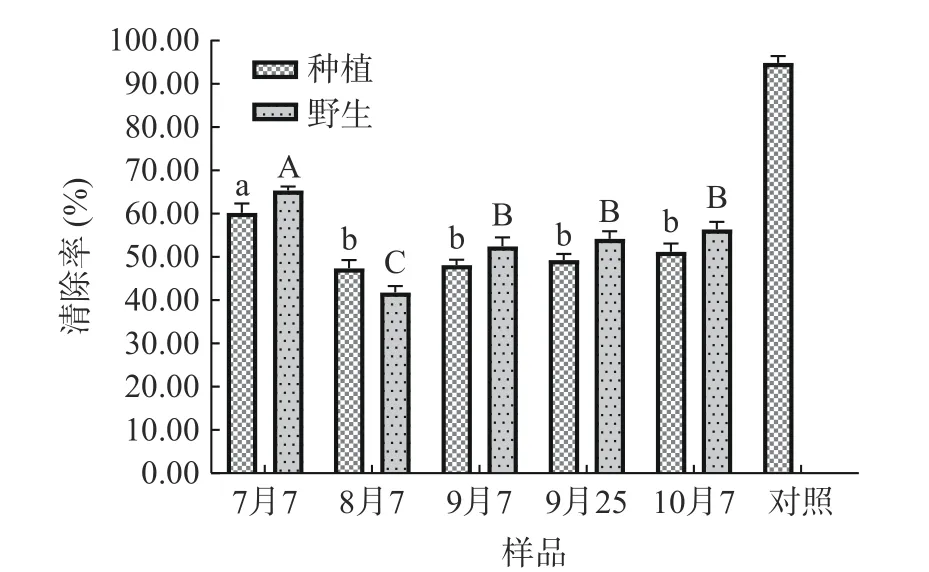
图6 不同时期ZJFP 的DPPH 清除能力Fig.6 DPPH scavenging capability of ZJFP at different stages
3 讨论与结论
本研究对不同时期酸枣的果肉多糖进行含量测定发现,发育过程中果肉多糖含量呈现出先下降后上升的趋势,且发育后期多糖含量低于发育初期。有研究表明酸枣果实总糖量显著低于一些枣类,同时有机酸含量显著高于枣果实[32],这可能是酸枣独特风味的原因。通过对酸枣果肉多糖进行相对分子量测定发现,酸枣果肉多糖可以分为P1(5.23×106Da)、P2(10.03×104Da)、P3(2.03×102Da)和P4(0.39×102Da)四个组分,P2 组分含量相对较高。单糖组成测定结果表明两种类型酸枣果肉多糖均由岩藻糖、葡萄糖醛酸、阿拉伯糖、鼠李糖、半乳糖、葡萄糖、木糖、甘露糖和半乳糖醛酸9 种单糖组成,与种植型相比野生型酸枣果肉多糖中葡萄糖醛酸、半乳糖醛酸所占比例相对较高,成熟期酸枣中还原糖类成分,如阿拉伯糖、半乳糖醛酸、葡萄糖的含量较果实发育初期均出现了明显增长,表明酸枣属于还原糖积累类型果实[33]。DPPH 自由基清除能力测定结果显示,当ZJFP浓度1.0 mg/mL 时,野生型ZJFP 平均清除率可达56.23%,种植型ZJFP 平均可达51.22%高于相同浓度的板枣多糖[34]、骏枣多糖[35]的清除率,表明两种类型酸枣果肉多糖具有较强的DPPH 自由基清除能力。上述研究结果可为酸枣果肉多糖的开发和应用提供参考,同时影响抗氧化能力强弱的因素和多糖代谢的机制仍需进一步探究。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
