真空低温慢煮加工对中华管鞭虾肌肉品质的影响
2024-04-01周寅涛冯绍彪水珊珊刘智禹
周寅涛,冯绍彪,水珊珊,刘智禹,张 宾,*
(1.浙江海洋大学食品与药学学院,浙江舟山 316022;2.浙江海洋大学比萨海洋研究生学院,浙江舟山 316022;3.浙江省海洋开发研究院,浙江舟山 316021;4.福建省水产研究所,福建厦门 361013)
中华管鞭虾(Solenocera crassicornis)又称红虾,其肉质鲜美,富含人体所需氨基酸及钙、镁元素而深受广大消费者追捧[1]。我国中华管鞭虾等虾类水产品多以鲜销为主,但中华管鞭虾中水分含量较高,头部和肌肉组织中内源蛋白酶活跃,加上外源微生物繁殖作用,极易导致其腐败变质[2]。随着虾类消费者群体扩大,研发一种风味品质好、营养价值高的虾类制品显得十分必要。当前,虾类水产品通常采用高温加热来进行杀菌和灭酶处理,这在一定程度上破坏了虾肌肉蛋白质结构和诸多营养物质,同时过度热处理也会导致虾肌肉硬化和蛋白质及脂质氧化。适当的低温、短时间热处理,可在一定程度上减少肌肉中水分流失,且能有效保持产品的风味和质构特性[3]。
真空低温慢煮加热技术(sous vide,SV)在可控的温度(巴氏杀菌温度内)和较短时间下,以最小程度的热处理和最大限度的保留原始状态为模型,将肌肉原料放置于真空袋中精确控制煮制时间并使其熟化,并能达到传统加工灭菌、灭酶的效果[4]。肌肉原料经真空包装后加热,其与水和空气彻底隔绝,可有效抑制各种细菌生长及二次污染,还能减少肌肉中氨基酸、维生素和矿物质等热敏性和水溶性营养成分的损失[3]。Hong 等[5]研究表明,SV 加工后的鸡胸肉菌落总数和大肠菌数显著降低,并且未检出沙门氏菌属。Cosansu 等[6]研究发现加热温度为65~75 ℃生产的海鲜产品鲜嫩多汁,并且70 ℃加热2 min 以上可以有效抑制大多数致病菌的繁殖。与传统100 ℃煮制方式相比,SV 加热由于温和的化学反应和较低的产品蒸煮损失率,肌肉原料中脂肪族和芳香族烃类等挥发性香气可以很好地得以保留[4]。有研究发现,SV 加工后的肉制品具有更浓郁的肉香味和烤制风味[7],并且其色泽、水分含量、口感和蛋白质体外消化率都远高于传统高温烹饪[8]。目前,SV 加热处理主要集中在鸡肉、牛肉、羊肉、猪肉等中[9],关于SV 处理虾类水产品及其对虾肌肉品质的影响研究还相对较匮乏。
本研究通过对比传统热加工和SV 加工两种方式的处理效果,探索SV 处理对中华管鞭虾肌肉理化性质、蛋白质功能及组织结构的影响,旨在为虾类制品生产过程中营养成分保留和肌肉品质保障提供技术参考。
1 材料与方法
1.1 材料与仪器
冰鲜中华管鞭虾 购于浙江舟山国际水产城,平均质量(15±2) g,平均体长(10±1) cm;三羟甲基氨基甲烷(Tris)、硼酸、甲基红-溴甲酚绿指示剂等 均为分析纯,国药集团化学试剂有限公司;蛋白含量测定试剂盒、总巯基含量测定试剂盒、Ca2+-ATPase 活性测定试剂盒 南京建成生物工程研究所有限公司;高效凯氏定氮催化剂片 郑州和顺电子科技有限公司;0.1 mol/L 盐酸标准滴定液 广州和为医药科技有限公司。
MDF-U53V 型超低温冰箱 日本SANYO 公司;DiRECT-Q 型超纯水装置 美国MILLIPORE 公司;CR-10 型便携式色差仪 日本柯尼卡美能达公司;MS-Pro 型物性测试仪 美国FTC 公司;751 UVGD 型紫外-可见光分光光度计 上海第三分析仪器厂;KDN-520 型全自动凯氏定氮仪 山东海能仪器科学仪器有限公司;ECLIPSE E100 型显微镜日本NIKON 公司;SU8100 型扫描电镜 日本HITA CHI 公司。
1.2 实验方法
1.2.1 样品制备 将冰鲜中华管鞭虾流水解冻、沥干后,分为两组:虾仁组(去壳去头制备虾仁,为保持虾仁完整,不去虾线)和带壳虾组(去头,保留虾壳)。将以上两组虾类分别进行SV 处理和传统蒸煮处理。Cosansu 等[6]研究发现海鲜产品70 ℃加热2 min 可以有效抑制大多致病菌的繁殖,并有着较好的质构特性,因此本实验SV 加热温度设置为70 ℃。SV 处理:将单个虾样品放入聚乙烯蒸煮袋中进行真空包装(0.1 MPa 下抽真空,保持14 s),然后浸没于70 ℃恒温水浴中,根据感官评价、质构特性等预实验结果分别保持5、8、10 和12 min(依次记为SV-5、SV-8、SV-10 和SV-12),取出后经冰水冷却至室温,备用。传统蒸煮处理(记为CK):将虾样品置于100 ℃沸水中,持续加热2 min 后,取出后经冰水冷却至室温,备用。
1.2.2 感官特征 感官评定采用定量描述感官评价方法,评价小组由5 名男性和5 名女性组成,参考GB/T 16291.1—2《感官分析分析选拔、培训与管理评价员一般导则》对组员进行选拔培训。组员分别对所有样品进行感官评定,采用评分检验法进行打分,每种加工方式的样品重复评价10 次,各项分值从0(品质最差)到5(品质最好),总分40 分,感官评价标准依照表1。
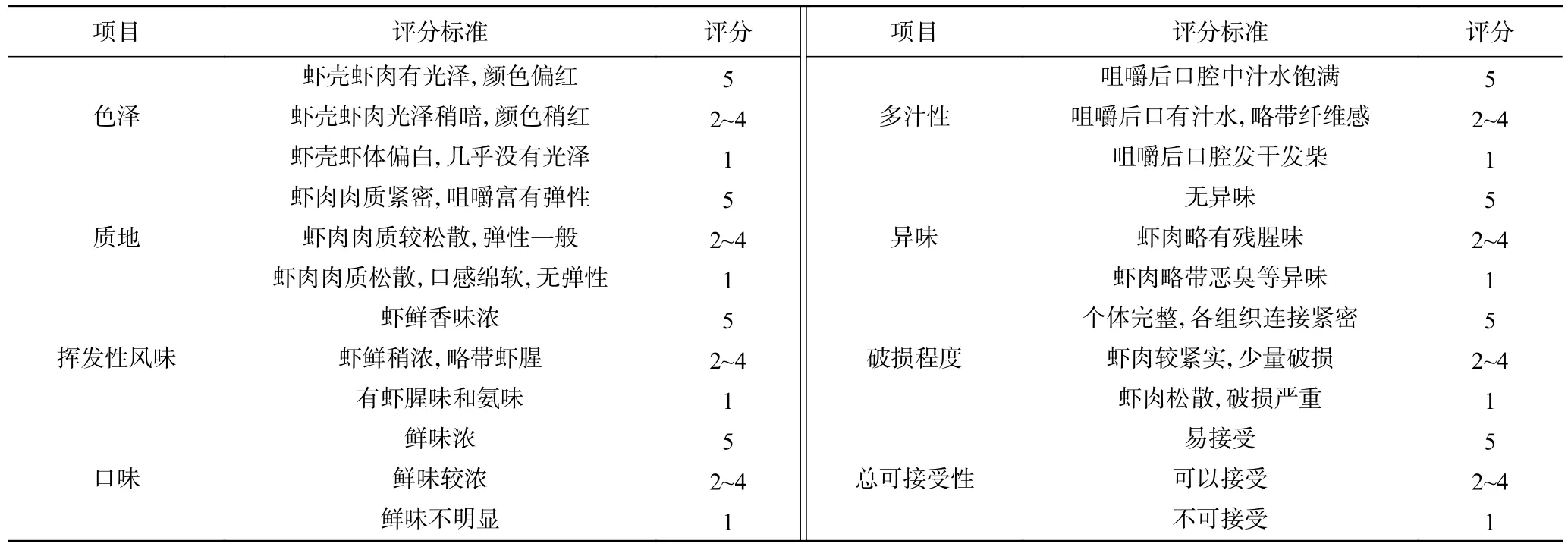
表1 感官评价标准Table 1 Sensory scoring standard
1.2.3 色差测定 采用CR-10 型色差仪,以虾仁背部第二节肌肉为测试点,测定虾仁表面L*值、a*值和b*值。L*为正值表示偏白,a*为正值表示偏红,b*为正值表示偏黄。
1.2.4 水分含量测定 选取6 只虾背部第二节肌肉,混合后切碎,称取2 g 样品(精确至0.00001 g)置于101~105 ℃烘箱中进行干燥处理,干燥至恒重后,通过干燥前后质量变化计算虾仁肌肉中水分含量。
1.2.5 蒸煮损失率测定 新鲜中华管鞭虾表面采用厨房纸吸干后,称其加工前质量(m1);加热处理后中华管鞭虾待其冷却至室温,再次用厨房纸吸干表面水分,称其加工后质量(m2)。根据加工前后中华管鞭虾质量,计算蒸煮损失率:蒸煮损失率(%)=(m1-m2)/m1×100。
1.2.6 质构特性测定 采用TPA 模型进行测定。选取6 只虾仁背部第二节肌肉为测试点,测试探头为P/50,测试速率为3.0 mm/s,样品压缩比40%,保持时间为3 s,触发力为20 g。采用FTC-PRO 软件从每个样品产生的力-时间曲线中,计算虾仁肌肉组织硬度、弹性和咀嚼性。
1.2.7 蛋白质组成测定 参照李志鹏等[10]方法,并略做修改。选取6 只虾背部第二节肌肉,混合后切碎,称取3.00 g 样品,加入5 倍体积10 mmol/L Tris-HCl(pH7.2)缓冲溶液,高速均质30 s 后,4 ℃条件下5000×g 离心10 min,收集上清液;取沉淀重复以上操作1 次。合并两次上清液,得到的即为水溶性蛋白质。用双缩脲法测定水溶性蛋白质含量,同时计算水溶性蛋白质提取率:水溶蛋白质提取率(%)=煮制后虾肉中提取所得水溶蛋白质含量/新鲜虾肉中提取所得水溶蛋白质含量×100。
在最后一次沉淀中加入5 倍体积10 mmol/L Tris-HCl 缓冲液(含0.6 mol/L NaCl;pH7.2),高速均质30 s 后,置于4 ℃冰箱提取1 h,4 ℃条件下5000×g 离心10 min,取上清液即为制备的盐溶性蛋白质溶液。用双缩脲法测定盐溶蛋白质量浓度,同时计算盐溶蛋白质提取率:盐溶蛋白质提取率(%)=煮制后虾肉中提取所得盐溶蛋白质含量/新鲜虾肉中提取所得盐溶蛋白质含量×100。
获得沉淀即为不溶性蛋白质,采用凯氏定氮法测定蛋白质含量[11]。称取0.50 g 沉淀于消化管中,向管中加入2 片催化剂片(1.5 g K2SO4:CuSO4=15:1)和10 mL 浓H2SO4,置于消化器加热消化3 h。消化后冷却至室温,再置于全自动凯氏定氮仪中,收集消化液用0.01 mol/L HCl 滴定。蛋白质换算系数为6.25(经前期测定,新鲜中华管鞭虾水溶性蛋白质含量为80.27 mg/g,盐溶性蛋白质含量为132.85 mg/g)。
1.2.8 肌原纤维蛋白总巯基含量和Ca2+-ATPase 活性测定 肌原纤维蛋白制备方法,参考1.2.7 中盐溶性蛋白的制备方法。采用试剂盒测定肌原纤维蛋白总巯基含量和Ca2+-ATPase 活力,具体方法参照说明书进行。
1.2.9 肌原纤维蛋白溶解度测定 参照刁小琴等[12]方法,并稍做修改。将制备的肌原纤维蛋白用50 mmol/L pH6.2 磷酸盐缓冲液(含有0.6 mol/L NaCl)配制成1 mg/mL 溶液于离心管中,4000×g 离心40 min 后,用考马斯亮蓝测定上清液蛋白质含量,肌原纤维蛋白溶解度(%)=上清液中蛋白质含量/样品中蛋白质含量×100。
1.2.10 苏木精-伊红染色观察分析 为观察熟化后虾仁肌肉的微观结构,参考荣建华等[13]方法,并稍作修改。选取SV 加热10 min 虾仁背部第二节肌肉,浸泡于4%多聚甲醛固定液中,室温下固定24 h,用梯度乙醇脱水后浸蜡包埋、切片,最后用苏木精-伊红进行染色,显微镜观察虾仁肌肉组织结构。
1.2.11 扫描电镜观察分析 参考崔宏博等[14]方法。选取虾仁背部第二节肌肉,将样品组织块切成大小不超过3 mm2块状,置于2.5%戊二醛溶液中,4 ℃条件下固定2 h,固定好样品经过0.1 mol/L 磷酸缓冲液PB(pH7.4)漂洗3 次,每次15 min;然后将组织依次放入30%、50%、70%、80%、90%和100%酒精脱水,每次15 min,最后用乙酸异戊酯浸泡15 min;将脱水后样品放入临界干燥仪内进行干燥,离子溅射仪喷金30 s 左右后,用扫描电镜观察肌肉组织结构。
1.3 数据处理
采用SPSS 26.0 对测定结果进行分析,采用ANOVA 算法进行方差分析,采用Duncan’s 算法进行多重比较分析,判断显著性差异(P<0.05)。采用Origin 2021 软件进行作图。
2 结果与分析
2.1 SV 加工对中华管鞭虾肌肉感官特性的影响
感官评价能直观反映大众对食品的色泽、质地、挥发性风味等感官特性的偏好和接受程度。由图1 可知,CK 组虾肌肉收缩严重、咀嚼后略带纤维感;SV 组虾肌肉色泽更加明亮、咀嚼时富有弹性、鲜香味更足。随着煮制时间增加,SV 组中华管鞭虾肌肉感官评分呈先上升后下降的趋势。当SV 组中华管鞭虾加热5 min 时,SV 虾仁组肌肉色泽较浅、质地较软、有腥味、水分含量较高易破损;SV 带壳虾组肌肉色泽鲜艳,但不易脱壳。当SV 组中华管鞭虾加热12 min 时,SV 虾仁组肌肉弹性上升且腥味有所下降;SV 带壳虾组虾肉易脱壳,并且虾肉饱满完整、色泽鲜亮,咀嚼后口腔中汁水饱满,鲜味较浓郁。与虾仁组对比,带壳虾组肌肉在虾壳的保护下完整性更好,在抽真空受挤压时破损程度较小,且肌肉中汁水相对丰盈。因为CK 组虾经过高温水煮,虾肌肉中的水分大量流失,肌肉质地变得粗糙,感官特征较差。而真空包装的水蒸气传输率较低,产品中水溶性和挥发性物质损失率降低,加上温和的加热温度,虾肉营养和风味成分得到更好的保留[6]。使得SV 组虾肉香味浓郁、汁水饱满、肌肉富有弹性,更受消费者青睐。但在加热过程中,加热时间过短,会引起异味的蛋白水解酶不能完全失活,导致虾仁略带腥味[15];而加热时间过长,虾仁肌肉中水分流失,质地较差。因此,确定中华管鞭虾的SV 加工时间变得尤为重要。

图1 不同煮制条件对中华管鞭虾肌肉的感官特性的影响Fig.1 Effect of different cooking condition on the sensory properties of S. crassicornis muscle
2.2 SV 加工对中华管鞭虾肌肉和虾壳色差值的影响
煮制过程中,中华管鞭虾肌肉和虾壳的色差变化,会直接影响消费者的可接受性。由图2 可知,CK 组(肌肉)L*和b*值均高于SV(肌肉),而CK 组(肌肉)a*值低于SV 组(肌肉);CK 组(虾壳)L*值显著高于SV 组(虾壳)(P<0.05),CK 组(虾壳)a*值显著低于SV 组(虾壳)(P<0.05)。随加热时间延长,SV 组(肌肉)L*和b*值呈上升趋势,a*值先上升后下降;SV 组(虾壳)L*和b*值呈逐渐上升趋势,而a*值呈不断下降趋势。虾仁组(肌肉)L*值高于带壳虾组(肌肉),a*值在煮制8 min 后低于带壳虾组(肌肉),b*值显著高于带壳组(肌肉)(P<0.05)。研究表明,加热过程中虾仁肌肉L*值的变化与细胞内外水分迁移有关[16]。CK 组由于加热温度较高,肌肉中自由水和不易游动水运动速率加强,使得自由水快速析出,从而导致L*值高于SV 组。随着煮制时间延长,SV 组虾仁肌肉组织收缩加剧,汁液流失增加,细胞内外水分迁移到虾仁表面,表面的游离水增加光反射而使L*值升高。
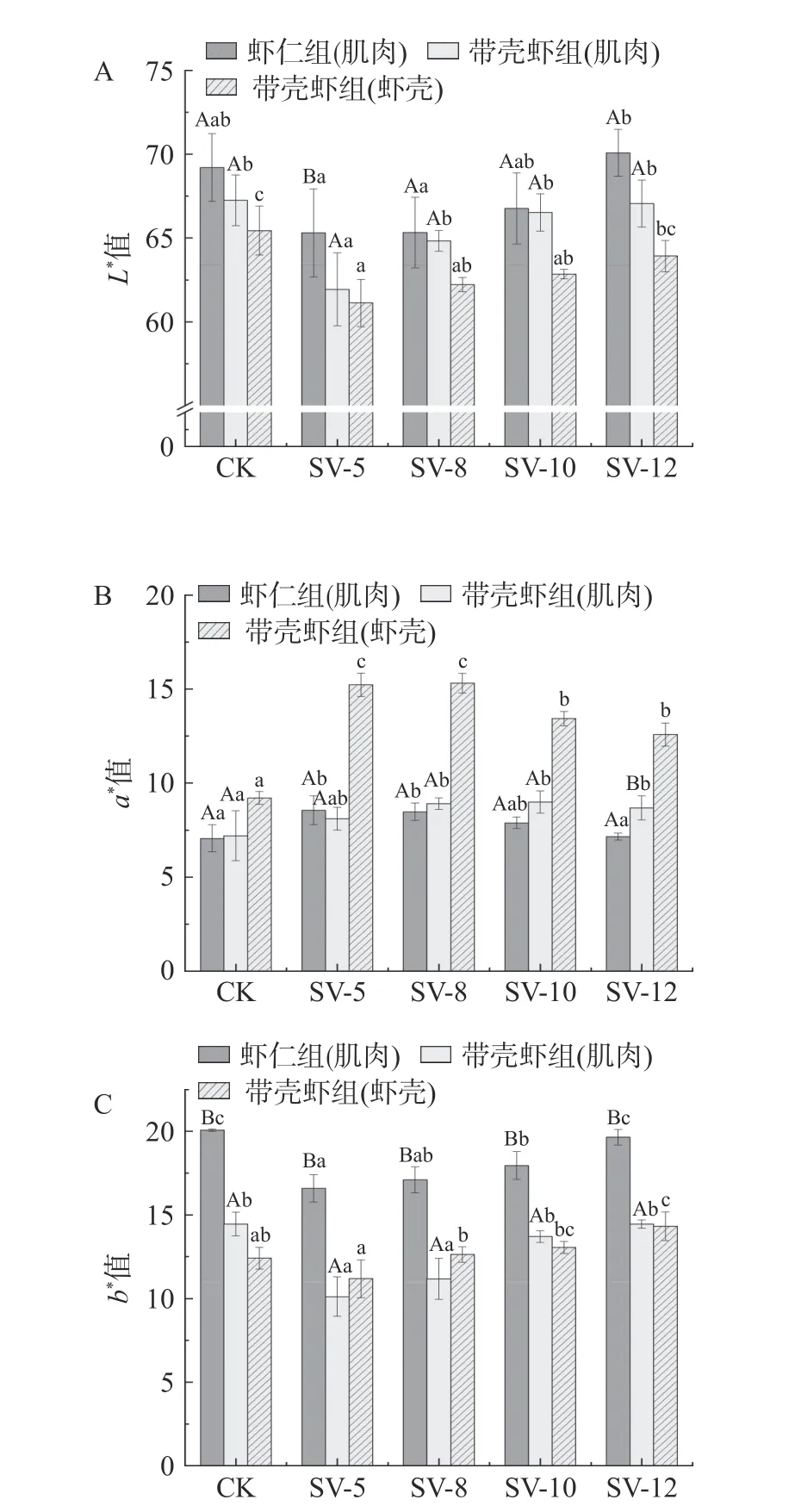
图2 不同煮制条件对中华管鞭虾肌肉和虾壳L*值(A)、a *值(B)和b*值(C)的影响Fig.2 Effect of different cooking conditions on the L* values(A), a* values (B) and b* values (C) of S. crassicornis muscle and shell
肌肉和虾壳a*值变化主要与游离态虾青素含量有关。CK 组虾直接在沸水中加热,高温使脂肪酸和甲壳素迅速破坏,结合态虾青素不断溶出到水中,肌肉和虾壳中游离态虾青素降解严重[16]。CK 带壳虾组(虾壳)出现明显的大片白斑区域,导致CK 组(肌肉)和(虾壳)a*值低于SV 组。SV 加热,隔绝了虾仁与水的直接接触,有效降低了水溶性色素的析出,使虾肉更为鲜亮[15]。煮制初期,SV 组虾仁肌肉中蛋白质发生热变性,复合物中的虾青素不断游离出来,肌肉组织中游离态虾青素含量增加,致使肌肉a*值上升。SV 虾仁组和SV 带壳虾组分别在煮制时间超过8 min 和10 min 后,结合态虾青素基本游离完毕,游离态虾青素受热降解,造成肌肉a*值略有下降。
魏健等[17]研究发现,肌肉b*值变化与脂肪氧化产物产生密切相关。CK 组在没有隔绝空气的条件下,氧化反应更加剧烈,并且CK 虾仁组肌肉直接暴露在空气中煮制,导致CK 虾仁组肌肉b*值最高。由于真空包装的厌氧条件和低透氧性,SV 加热通过减少氧化来保护虾仁的颜色[15]。随着煮制时间延长,SV 组肌肉中脂肪等物质受热氧化,氧化产物和蛋白质氨基酸侧链发生非酶褐变等反应,导致SV 组b*值上升。
2.3 SV 加工对中华管鞭虾肌肉中水分含量的影响
水分含量是影响水产品口感的重要参数。由图3 可知,CK 组虾肌肉中水分含量显著低于SV 组(P<0.05);随着煮制时间延长,SV 组虾肌肉中水分含量下降;在相同加热条件下,虾仁组肌肉中水分含量显著低于带壳虾组(P<0.05)。分析上述现象,CK 组煮制温度较高,肌肉中游离水的运动速率较快,导致水分大量流出;并且在相对较高温度下,肌肉纤维会纵向收缩,导致水分大量流失[3]。蛋白质经过持续加热,其三级结构、二级结构依次被破坏,虾肌肉组织中的亲和水、结合水也逐渐被释放出来,肌纤维开始收缩和断裂,导致水分含量下降[16]。在煮制时,虾壳对虾肉有一定的隔热保护作用,减少了蛋白质结构的破坏。但当SV 带壳虾组加热到10 min 后,肌肉中水分含量变化不显著(P>0.05),这可能是因为胶原蛋白在此温度下持续受热变性,生成可溶于水的明胶,同时虾壳的保护作用吸收了一部分水分,从而减缓了肌肉中水分的流失。综上所述,中华管鞭虾在SV 加工条件下,水分含量下降平缓,带壳加热可以更好维持虾肌肉中的水分。

图3 不同煮制条件对中华管鞭虾肌肉中水分含量的影响Fig.3 Effect of different cooking conditions on the moisture of S. crassicornis muscle
2.4 SV 加工对中华管鞭虾蒸煮损失率的影响
蒸煮损失率是肌肉系水力的重要指标,肌肉在煮制过程中会伴随着汁液流失,流失的汁液包括肌肉中自由水、肌纤维中水溶蛋白、盐溶蛋白和不溶蛋白及脂肪等[17]。由图4 可知,CK 组蒸煮损失率显著高于SV 组(P<0.05),SV 组蒸煮损失率随着煮制时间延长呈上升趋势,虾仁组蒸煮损失率高于带壳虾组。分析原因可知,CK 组虾受热强度高,肌纤维和结缔组织受热收缩严重,导致虾仁蜷缩明显,蛋白质变性后肌束间间隙较大,肌肉持水力较差,蒸煮损失严重。随着加热时间延长和加热温度升高,虾肌肉中蛋白质肽链展开,疏水基团暴露,蛋白质表面电荷数量和分布情况发生改变,导致蛋白质与水结合的能力下降[18]。带壳虾组肌肉在虾壳的隔热保护作用下,虾肉中蛋白质变性程度有所延缓;而虾仁组受热中心到表面的距离较短,肌肉组织受热发生汁液分离,蒸煮损失率增加。在煮制10 min 后,SV 带壳虾组蒸煮损失率变化不显著,可能与胶原蛋白变性溶解形成凝胶有关,使肌肉具有一定的保水性[19]。SV 带壳虾组在加热12 min 后仍保持较低的蒸煮损失率,说明SV 带壳加热可以有效降低虾肉在加工过程中营养物质的流失,更好地保留虾肉本身的风味物质。
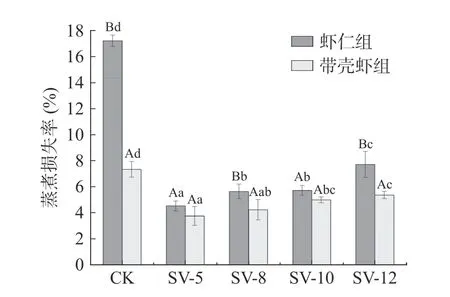
图4 不同煮制条件对中华管鞭虾蒸煮损失率的影响Fig.4 Effect of different cooking conditions on mass loss rate of S. crassicornis muscle
2.5 SV 加工对中华管鞭虾肌肉质构的影响
虾类水产品在煮制过程中,肌肉中水分含量、胶原蛋白含量、弹性蛋白含量和肌纤维等诸多因素均会影响虾肌肉的质构特性[20]。由表2 可知,CK 组肌肉硬度和咀嚼性都显著高于SV 组(P<0.05)。这可能与CK 组虾肉受热温度较高,引起肌原纤维蛋白完全变性,使肌肉纤维聚集、肌节收缩,导致肌纤维密度变大有关。而CK 组肌肉弹性显著高于SV 组(P<0.05),可能是传统加工方式下,虾肉受热剧烈,虾肉中大分子团聚集交联、虾肉密度上升和不溶蛋白大量形成,具有伸展性的弹性蛋白比例不断上升。邓丽等[21]研究热加工过程中鲍鱼腹足蛋白间作用力及其质构特性发现,在低温度加热条件下(60 °C),离子键、氢键和疏水键对凝胶稳定性起主要作用,此时形成的凝胶较柔软;在传统加热温度条件下(100 °C),二硫键和非二硫共价键为维持凝胶稳定的主要作用力,此时凝胶特性较佳,富有弹性,其与本实验结果相一致。
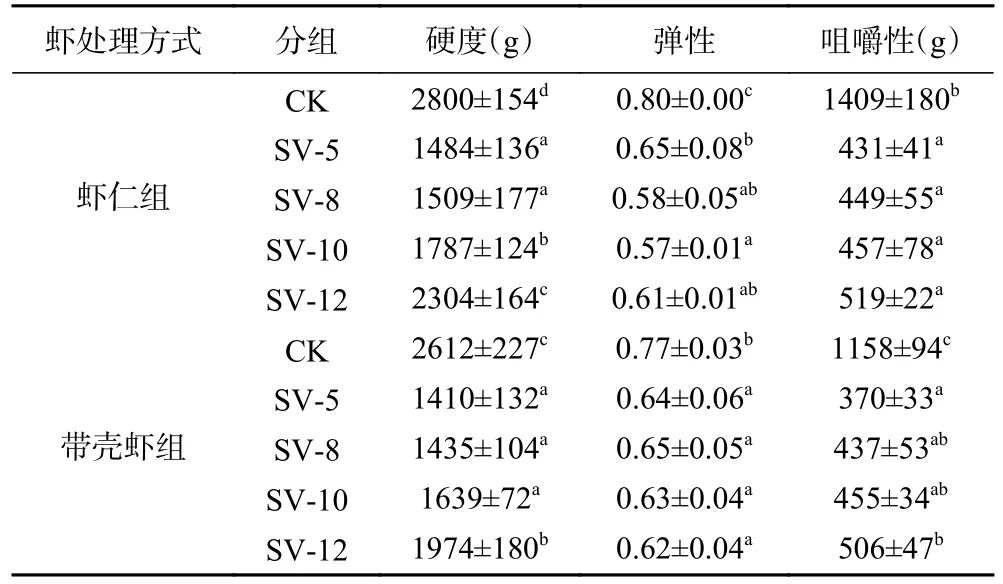
表2 不同煮制条件对中华管鞭虾肌肉质构的影响Table 2 Effect of different cooking conditions on the texture properties of S. crassicornis muscle
由表2 可知,SV 组肌肉硬度和咀嚼性随着煮制时间延长不断上升。在煮制初期,由于虾仁组和带壳虾组虾肉中心部位的肌肉还没有熟化,从而使肌肉硬度变化不显著(P>0.05)[22];延长煮制时间,肌肉硬度明显上升(P<0.05),是虾肉结缔组织脱水收缩及蛋白质发生深度变性等共同作用的结果[23]。Botinestean 等[24]研究发现,在SV 加工过程中,肌肉咀嚼性随着肌肉中心温度升高而升高,随着加热时间延长中心温度超过60 ℃时,肌肉中凝结物质形成,造成肌肉硬度增加,与本实验结果一致。并且在蒸煮损失率和水分含量的测定中也得到了证实,蒸煮损失率较高的虾仁组肌肉硬度和咀嚼性高于带壳虾组。SV 虾仁组肌肉弹性先呈下降的趋势,可能与一开始肌原纤维蛋白变性加剧,断裂成小分子肽段有关;随后又聚集交联形成大分子团,从而肌肉使弹性再次上升。这与傅新鑫[19]研究南美白对虾热加工时硬度和咀嚼性增加,弹性先下降后上升的结果相一致。CK 加工的中华管鞭虾,因水分含量降低会导致硬度和咀嚼性大幅上升,存在干硬、难以咀嚼等问题。对比发现,SV 加工的中华管鞭虾硬度、咀嚼性和弹性较为适中,口感较好,与感官评分结果一致。
2.6 SV 加工对中华管鞭虾肌肉中蛋白质组成的影响
肌浆蛋白和肌原纤维蛋白是中华管鞭虾肌细胞中的主要构成蛋白质。前者分布于肌浆中,主要包含一些新陈代谢相关的酶类以及肌红蛋白等,属水溶性蛋白质;后者包括肌球蛋白和肌动蛋白等,占肌肉总蛋白质的60%以上,属盐溶性蛋白质[16]。由表3 可知,CK 组肌肉中水溶性蛋白质、盐溶性蛋白质和总蛋白质含量显著低于SV 组(P<0.05)。SV 组中华管鞭虾随着煮制时间延长,肌肉中水溶性蛋白质、盐溶性蛋白质和总蛋白质含量均呈下降趋势;而SV 虾仁组肌肉中不溶性蛋白质含量呈先上升后下降趋势,SV 带壳虾组肌肉中不溶性蛋白质含量呈上升趋势。分析原因,可能是CK 组处理过程中过高的加热温度导致虾仁肌肉肌纤维快速受热收缩断裂、肌膜发生破裂,导致部分蛋白质流失到水煮液中,造成水溶性蛋白质和总蛋白质含量急剧下降。而SV 处理由于较低的加热温度最大限度减少热敏蛋白质的变性[25],有助于维持虾肉肌肉细胞结构,但随加热时间延长,肌肉受热程度不断上升,蛋白质开始缓慢变性,证明SV 处理有效提升了虾类产品品质。肌纤维蛋白提取率可以反映肉品的熟化程度,当其低于10%时,肉品达到熟化状态[16]。CK 虾仁组肌肉中肌原纤维蛋白含量为8.67 mg/g,提取率为6.52%;CK 带壳虾组肌肉中肌原纤维蛋白含量为10.84 mg/g,提取率为8.16%。由此可知,CK 组肌肉已经完全熟化。SV 组虾在加热5~12 min 过程中,SV 虾仁组肌肉中肌原纤维蛋白提取率从8.62%降至7.46%,而SV 带壳组肌肉中肌原纤维蛋白提取率从10.49%降至9.09%。由此表明,SV 虾仁组肌肉在加热5 min 时已完全熟化,而SV 带壳虾组肌肉在5~8 min 阶段还未完全熟化,到了10 min 时完全熟化。同时,SV 组虾肌原纤维提取率显著高于CK组(P<0.05)。进一步分析表3 可知,煮制过程中带壳组肌肉中水溶性蛋白质和盐溶性蛋白质含量降幅均小于虾仁组,表明虾壳在加工过程中隔绝了一部分热量,减少了蛋白质变性。此外,肌原纤维蛋白比肌浆蛋白更易发生高温变性,可能与其自身蛋白质组分以及空间结构有关[16]。虾肉受热后,肌原纤维蛋白提取率呈先快速降低后缓慢降低趋势,这与傅新鑫[19]在研究南美白对虾热加工特性时发现的结果一致。由上可见,CK 组虾在较短时间内蛋白质变性严重,SV 组虾在加热12 min 后各类蛋白质提取率均高于CK 组(P<0.05)。在长时间的加工下,SV 加热技术能够更好控制蛋白质的变性程度,从而保持虾肉品质。

表3 不同煮制条件对中华管鞭虾肌肉中蛋白质组成变化的影响Table 3 Effect of different cooking conditions on the protein contents of S. crassicornis muscle
2.7 SV 加工对中华管鞭虾肌原纤维蛋白总巯基含量和Ca2+-ATPase 活性的影响
巯基在水产品蛋白质功能性基团中最具活性,对肌肉蛋白质结构稳定具有重要影响作用。在热加工过程中,巯基易被氧化形成二硫键,其含量的变化在一定程度上反映了蛋白质的变性程度[26]。由图5A 可以看出,CK 虾仁组肌原纤维蛋白总巯基含量为23.01±0.75 nmol/mg,低于CK 带壳虾组24.54±0.68 nmol/mg,且CK 组肌原纤维蛋白总巯基含量低于SV 组。这与虾肉受热强度有关,在CK 加热条件下,虾肉蛋白质快速变性,短时间内总巯基含量大幅降低。SV 虾仁组肌原纤维蛋白总巯基含量随着加热时间延长,呈平稳下降趋势。SV 带壳虾组肌原纤维蛋白总巯基含量在煮制5 min 后下降显著,在8 min 时开始趋于稳定。随着煮制时间延长,虾肉中维持蛋白质构象稳定的离子键、氢键作用力下降,肽链舒展开,包埋在内部的巯基暴露出来,被氧化形成二硫键,使得总巯基含量减少[27]。潘锦锋等[28]在研究草鱼肌原纤维蛋白热稳定性时发现,在60 ℃以上加热,草鱼肌肉中总巯基含量随时间延长下降显著。虾仁组肌原纤维蛋白总巯基含量低于带壳虾仁组,可能在去壳条件下,虾仁中心温度到达60 ℃所需时间更短,SV 虾仁组肌原纤维蛋白在5 min 时已经完全变性。潘锦锋等[28]还研究发现,加热过程中,在草鱼肌原纤维蛋白变性完全后,巯基含量趋于稳定,与本实验的结果一致。

图5 不同煮制条件对中华管鞭虾肌原纤维蛋白总巯基含量(A)和Ca2+-ATPase(B)活性的影响Fig.5 Effect of different cooking conditions on the total sulfhydryl content (A) and Ca2+-ATPase activity (B) of S.crassicornis myofibrillar proteins
肌球蛋白具有ATP 酶活性,Ca2+-ATPase 主要位于肌球蛋白头部球形ATP 结合区,因此Ca2+-ATPase 活性可以反映肌球蛋白分子完整性。由图5B 可知,CK 组Ca2+-ATPase 活性与虾仁组SV-8、SV-10、SV-12 和带壳虾组SV-10、SV-12 无显著性差异(P>0.05),可能与肌球蛋白完全变性有关。Ogawa 等[29]研究鲤鱼肌肉蛋白热稳定时,发现鱼块在蒸制1 min 时,Ca2+-ATPase 酶活力大幅度下降,肌球蛋白活性头部已被完全破坏,在蒸制2 min 后趋于稳定。SV 虾仁组虾在加热5~8 min 过程中,Ca2+-ATPase 活性从0.061 U/mg 下降至0.047 U/mg,8 min后活性无显著变化(P>0.05),而SV 带壳虾组Ca2+-ATPase 活性呈稳定下降趋势。由于虾肉受热后蛋白质原有构象发生改变,肌球蛋白头部与Ca2+-ATPase 酶活力有关的SH1和SH2基团遭到破坏,导致Ca2+-ATPase 酶 活 下 降[22]。Kittiphattanabawon等[30]研究也指出,蛋白质中总巯基含量的下降往往也伴随着 Ca2+-ATPase 活性的不断下降,表明总巯基含量的下降与Ca2+-ATPase 活性之间具有一定的相关性。与图5A 总巯基含量变化趋势相同。
2.8 SV 加工对中华管鞭虾肌原纤维蛋白溶解度的影响
肌原纤维蛋白溶解度是评价肌肉品质重要的标志之一,是蛋白质与蛋白质、蛋白质与水之间相互作用的结果,受温度、离子强度和共溶质等多种因素的影响。由图6 可知,CK 组溶解度显著低于SV 组(P<0.05),可能在未抽真空条件下,肌肉大面积与氧气接触,增强了基团氧化[3]。SV 组肌原纤维蛋白溶解度随着加热时间延长而下降,这与总巯基含量趋势基本相同。在加热过程中,活性巯基等基团氧化,肌球蛋白与水之间作用力减小,致使肌原纤维蛋白溶解度下降[31]。与带壳虾组相比,虾仁组在加工过程中,虾肉中更多肌球蛋白被打开,巯基完全暴露,随着加热时间的延长,氧化形成二硫键,组成丝状肌球蛋白,导致盐溶性蛋白质下降。另外,高温导致虾肉蛋白质结构发生改变,维持结构稳定的氢键和分子间作用力遭到破坏[27],表面氨基酸残基的疏水性增强,蛋白质分子展开成氨基酸长链,电荷频率发生改变,长链之间形成分子间氢键成团聚集,导致肌原纤维蛋白溶解度下降[32]。胡亚丽[33]在研究罗非鱼热变性聚集时发现,蛋白质在加热过程中变性程度越大,其蛋白质聚集和沉淀越明显,溶解度就越低,与本研究结果相一致。可见,SV 加工中华管鞭虾在一定程度上缓解蛋白质变性进程,延长加热时间会导致肌原纤维蛋白溶解度显著下降,在虾肉熟成后停止加热可以更好地保持虾肉品质。

图6 不同煮制条件对中华管鞭虾肌原纤维蛋白溶解度的影响Fig.6 Effect of different cooking conditions on the solubility of S. crassicornis myofibrillar proteins
2.9 HE 染色观察SV 加工对中华管鞭虾肌肉组织结构的影响
在不同处理下观察虾仁肌肉横截面微观结构变化发现,新鲜虾仁肌纤维排列紧密,组织结构间仅有少量的空隙(图7A)[34]。CK 组肌纤维胞间隙增大明显,肌丝变细并伴有断裂(图7B 和7C)。这些空隙可能是随着虾仁肌肉汁液损失而出现,虾肉在加工过程中,肌纤维收缩变性,细胞汁液流失严重,破坏原有空间结构,使得肌束间空隙增大。传统加热方式在未隔绝空气条件下,高温加快基团氧化,增加了肌原纤维蛋白间的疏水力和共价力,从而导致肌丝间接接触增强[35]。与CK 组相比,SV 组(图7D 和7E)肌肉结缔组织排列紧密,肌纤维破坏程度较小,肌纤维间隙较小且均匀。在SV 处理下蛋白质变性程度相对较小,降低肌纤维的聚集[27]。虾仁组(图7B 和7D)与带壳虾组(图7C 和7E)相比,虾仁组肌纤维排列混乱,结构更加松散,肌丝变细断裂明显,可能虾仁在去壳条件下加热,肌肉受热强度高,肌内膜分裂严重,导致肌肉组织的网状结构遭到严重破坏,也证实SV 带壳加热可以更好维持虾仁肌肉微观结构。

图7 HE 染色观察中华管鞭虾肌肉组织结构(放大倍数:500 ×;切面:横切)Fig.7 Histological structure of S. crassicornis muscle tissues analysed by HE staining (Magnificence: 500 ×; section: crosscut)
2.10 SEM 观察SV 加工对中华管鞭虾肌肉组织结构的影响
如图8 所示,通过扫描电镜高倍镜观察虾仁肌肉纵切面发现,新鲜虾仁(图8A)结构规则清晰,肌束排列紧密、直挺、结构完整,肌束膜将肌纤维紧密束在一起。CK 组(图8B 和8C)肌束膜破裂、肌束结构发生紊乱并断裂,肌束之间空隙较大,肌纤维收缩团聚。CK 虾仁组(图8B)与CK 带壳虾组(图8C)相比,CK 虾仁组肌束膜和肌内膜破损严重,各肌束内单根肌纤维断裂数量明显增多,连接松散,组织与组织之间空隙增大,肌纤维与肌内膜剥离。与CK 组相比,SV 组(图8D 和8E)肌束排列紧密。与新鲜组(图8A)相比,SV 组部分肌束膜轻微破裂,肌束收缩空间增大,肌内膜破损,肌纤维裸露出并伴有少量断裂的情况。SV 带壳虾组(图8E)组织结构完整性较好,肌束膜破裂,但单根肌纤维间仍较为紧密,肌束表面有少量颗粒。由于肌肉蛋白质发生热变性后,致使肌浆蛋白溶出,覆盖在肌束表面,形成颗粒状物质。观察图8 可直观发现,SV 组肌纤维微观结构完整性优于CK 组,带壳虾组优于虾仁组。刘晶晶[36]研究煮制温度和时间对肌肉微观结构影响中指出,肌肉在加热过程中,肌节发生聚合收缩,导致结缔组织间隙增大,并随着心中温度升高持续发生断裂,与本文研究结果相符。综上所述,SV 带壳虾组在保证虾肉完全熟化的情况下,能有效减缓加工过程中虾肉中汁液流出和组织结构破坏。

图8 SEM 观察中华管鞭虾肌肉组织结构(放大倍数:1000 ×;切面:纵切)Fig.8 Scanning electron microscopic (SEM) images of S. crassicornis muscle tissues (Magnificence: 1000×; section: slitting)
3 结论
本研究对比分析了传统沸水煮制和真空低温慢煮两种加热方式对中华管鞭虾肌肉色泽、水分含量、蒸煮损失、质构特性、蛋白质含量及提取率、肌原纤维蛋白总巯基含量、Ca2+-ATPase 活性以及肌肉组织结构的影响。结果发现,SV 组虾肌肉中水分含量显著高于CK 组,并且有着较低的蒸煮损失率,一定程度上影响了虾仁硬度和咀嚼性,降低了咀嚼后的纤维感,使虾肉有较好的质地。SV 加热后虾肉和虾壳L*、a*值增大,虾肉和虾壳的色泽鲜亮与CK 加热后的色泽接近。煮制后肌肉蛋白质变性,CK 组和SV组虾肉中盐溶性蛋白含量、总巯基含量和Ca2+-ATPase 活性都下降较快,但SV 组值高于CK 组。溶解性与肌原纤维蛋白含量的变化趋势相同,均是随着加热时间延长呈下降趋势。通过微观结构观察发现,SV 煮制方式可以更好保持虾肉组织结构完整,相对CK 组,SV 组虾肌纤维清晰、排列整齐。综上,SV 是一种优于传统蒸煮的热处理方式,能够保持虾肉本身的品质特性。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
