2型糖尿病Gd-EOB-DTPA增强MRI肝肾影像改变
2024-03-01孙昊洋张文玉张文龙
孙昊洋, 张文玉, 张文龙
钆塞酸二钠(gadoxetate disodium,Gd-EOB-DTPA)是肝胆特异性MRI对比剂,其特殊的化学基团(EOB)可被肝细胞膜上的有机阴离子转运多肽(organic anion-transporting polypeptides,OATPs)介导进入肝细胞内[1],再通过多药耐药蛋白2排泄至胆道系统,从而在肝胆期完成肝细胞内外循环过程,此过程可以反映肝细胞的功能状态[2]。根据这一特性Gd-EOB-DTPA广泛应用于肝肿瘤的诊断、肝硬化患者的肝功能评价、肝脏术后肝功能衰竭的预测以及肝转移瘤化疗后并发症的诊断等[3-6]。经肝胆途径、肾脏途径各排泄体内约50%的Gd-EOB-DTPA。
2型糖尿病(type 2 diabetes,T2D)在我国及世界范围内的发病率逐年增高,我国老年人约30%罹患该病,已经成为公共健康安全领域的一项重大挑战[7-9]。T2D可影响中枢神经系统等全身多个器官,还可抑制肝细胞OATPs的功能或表达[10],对肝功能造成一系列影响。目前对于T2D患者Gd-EOB-DTPA增强MRI肝肾改变的研究很少。本研究旨在探讨T2D患者行Gd-EOB-DTPA增强MRI检查时肝肾影像的变化规律。
材料与方法
1.研究对象
回顾性搜集2021年3月-2023年1月因肝脏占位在本院行Gd-EOB-DTPA增强MRI检查的住院患者。病例纳入标准:①肝肾功能正常;②患有T2D(观察组)或未患有T2D(对照组);③年龄大于18岁。病例排除标准:①存在肝硬化、脂肪肝、病毒性肝炎、肝纤维化、肝多发占位(占位数≥5)等肝弥漫性病变;②有肾、胆囊或部分肝切除手术史;③存在门脉栓塞、胆系梗阻或泌尿系梗阻;④患者体型原因致扫描野内双肾未完全显示。参照上述纳排标准,依据患者的既往史、入院后的肝肾功能等实验室检查、B超等影像检查结果进行研究对象的筛选。最终82例患者纳入本研究,其中男44例,女38例,年龄(58.13±11.34)岁。观察组34例,对照组48例,搜集两组患者的临床资料,包括年龄、性别、入院诊断、糖尿病情况等。本研究经所在机构伦理委员会批准,免除研究对象知情同意。
2.检查方法
MRI检查采用Siemens MAGNETOM Skyra 3.0T磁共振扫描仪,选用18通道体部相控阵线圈,在注入对比剂前后使用快速动态增强成像序列采集T1WI及其他序列图像。扫描参数:TR 3.97 ms,TE 1.29 ms,层厚6 mm,翻转角9.0°,视野380 mm×320 mm,矩阵360×100%。使用高压注射器注射对比剂Gd-EOB-DTPA(普美显/Primovist,拜耳先灵药业,德国),剂量0.025 mmoL/kg,流率1.0 mL/s,之后采用1.0 mL/s的流率推注25 mL生理盐水。对比剂注射完毕后20~35 s行动脉早、中、晚期扫描,60 s行门静脉期扫描,5 min行移行期扫描,20 min行肝胆期扫描,同时获得肝、肾多期动态扫描图像,扫描完成后将图像数据上传并进行评估。
3.影像分析
两位放射科医师(工作经验分别为5年、12年)在对患者临床信息不知情的前提下分别对影像资料进行评估,评估内容包括:①在工作站对患者肝脏的肝胆期图像进行感兴趣区(ROI)选取,每个ROI面积尽量大,并尽量远离主要胆管、大血管及病灶;记录ROI的信号强度(signal intensity,SI)。分别记录肝左外叶、左内叶、右前叶、右后叶等四处SI,取平均值作为肝脏SI,记作SIL;②记录平扫T1WI图像肝门层面的双侧竖脊肌SI的平均值,记作SIM;③记录肝胆期肾皮质、肾髓质的SI(肾皮髓质的分区以平扫图像作为参考)。测量层面为肾门头侧、肾门、肾门足侧三个层面,每个层面均记录双肾的肾皮质、肾髓质各一处的SI,取双肾平均值作为肾皮质、肾髓质SI,肾皮质、髓质分别记作SIRc、SIRm。
分别计算肝胆期肝脏相对SI(relative SI in the liver,RL)、肾皮质相对SI(relative SI in the renal cortex,Rrc)、肾髓质相对SI(relative SI in the renal medulla,Rrm)、肾皮髓质SI的相对差异(relative differences in SI between renal cortex and medulla,Rc-m)。RL、Rrc、Rrm、Rc-m的计算公式为:RL=SIL/SIM;Rrc=SIRc/SIM;Rrm=SIRm/SIM;Rc-m=(SIRc-SIRm)/SIM。
4.统计学分析
采用SPSS 25.0软件进行统计学分析。正态分布的计量资料以均数±标准差表示,采用独立样本t检验进行组间比较;偏态分布的计量资料以中位数(四分位数间距)表示,采用Mann-WhitneyU检验进行组间比较。两组性别的比较采用χ2检验。若RL、Rrc、Rrm、Rc-m中存在组间差异有统计学意义的变量(即阳性变量),则采用受试者工作特征(receiver operating characteristic,ROC)曲线评价阳性变量鉴别诊断T2D的效能。采用组内相关系数(intraclass correlation coefficient,ICC)评估两位医师间阳性变量数值的一致性。以P<0.05为差异有统计学意义。
结 果
1.临床资料
观察组患者34例,其T2D病程为6个月~17年,其中29例接受口服药物(如二甲双胍)治疗,5例采用皮下注射胰岛素治疗。观察组的随机血糖<11.1 mmol/L,糖化血红蛋白(HbA1c)≤7.1%,无糖尿病足等严重糖尿病并发症发生。对照组患者48例。两组患者的年龄、性别、体质指数、肝脏原发肿瘤情况见表1,两组患者的年龄、性别、体质指数差异均无统计学意义(P均>0.05)。

表1 两组患者的一般资料及肝脏原发肿瘤情况
2.影像分析结果
观察组的RL、Rc-m均较对照组降低,差异有统计学意义(P<0.05),两组的Rrc、Rrm差异均无统计学意义(P>0.05,表2,图1、2)。
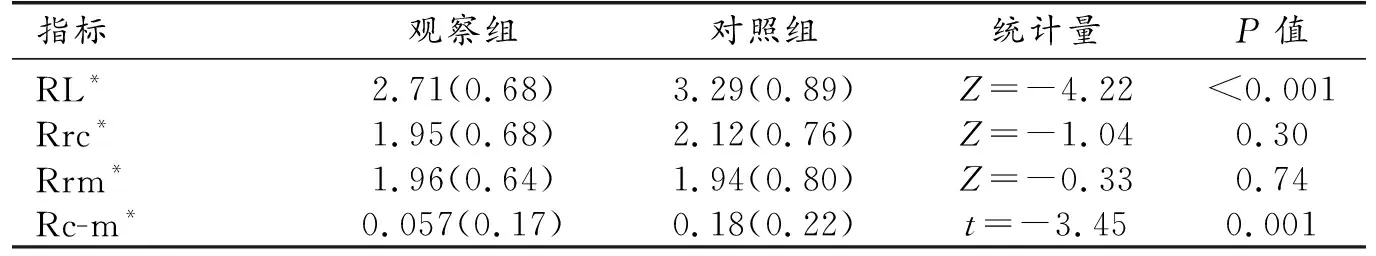
表2 两组间RL、Rrc、Rrm、Rc-m比较

图1 直肠癌肝转移(对照组)患者,男,59岁。圆圈表示模拟测量肝右后叶、肾皮质、肾髓质、竖脊肌的信号强度。肾皮质和肾髓质可以较清晰地区分,左肾较明显(箭),说明其肾皮髓质信号强度差异较大。 图2 胃癌肝转移(观察组)患者,男,55岁。与图1患者相比,该患者的肾皮、髓质分界不清(箭),说明其肾皮髓质信号强度差异较小。
ROC曲线分析结果显示,RL和Rc-m均可用于鉴别T2D(P<0.05)。RL和Rc-m的ROC曲线下面积(area under curve,AUC)分别为0.78(95% CI:0.67~0.88)和0.72(95% CI:0.61~0.84)最佳界值分别为2.89和0.14,诊断敏感度分别为77.10%和64.60%,特异度分别为70.60%和79.40%(表3、图3)。
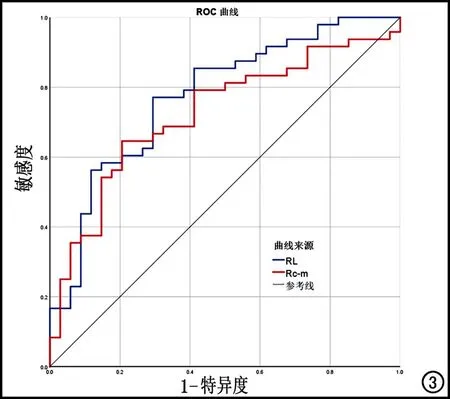
图3 RL和Rc-m鉴别T2D的ROC曲线。

表3 RL和Rc-m的ROC曲线分析结果
RL和Rc-m的观察者间一致性均较好,RL和Rc-m的ICC分别为0.91(95% CI:0.87~0.94)和0.89(95% CI:0.83~0.93)。
讨 论
T2D是我国患病率非常高的常见病之一,其对肝细胞OATPs的抑制作用以及对Gd-EOB-DTPA增强MRI肝肾图像的影响目前研究很少。而Gd-EOB-DTPA增强MRI对于肝脏肿瘤的诊断起着非常重要的作用。本研究证实了T2D患者Gd-EOB-DTPA增强MRI的肝脏和肾脏图像均发生了改变:在肝胆期,观察组肝脏相对SI (RL)、肾皮髓质SI的相对差异(Rc-m)均低于对照组。在一定前提下,以上两项指标可能有助于T2D的鉴别诊断。
Gd-EOB-DTPA增强MRI在国内外已广泛应用于肝脏检查。然而许多研究发现,某些疾病如慢性肝病、非酒精性脂肪性肝病、肝纤维化等会降低肝脏SI[11,12];一些食物或药物可以抑制肝细胞中OATPs的功能或表达,导致Gd-EOB-DTPA进入肝细胞的量减少[13,14]。Shuboni-Mulligan等[10]利用小鼠模型发现T2D也可以阻断OATPs的功能或表达,从而降低肝胆期的肝脏SI。在本研究中,排除了上述肝脏病变的干扰。为了避免肝脏占位性病变(如肝细胞癌、肝脏转移瘤)对研究结果的影响,所选研究对象的肝脏占位个数不超过5个,且患者肝功能指标正常;在选取ROI时,两位医师均尽量选择远离肝脏病变的正常肝实质。RL表示肝胆期肝脏的相对SI,观察组RL的降低表明肝细胞的OATPs受到T2D的抑制,进入肝细胞的Gd-EOB-DTPA减少(经肝脏途径排泄的Gd-EOB-DTPA减少),这与之前的T2D小鼠模型的结果相同。观察组RL的降低与Kumasaka等[15]的研究结果近似,但与他的研究相比,本研究观察组T2D的病情更轻(HbA1c ≤7.1%;无T2D严重并发症且绝大部分患者仅需口服药物治疗T2D),这说明较早期的T2D就可对OATPs造成影响。肝胆期肝脏背景信号强度的降低可能对肝细胞肝癌等疾病的诊断产生不利影响。
肾脏排泄途径占体内Gd-EOB-DTPA排泄量的50%左右,与肝脏途径相互代偿,一方的排泄量减少可导致另一方的排泄量代偿性增大[16]。本研究首次以半定量的方法探讨了T2D对肾脏肝胆期图像的影响。肾小球主要位于肾皮质,起到对Gd-EOB-DTPA的滤过作用;肾小管主要位于肾髓质,其对Gd-EOB-DTPA无重吸收作用。反映肾皮质、肾髓质相对SI的指标(Rrc、Rrm)两组间差异无统计学意义,可能是因为T2D患者肝脏途径排泄Gd-EOB-DPTA的量虽有减少,但程度较轻,而肾脏代偿性增加的排泄量有限,尚不足以导致Rrc、Rrm两组间的差异出现统计学意义;但T2D患者肝胆期肾皮髓质SI的相对差异(Rc-m)较对照组降低,提示肝胆期肾皮质与肾髓质SI的差值缩小,反映在图像上表现为观察组肾皮质、髓质的分界不清。说明在体现T2D改变肾脏影像方面,Rc-m较前述单独反映肾皮质或肾髓质的指标更敏感。本研究中T2D患者的肾功能正常,但其肝胆期肾脏图像发生改变,另一个原因可能是因为T2D可引起肾脏微结构的亚临床改变,而此时患者的肾功能指标(如肾小球滤过率、血肌酐、尿素氮、尿酸、尿β2微球蛋白等)尚正常[17,18]。有多项研究发现在T2D患者检测到蛋白尿之前或者尿微量白蛋白与肌酐比值正常时,肾皮质和肾髓质就会出现不同程度的水分子扩散受限及灌注过度,肾髓质可出现缺氧改变[19,20]。本研究中T2D患者Rc-m的降低或许反映了肾皮、髓质某种微结构或功能的亚临床改变。
ROC曲线分析结果显示,RL和Rc-m可能有助于T2D的鉴别诊断,前提是要排除前文提到的肝脏弥漫性病变等影响肝细胞摄取Gd-EOB-DTPA的情况。本研究中两位医师间RL和Rc-m的一致性较高,与国外研究结果相近[21]。Rc-m的ICC略低于RL,推测原因是Rc-m的计算需要测量肾皮质和肾髓质的ROI,这两个位置的ROI面积远小于肝脏ROI,ROI过小会造成较大的测量误差。
本研究存在以下局限性:①未排除原发恶性肿瘤对结果的潜在影响,但在测量肝肾ROI时避开了病灶,这可以尽量减少原发病的影响;②因样本量相对较少,且观察组T2D的病情程度近似(如HbA1c≤7.1%,大多数患者仅需口服药物治疗T2D,随机血糖<11.1 mmol/L),故观察组未根据糖尿病严重程度进行进一步分类。在未来的研究中,扩大样本量可以解决上述问题,也可以结合更先进的功能性磁共振检查技术,如定量磁敏感图技术、多模态磁共振成像技术、磁共振扩散峰度成像以及动脉自旋标记技术对T2D患者的肾脏早期改变进行进一步研究[22-25],并且可以结合T2D小鼠模型对肾脏Gd-EOB-DTPA增强MRI各期的影像改变进行深入研究。
综上所述,本研究证实了T2D可抑制肝细胞摄取Gd-EOB-DTPA,降低肝胆期肝脏相对信号强度,并影响肾皮质、肾髓质的信号强度。RL和Rc-m可以反映T2D患者肝脏、肾脏图像的改变,其可重复性较好,可能对T2D的鉴别诊断有一定帮助。
