联合CT影像组学与深度学习特征建立列线图预测食管鳞癌放疗近期疗效
2024-03-01朱正群巩萍黄栎有徐兰章龙珍
朱正群,巩萍,黄栎有,徐兰,章龙珍
世界卫生组织报告显示食管癌的全球发病率排名七位[1],我国食管癌患者中约90%为鳞状细胞癌[2]。大部分食管癌患者在确诊时已处于中晚期,难以接受手术治疗。对于不能手术的食管癌患者,放疗是主要治疗手段之一[3]。有研究表明患者接受放疗后的近期疗效存在明显差异[4],而近期疗效与食管癌患者预后关系密切[5]。因此,准确预测患者放疗近期疗效,能够帮助临床为患者制定个性化的治疗方案,对提高食管癌患者的治疗效果,延长生存时间意义重大。
CT作为一种无创性影像学检查,被临床广泛应用于食管癌检查中,但传统CT无法对食管癌患者放疗近期疗效进行准确预测。影像组学通过提取并分析图像的高通量特征,能够反映肿瘤整体的异质性,已有研究发现影像组学能够较好地预测食管鳞癌放疗近期疗效[6]。深度学习技术通过自主提取特征在多种疾病中表现出了优异的诊断性能[7-8]。本研究通过提取并分析CT影像组学特征和深度学习特征建立联合预测模型,旨在探讨其对食管鳞癌患者放疗近期疗效的预测价值。
材料与方法
1.病例资料
回顾性分析2018年1月-2021年1月徐州医科大学附属医院137例接受放疗的食管鳞癌患者的CT影像和临床病理资料。病例纳入标准:①内镜活检病理结果为食管鳞癌;②患者接受根治性放疗;③治疗前行CT扫描及食管钡餐检查。病例排除标准:①合并有远处转移和患有其他恶性肿瘤;②缺少临床和复查影像资料;③CT图像质量不能满足影像组学分析。
患者放疗结束后3个月行胸部CT和食管钡餐检查,与治疗前的影像资料进行比较。根据实体瘤疗效评价标准(response evaluation criteria in solid tumours,RECIST)1.1版将治疗效果分为完全缓解(complete response,CR)、部分缓解(partial response, PR)、病变稳定(stable disease,SD)和病变进展(progressive disease,PD),其中PR与CR患者被定为治疗有效组,SD与PD患者被定为治疗无效组。
2.检查方法
CT检查采用飞利浦BigBore大孔径CT,扫描参数:管电压120 kV,管电流120 mA,螺距0.2,扫描层厚5 mm,矩阵512×512,重建层厚5 mm。增强扫描通过高压注射器注射对比剂碘克沙醇,剂量1.5~2.0 mL/kg,流率3.0 mL/s,注射对比剂25 s后进行扫描,获得动脉期图像。
3.图像分割和特征提取
以DICOM格式下载患者动脉期CT图像,由1位有5年CT诊断经验的医师在勾画软件中对食管癌肿瘤区域进行独立人工感兴趣区(region of interest,ROI)勾画,勾画时避开食管空腔和其他组织结构(图1)。通过MRIcroGL图像处理软件对CT图像与ROI进行重采样,对CT图像三维方向的像素变化进行校正。重采样后的CT图像与ROI层厚设置为1 mm×1 mm×1 mm,保持像素在3维方向的各向同性。基于Pyradiomics 1.2.0软件包利用一阶统计量、灰度共生矩阵、灰度游程矩阵、小波变换等方法从每例患者CT图像中提取影像组学特征395个。
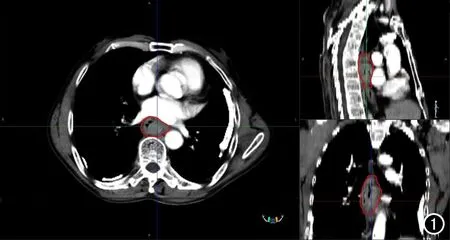
图1 胸中段食管癌患者,男,75岁。手动勾画ROI三方向观,红色区域为ROI。
通过pytorch1.04框架建立ResNet18深度学习网络,通过迁移学习技术将由128万张图像训练得到的ImagNet数据集预训练模型参数迁移到ResNet18深度学习网络中。在预训练模型参数基础上通过训练集数据对模型参数进行微调并冻结深度学习网络的参数权重,使模型各层的参数不再进行更新。由于Res-Net18采用的是二维卷积核,只能对二维图像进行深度特征提取。因此,研究选取每例患者肿瘤直径最大的层面ROI作为深度特征提取图像,将图像调整成224×224×3像素输入到网络中对图像进行多次卷积。输入图像经过17层卷积层后得到7×7×512维张量,对提取到的张量进行自适应平均池化处理,最终得到512个深度特征。
为了保证提取特征的一致性,研究随机选取20例患者,由另一位有7年CT诊断经验的医师进行2次独立勾画ROI并通过相同方法进行影像组学特征和深度学习特征的提取。采用组内相关系数(intraclass correlation coefficient,ICC)比较2位医生提取特征的一致性,选取ICC>0.75的特征进行后续分析。
4.模型建立
所有患者依照7:3的比例被随机划分为训练集和验证集。通过最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)方法对训练集中的影像组学特征和深度学习特征分别进行降维筛选。被筛选出的影像组学特征和深度学习特征依照各自特征回归系数进行线性加权,最终分别计算得到影像组学得分(Radscore)和深度学习得分(Deepscore)。分别纳入临床指标(年龄、性别、T分期、N分期、TNM分期、放疗剂量、是否化疗)、影像组学得分和深度学习得分三方面参数,根据纳入参数不同分别建立临床模型(临床参数)、影像组学模型(临床参数+影像组学得分)以及联合模型(临床参数+影像组学得分+深度学习得分)。通过单因素与多因素分析得到影响食管癌放疗近期疗效的独立预测因子。基于多因素逻辑回归建立预测模型,应用似然比统计量,利用赤池信息量准则(akaike information criterion,AIC)为停止规则,在AIC最小时停止后向逐步选择。利用列线图对逻辑规模模型进行可视化,并通过校准曲线评价模型的校准度。利用Hosmer-Lemeshow检验评价预测模型的拟合度。分别绘制3种预测模型的受试者工作特征(receiver operating characteristic curve,ROC)曲线,并计算其曲线下面积(area under curve,AUC)。采用Delong法比较临床模型、影像组学模型以及联合预测模型间的AUC差异。在此基础上,采用决策曲线分析(decision curve analysis,DCA)对模型的临床净获益进行量化,比较3种模型在不同阈值概率下的临床应用价值。
5.统计学分析
采用R语言(Version3.5.1)进行统计学分析。对连续变量行正态性检验,符合正态分布的连续变量以均值±标准差表示,采用独立样本t检验进行组间比较;不符合正态分布的连续变量以中位数(上、下四分位数)表示,采用Mann-WhitneyU检验进行组间比较。分类变量采用皮尔逊χ2检验进行组间比较。采用glmnet进行Lasso回归分析,rms包进行列线图绘制,pROC包进行ROC曲线绘制,ResourceSelection包进行拟合度检验,rmda包进行DCA分析。以P<0.05为差异有统计学意义。
结 果
1.临床资料分析结果
本研究共纳入137患者,其中有效组患者65例,无效组患者72例。统计学分析结果显示,有效组中T4期患者所占比例明显低于无效组(P=0.021),接受化疗患者所占比例明显高于无效组(P=0.017,表1)。训练集与验证集两组患者的临床指标之间差异均无统计学意义(P均>0.05)。
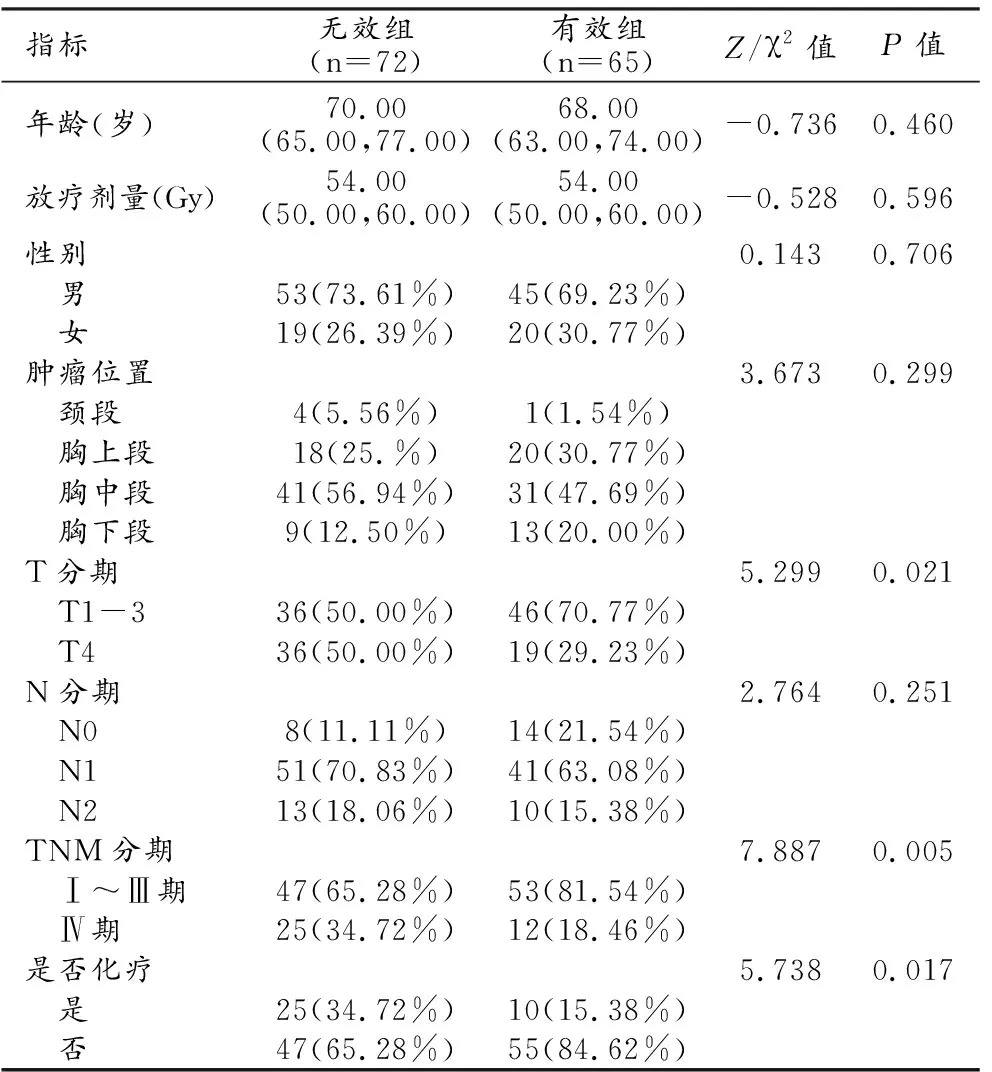
表1 有效组与无效组患者的临床指标比较 (n,%)
2.特征筛选结果
在特征选择过程中,共纳入306个ICC>0.75的影像组学特征。通过LASSO回归分析,经过5折交叉验证后,当λ值为0.1011002时得到6个系数非零最佳影像组学特征(图2)。对6个特征进行回归系数加权后得到影像组学得分为Radscore=-0.08396648+original_glcm_ClusterProminence×0.18517479-wavelet_HHH_glcm_Correlation×0.08976676+log_sigma_1mm_3D_glcm_ClusterShade×0.07762019+log_sigma_2mm_3D_glcm_ClusterShade×0.05812535-log_sigma_5mm_3D_glcm_Cluster-Shade×0.07351695-log_sigma_5mm_3D_glcm_InverseVariance×0.01466633。训练集中有效组的Radscore[0.03(-0.12,0.21)]明显高于无效组[-0.24(-0.36,-0.06)],差异有统计学意义(Z=-4.572,P<0.001)。验证集中有效组的Radscore[-0.03(-0.15,0.15)]明显高于无效组[-0.19(-0.30,-0.08)],差异亦有统计学意义(Z=-3.216,P<0.001)。

图2 LASSO回归参数图。a)5折交叉验证得到参数λ值,左右两条虚线分别为LASSO均方误差最小值对应的λ值和最小误差1倍标准差对应的λ值;b)影像组学特征的LASSO系数曲线,在均方误差最小值1倍标准差处绘制虚线得到6个影像组学特征。 图3 LASSO回归参数图。a)5折交叉验证得到参数λ值,左右两条虚线分别为LASSO均方误差最小值对应的λ值和最小误差1倍标准差对应的λ值;b)深度学习特征的LASSO系数曲线,在均方误差最小值1倍标准差处绘制虚线得到6个深度学习特征。
深度学习特征依据f1到f512依次命名,纳入413个ICC>0.75的深度学习特征。经过LASSO回归分析,当λ值为0.1371363时得到6个系数非零最佳深度学习特征(图3)。对6个特征进行回归系数加权后得到深度学习得分为Deepscore=-0.08449667-0.01013450×f61-0.08460169×f324-0.00107008×f348+0.16836871×f369-0.04141898×f404-0.08245554×f409 。训练集中有效组的Deepscore[0.08(-0.13,0.24)]显著高于无效组[-0.25(-0.39,-0.14)],差异有统计学意义(Z=-5.071,P<0.001)。验证集中有效组的Deepscore[0.02(-0.15,0.16)]显著高于无效组[-0.22(-0.42,-0.07)],差异亦有统计学意义(Z=-3.041,P=0.003)。
3.预测模型建立
对患者临床资料、Radscore、Deepscore分别行单因素分析,结果显示TNM分期(Ⅳ期)、是否化疗(是)、Radscore及Deepscore有统计学意义(P<0.05,表2)。
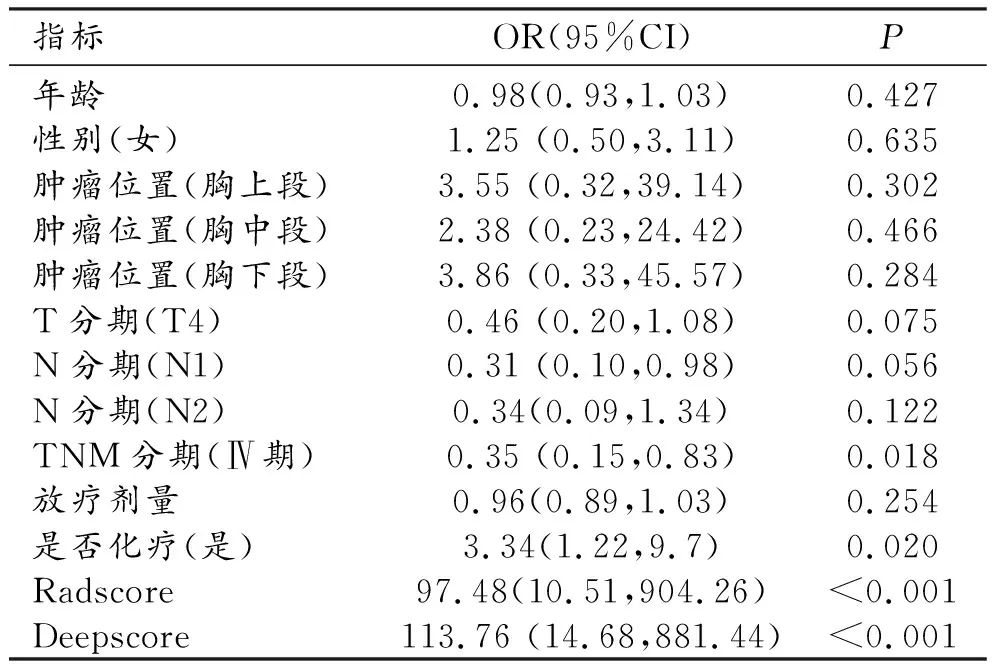
表2 单因素分析结果
基于单因素分析结果,分别对临床模型、影像组学模型及联合模型进一步行多因素分析,结果显示TNM分期(Ⅳ期)、是否化疗(是)为临床模型的独立预测因子,TNM分期(Ⅳ期)、Radscore是影像组学模型的独立预测因子,TNM分期(Ⅳ期)、Radscore及Deepscore是联合模型的独立预测因子(表3)。基于上述独立预测因素,利用赤池信息量准则为停止规则,对筛选出的变量进行后向逐步选择,分别建立 3 种 logistic 回归模型。

表3 3种模型多因素分析结果
4.模型比较
临床模型、影像组学模型以及联合模型在训练集与验证集中的诊断效能见表4。联合模型在训练集中预测食管鳞癌患者放疗近期疗效的AUC值为0.904,显著高于影像组学模型(AUC=0.814,Z=-2.851,P=0.004)以及临床模型(AUC=0.662,Z=-4.865,P<0.001,图4a)。联合模型在验证集中预测食管鳞癌患者放疗近期疗效的AUC值为0.938,显著高于临床模型(AUC=0.644),差异有统计学意义(Z=-3.36,P<0.001);高于影像组学模型(AUC=0.852),但差异无统计学意义(Z=-1.692,P=0.091,图4b)。

表4 3种模型在训练集与验证集中的诊断效能
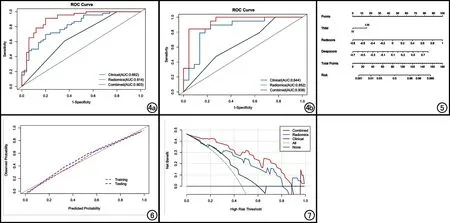
图4 临床模型、影像组学模型以及联合模型预测食管鳞癌患者放疗近期疗效的ROC曲线。a)训练集;b)验证集。 图5 联合预测模型列线图。 由TNM、Radscore和Deepscore得分相加为总得分,根据总得分取值可获得食管癌患者放疗近期有效的概率。 图6 列线图校准曲线。 图7 3种模型在验证集上的决策曲线。All假设所有患者均接受放疗,None假设所有患者均不接受放疗。
对表现最好的联合模型绘制列线图(图5)。联合预测列线图在训练集和验证集中的校正曲线见图6,列线图在训练集和验证集中的预测结果和观察结果均显示出良好的一致性。Hosmer-Lemeshow 检验结果显示联合预测列线图在训练集和验证集中拟合优度检验结果差异均无统计学意义(X=8.628、5.836,P=0.375、0.666),表明列线图预测结果没有偏离完美拟合。决策曲线分析结果显示在0.1~0.9和0.97~0.99的阈值范围内使用联合预测列线图获得的临床受益要高于临床模型和影像组学模型(图7)。
讨 论
随着食管癌患者人数的逐年递增,临床迫切需要一种便捷、可靠的诊断方法来预测食管癌放疗的近期疗效。本研究基于临床指标、影像组学特征及深度学习特征开发并建立了联合模型,用于食管鳞癌放疗近期疗效的预测。联合模型中包含TNM分期、Radscore和Deepscore等3个指标,结果显示联合模型在训练集与验证集中的AUC分别达到0.904和0.938,表明联合模型能够准确预测食管鳞癌患者放疗的近期疗效,有助于食管鳞癌患者个体化治疗方案的制定。
目前,已有研究通过影像组学对食管癌放化疗疗效进行预测[9-11]。Luo等[9]从CT图像中基于7个影像组学特征建立Radscore,并发现TNM分期和Radscore是预测食管癌放化疗疗效的独立预测因子。本研究筛选出6个影像组学特征计算得到Radscore,并发现TNM分期(Ⅳ期)和Radscore是影像组学模型的独立预测因子,结果与既往研究相似。TNM分期是临床医生判断食管癌患者预后的一项重要指标。TNM Ⅳ期表示病变浸润到外膜以外的组织,有淋巴结转移,且存在远处器官转移,意味着患者已处于食管癌晚期,其治疗效果往往较差。相关研究显示对Radscore有贡献的6个影像组学特征均属于灰度共生矩阵,该类特征能够反映肿瘤整体的异质性[12-13],研究结果提示2组患者在肿瘤异质性上存在差异。造成异质性差异的因素可能与肿瘤内血流灌注情况、血管分布情况、细胞增殖和坏死等因素有关[14-15]。
既往研究大多单纯利用影像组学对食管癌患者近期疗效进行预测,但影像组学特征均由人为定义,其能够反映的图像细节较为有限。这导致影像组学模型的预测准确度难以满足临床需要。深度学习通过数据进行自主学习摆脱了人工定义的限制,并在医学图像分析领域取得巨大成功[16-17]。已有研究证实深度学习特征能够提高影像组学模型的精确度[18-19]。目前,尚未有研究利用深度学习特征对食管鳞癌放疗近期疗效进行预测。因此,本研究通过ResNet18深度学习网络进行深度特征提取,利用LASSO回归筛选出6个最佳深度特征计算得到Deepscore。结果显示训练集和验证集中有效组的Deepscore均显著高于无效组。多因素分析结果显示Deepscore是食管鳞癌患者放疗近期疗效的独立预测因子。上述结果表明深度特征能够对食管鳞癌放疗近期疗效进行预测。本研究联合Deepscore、TNM分期与Radscore建立联合模型,结果显示联合模型在训练集中预测食管鳞癌患者放疗近期疗效的AUC为0.904,显著高于影像组学模型(AUC=0.814)。验证集中联合模型的AUC为0.938,高于影像组学模型(0.852),但AUC差异无统计学意义(P>0.05),这可能与验证集样本量较小有关。DCA曲线分析结果显示联合模型在验证集中的AUC要大于临床模型和影像组学模型,在0.1~0.9和0.97~0.99的阈值范围内联合模型具有更好的临床实用性,表明深度学习特征能够进一步提高预测模型的诊断效能和临床实用性。
本研究存在以下局限性:①本研究仅纳入单中心数据,研究结果需要外部数据验证;②本研究的数据量较小,扩大数据量能够进一步提升模型性能;③本研究中ROI为医生手动勾画,特征提取的稳定性受人为因素制约。
综上所述,基于CT影像组学和深度学习特征开发的联合预测列线图能够准确地预测食管癌放疗近期疗效,可以为临床提供一种快捷、无创且有效的预测手段。
