肝细胞癌铜死亡标志物SLC31A1、DBT的鉴定及化合物筛选
2024-02-26张楠楠周伊帆朱燚安明宇邓颖李军
张楠楠 周伊帆 朱燚 安明宇 邓颖 李军
摘要:探究銅死亡相关基因对肝细胞癌(hepatocellular carcinoma, HCC)的影响,并挖掘治疗HCC的活性成分。通过GEO数据库下载GSE84402数据集,获取肝癌差异表达基因,通过文献检索铜死亡相关基因,两者取交集获得肝癌相关铜死亡基因。进一步分析交集基因,使用UALCAN分析其差异表达,R语言分析其表达水平与临床的相关性,Kaplan-Meier Plortter分析其预后价值,HCMDB分析其与肝癌转移的关系,并使用THPA分析其与肝癌的病理关系。最后进行化合物预测与分子对接。结果表明,与正常组相比,铜死亡关键基因SLC31A1、DBT在肿瘤中表达水平下调,病理分析显示其蛋白在HCC组织中表达增加,且与临床相关性变量性别、肿瘤分期、淋巴结转移显著相关,其高表达与肝癌预后良好相关,其中SLC31A1低表达与肝癌向肾上腺、肺部转移显著相关。最后筛选出可能与SLC31A1、DBT结合的活性化合物,其中白藜芦醇、叶酸对接分数高。研究认为铜死亡相关基因SLC31A1、DBT在HCC的发生发展中起重要作用,为HCC的诊断及治疗药物研究提供了新思路。
关键词:肝细胞癌;铜死亡;SLC31A1;DBT
中图分类号:R965.1 文献标志码:A 文章编号:1002-4026(2024)01-0039-12
Identification and compound screening of copper-induced cell death-related genes SLC31A1 and ‘DBT in hepatocellular carcinoma
Abstract∶This study aimed to investigate the effect of copper-induced cell death-related genes on hepatocellular carcinoma (HCC) and to explore active components for treating HCC. The GSE84402 dataset was downloaded from the Gene Expression Omnibus (GEO) database to obtain the differentially expressed genes associated with HCC, and copper-induced cell death-related genes were retrieved from past literature; the commonalities between the two were considered to obtain HCC-related copper-induced cell death genes. The genes in common were further analyzed for differential expression using the UALCAN (University of Alabama at Birmingham Cancer Data Analysis) portal, the correlation between their expression levels and clinical levels was analyzed using the R language, prognostic value was determined using the Kaplan-Meier plotter, their relationship with HCC metastasis was examined using the Human Cancer Metastasis Database (HCMDB), and their pathological relationship with HCC was explored using the ‘Treponema pallidum hemagglutination test. Lastly, compound prediction and molecular docking were performed. The results showed that compared with the normal group, expression levels of the key copper-induced cell death genes SLC31A1 and ‘DBT were downregulated in tumors, and pathological analysis showed that their proteins were increased in HCC tissues. In addition, these genes were significantly correlated with the clinical correlation variables of sex, tumor stage, and lymph node metastasis. Their high expression was correlated with a good HCC prognosis, whereas low expression of SLC31A1 was significantly correlated with the metastasis of HCC to the adrenal glands and lungs. Finally, the active compounds that may bind to ‘SLC31A1 ‘and ‘DBT ‘were screened, of which resveratrol and folic acid exhibited high docking scores. Hence, it could be concluded that copper-induced cell death-related genes SLC31A1 and ‘DBT play an important role in the development of HCC, and this study provides new theories for the diagnosis of HCC and therapeutic drug research.
Key words∶hepatocellular carcinoma; cuproptosis;SLC31A1; ‘DBT
肝细胞癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤之一,我国新发HCC病例约占全球50%以上[1]。目前,HCC以其18% 的5年生存率成为仅次于胰腺癌的第二大致死癌症[2]。HCC具有异质性强、易转移复发、预后差等特点,早发现早诊断早治疗、抗转移复发、精准施治是改善患者生存率的关键。
铜死亡是一种新型的细胞死亡方式,由蛋白质脂酰化介导且与线粒体代谢高度相关[3]。铜通过单独或与配体结合促进血管生成,而铜螯合则抑制这一过程,这是肿瘤进展和转移必不可少的因素[4-6]。铜直接与三羧酸循环(TCA)的脂酰化成分结合,导致毒性蛋白质应激,最终导致细胞死亡[7]。细胞死亡是肿瘤研究的热点领域,是癌症起源和发展的基础。
本研究通过联合癌症基因组图谱(the cancer genome atlas,TCGA)数据库中的转录组数据和基因表达综合数据库(gene expression omnibus,GEO)中HCC的基因芯片数据,筛选HCC组织与周围正常组之间的差异表达基因(differentially expressed genes,DEGs),对关键基因的差异表达、临床相关性、生存分析及肿瘤转移分析以及免疫组化等进行综合验证,从而对HCC的治疗及预后寻找潜在靶标,并进一步发掘治疗HCC的化合物活性成分并进行分子对接。本研究旨在为HCC的发病机制研究和治疗提供新思路和方法,为抗癌新药及其靶点的研发提供理论依据。
1 材料与方法
1.1 数据来源
从文献中收集获得铜死亡基因。通过下载GEO数据库(htpp: //www.ncbi.nlm.nih.gov/geo/)和TCGA数据库(https://portal.gdc.cancer.gov/)中来自于分析平台GPL570,样本数为28个的基因表达谱芯片GSE84402数据和HCC的转录组数据及其相应患者的临床信息[8-9]。使用UCSC Xena 网站(https://xena.ucsc.edu/)下载TCGA数据库其余的32种肿瘤转录组数据,进行基因差异表达分析、临床相关性分析、肿瘤转移分析及生存分析。
1.2 分析差异基因
使用R语言(3.6.3版本)limma包中的izeBetweenArrays函数,对从GEO数据库中下载的GSE84402数据集进行数据均一化处理,绘制箱式图。以p<0.05, fold change (|log2 ‘FC|) >1作为筛选条件。利用limma包对正常组和癌症组进行差异分析,所获得的DEGs使用ggplot2包和ComplexHeatmap包分别绘制火山图和聚类热图。运用Venny 2.1.0在线工具(http://bioinformatics.psb.ugent.be/webtools/venn/),获得并保留与铜死亡相关的交集基因,并将其定为关键基因做进一步分析。
1.3 关键基因差异表达分析
以TCGA数据库为来源,使用UALCAN在线工具(http://ualcan.path.uab.edu/)分析关键基因表达量在HCC组织与非癌组织中的差異并探究其临床研究意义[10]。筛选条件:(1)TCGA分析 ;(2)检索基因DBT、SLC31A1 ;(3)TCGA数据集HCC;(4)分析索引为表达分析;(5)统计学意义p<0.05。
1.4 ROC(receiver operating characteristic)分析
以TCGA数据库为来源,通过R语言(3.6.3版本)中pROC包进行数据分析,ggplot2包绘图,ROC曲线下的面积值在0.5~1.0之间,在模型评估指标area under the curve(SAUC)>0.5的情况下,SAUC值越接近1,说明诊断效果越好,通过ROC曲线分析以评估SLC31A1、DBT在HCC诊断上的可行性。
1.5 关键基因与临床相关性分析
在TCGA数据库中下载格式为HTSeq-FPKM的HCC(肝细胞HCC)RNAseq数据和患者的临床信息数据,将其转化为TPM格式进行以2为底的对数转化后,使用R语言(3.6.3版本)中ggplot2包对关键基因在HCC中的表达量进行临床相关性可视化和统计分析。p<0.05则结果具有统计学意义。
1.6 生存分析
使用Kaplan-Meier Plortter在线工具(https://kmplot.com/)进行Kaplan-Meier曲线和log rank检验分析,探索其表达量与HCC患者生存时间的关系[8]。p<0.05,风险率RH>0.05表示结果具有统计学意义。
1.7 肿瘤转移分析
使用HCMDB数据库(http://hcmdb.i-sanger.com/)对关键基因在HCC转移中的沉积量进行分析,探索关键基因沉积量在肿瘤转移中的变化[11]。p<0.05表示结果具有统计学意义。
1.8 免疫组织化学分析
通过THPA数据库(https://www.proteinatlas.org/)获取含有关键基因的正常组织与病理组织图谱,分析对比正常组织与癌症组织的差异[12]。
1.9 活性化合物筛选
通过内置于 CTD 数据库 (http://ctdbase.org/)的 PTS 网络服务器,分析与靶基因相互作用的分子结构,并进一步检索与关键基因相互作用的活性化合物[9]。
1.10 分子对接
根据CTD数据库获得关键基因的活性化合物成分,通过PDB数据库(https://www.pdbus.org/)查找获得人源蛋白的3D结构,联合TCMSP数据库(https://old.tcmsp-e.com/tcmsp.ph)和PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/) 获取关键基因相对应活性化合物的分子3D结构[13],将蛋白及化合物的结构导入BIOVIA Discovery Studio (DS) 2016软件进行分子对接,检验蛋白与活性成分的亲和性。
1.11 细胞培养
人肝癌细胞(HepG2,购自中国科学院上海细胞库,编号SCSP-510),在含有10% FBS和1%青霉素-链霉素混合物的低糖DMEM培养液(gibico,批号8123299)中培养,37 ℃、5% CO2培养箱中培养,待细胞融合至80%~90%时,分别以0、50、100、200 μmol/L的叶酸(MedChemExpress,货号HY-6637)处理细胞24 h后,每孔加入60 μL含PMSF和磷酸酶抑制剂的RIPA裂解液(Solarbio,货号R000)提取细胞中的蛋白。
1.12 蛋白免疫印迹
提取HepG2细胞中的蛋白进行蛋白免疫印迹(western blot,WB)分析。使用 BCA蛋白检测试剂盒(Solarbio, 货号PC0020,规格500微孔)定量后,用SDS-PAGE 凝胶(Solarbio,货号P1200-1/P1200-2)分离出等量的蛋白质,转移至PVDF 膜上,5%脱脂牛奶阻断膜2 h,DBT抗体(Bioswamp,#PAB48456)和Anti-beta Actin Rabbit mAb(PTM BIO,#PTM-5436)孵育过夜,再用山羊抗兔IgG(H&L)-HRP(Bioworld,#bs13278)孵育2 h,而后使用ECL试剂盒(Millipore,批号2201215)进行显影,最后通过Image Lab软件分析WB条带的灰度值,将目标蛋白与β-actin的灰度值比对进行蛋白的定性及半定量分析。
1.13 统计分析
数据来自3次重复实验,数据分析和图片制作通过 SPSS 25.0 和 GraphPad Prism 9.0 软件进行。数据以x[TX-*4]±s表示,多组间比较当满足正态及方差齐性时,采用单因素方差分析,两两比较采用LSD;两组间比较当满足正态时,采用独立样本t检验分析;以p<0.05为差异有统计学意义。
2 结果
2.1 HCC相关铜死亡差异基因筛选
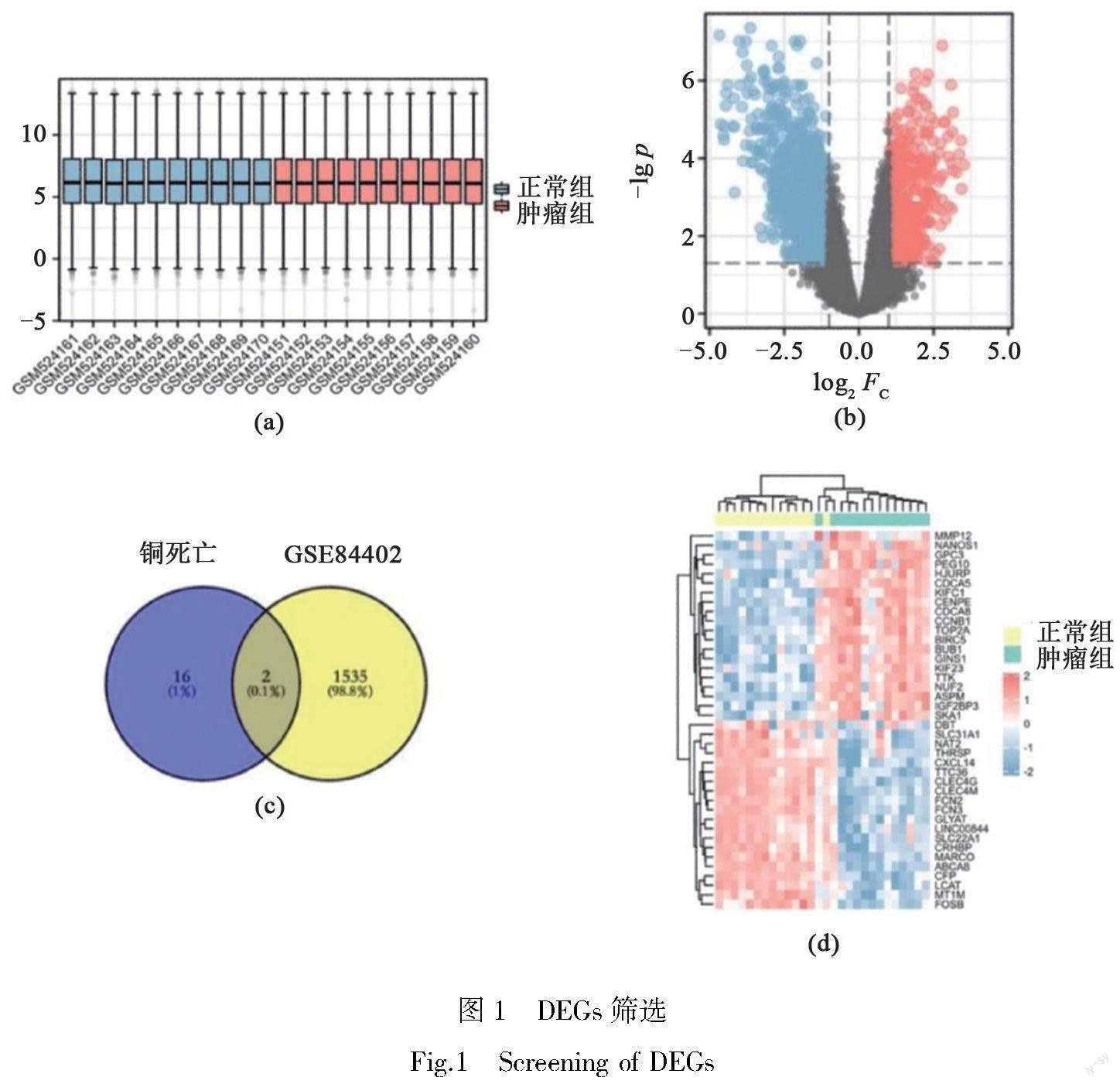
通过limma包的数据处理分析结果显示,26个样本数据的中位数基本处于一条直线上,表明数据集质量可靠、样本归一化程度好,如图1(a)所示,可对HCC组和相应的非癌组中的DEGs进行下一步分析。将GSE84402芯片中的14例HCC组设为实验组,14例非癌组织设为对照组,对其数据进行分析。以阈值为|log2 ‘FC|>1和p<0.05作为初步筛选条件,通过火山图可直观地观察到总体差异基因的分布情况,其中红色小点代表上调基因,蓝色小点代表下调基因(图1(b));再对其进行聚类分析(图1(d));图中蓝色小块代表下调基因,红色小块代表上调基因,方块颜色越深表示差异表达的倍数越高。运用Venny 2.1.0在线工具(http://bioinformatics.psb.ugent.be/webtools/venn/),獲得2个交集基因(图1(c)),分别为SLC31A1、DBT。
2.2 关键基因差异表达分析
使用UALCAN在线工具以交集基因SLC31A1和DBT为关键基因,进行差异表达分析。其结果见图2,与正常组相比,关键基因SLC31A1和DBT在HCC肿瘤中均显著下调。
2.3 ROC分析
使用TCGA数据库,用R语言中的pROC包进行ROC分析,ROC曲线下的面积值在0.5~1.0之间,在SAUC>0.5的情况下,SAUC越接近于1,说明诊断效果越好。SAUC在 0.5~0.7时有较低准确性,SAUC在0.7~0.9时有一定准确性,SAUC在0.9以上时有较高准确性。SAUC=0.5时,说明诊断方法无诊断价值。根据图3可知,SLC31A1对应的SAUC=0.685,DBT对应的SAUC=0.694,SAUC值均高于0.5,说明SLC31A1、DBT对HCC的诊断价值有准确性。
2.4 临床相关性分析
使用TCGA数据库探索SLC31A1、DBT在HCC患者不同亚型中的表达与性别、淋巴结转移状态和癌症分期间的关联,性别分析如图4(a)所示,与正常组相比,SLC31A1和DBT在男性和女性患者肿瘤中表达均显著下调;N分期是肿瘤-结节-转移(TNM)分期系统中的重点分期,N分期系统有5个阶段,包括NX、N0、N1、N2和N3。N的后缀代表淋巴结转移的程度。NX表示不能评估区域淋巴结;N0表示没有区域淋巴结转移,N1~N3表示区域淋巴结受累程度逐渐递增。淋巴节转移分析如图4(b)所示,SLC31A1和DBT与正常组相比,N0组显著降低(p<0.001),N1组显著降低不明显,表明SLC31A1、DBT和局部淋巴结受累关系均不明显。肿瘤分期分析如图4(c)所示,与正常组相比,SLC31A1和DBT在I、II、III期患者肿瘤中的表达均显著下调。
2.5 预后分析
将2个关键基因在TCGA数据库中进行5年生存预后分析,红色线条代表基因高表达的生存情况,黑色线条代表低表达的生存情况,纵坐标根据基因表达的高低,分为高、低表达组,数值代表随时间变化存活的患者例数,为风险数字表,横坐标代表生存时间,OS表示总生存期,PFS表示无进展生存期,其结果如图5所示,关键基因p值均小于 0.05,RH>0.05表示统计值具有意义,SLC31A1、DBT高表达说明HCC预后良好。
2.6 肿瘤转移分析
通过HCMDB数据库分析在HCC肿瘤转移中关键基因SLC31A1、DBT沉积量的表达,观察到SLC31A1的沉积量在肾上腺和肺部的转移中表达量均具有统计意义,见图6(a),但DBT转录物在肾上腺、肺部、淋巴结转移中统计差异不显著,见图6(b)。
2.7 病理分析
通过The human protein atlas project数据库比较人类正常组织和癌症组织之间不同蛋白质的表达,结果如图7所示,结果表明SLC31A1在肝癌组织中的表达低于正常肝组织。但DBT未在正常肝组织中探测到,在肝癌组织中表达量低。
2.8 分子对接和活性化合物筛选
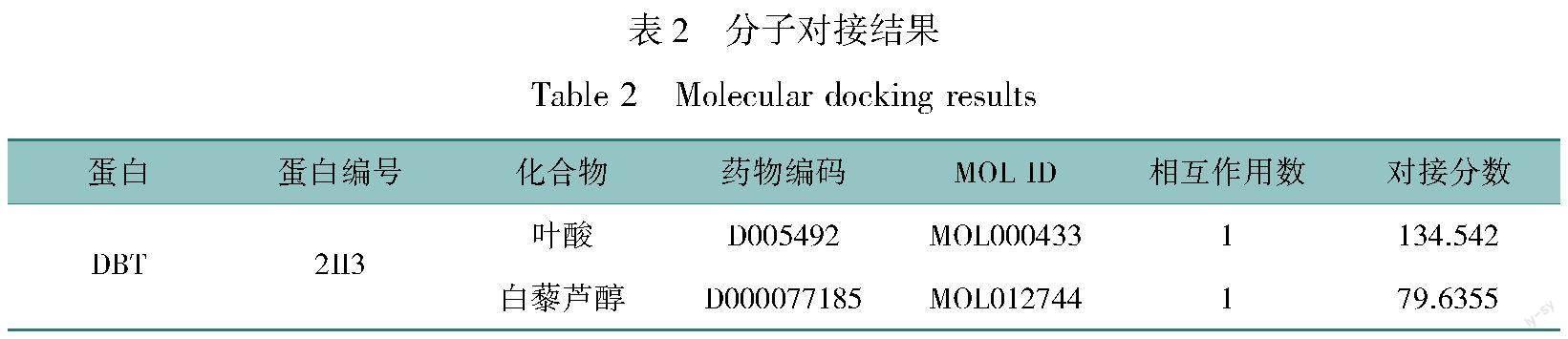
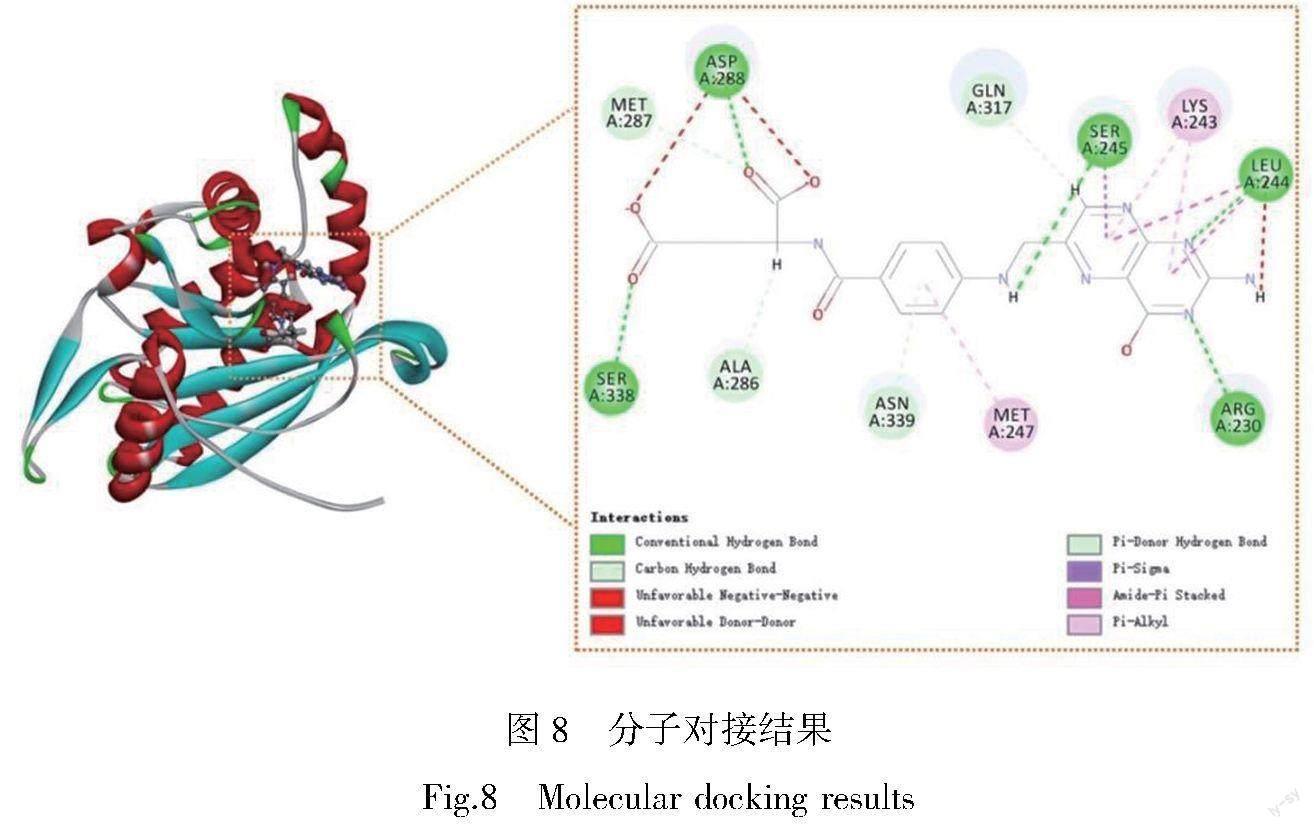
根据CTD数据库获得SLC31A1、DBT相对应的活性化合物成分,所获化合物主要成分见表1,全表见OSID科学数据与内容附表1。联合TCMSP数据库和PubChem数据库筛选并获得SLC31A1、DBT相对应化合物的2D结构,并从PDB数据库中下载上述关键基因编码的蛋白结构,再使用BIOVIA Discovery Studio (DS) 2016进行分子对接,SLC31A1与所筛选药物无法对接,DBT与叶酸和白藜芦醇均能对接,结果见表2,其中对接效果最好的小分子化合物为叶酸(对接分数134.542,图8)。
2.9 Western Blot
采用 WB 检测蛋白表达情况,实验结果如图9所示。与未给药干预组相比,HepG2细胞在50和100 μmol/L叶酸的干预下,DBT蛋白表达无明显变化,但在200 μmol/L叶酸干预下,DBT蛋白表达升高(p<0.005)。
3 讨论
据国际癌症研究机构估计,2018年HCC患者超过841 080例[1]。患者的患病率与发病率密切相关,这反映其具有典型的晚期表现、有限的治疗选择、侵袭性和极差的总体生存率[14]。癌症治疗成本较高,治疗费用可能随着越来越多的病人接受肝移植而上升[14-15]。因此,探索诊断HCC的肿瘤标志物与治疗HCC的药物靶标关重要。
铜死亡取决于细胞中铜的积累,是一种独特的细胞死亡途径。研究表明[4-6],与正常组相比,许多恶性肿瘤中的铜含量更高,尤其在乳腺癌、肺癌、胃癌等不同癌症患者的血清和肿瘤中,都发现了铜水平的高表达。同时,铜的积累与增殖和生长、血管生成和转移有关[16]。铜离子载体(如Elesclomol)是铜离子的小分子转运蛋白,可以探索铜离子细胞毒性机制。铜水平的稳定在各生理过程中至关重要,细胞内铜的生物利用度失调可诱发氧化应激和细胞毒性[17]。因为肿瘤的生长和转移对这种金属营养的要求更高。除此之外,铜除了作为活动性位点代谢辅助因子外,也是一种动态信号金属和金属变异体调节因子[18],其在脂肪分解中依赖铜的磷酸二酯酶3B(PDE3B),在细胞生长和增殖中依赖丝裂原激活蛋白激酶激酶1(MEK1)和MEK2以及在自噬中依赖激酶ULK1和ULK2。
本研究首先通过 GEO 数据库获得HCC及周围正常组基因芯片数据集 GSE84402,对非癌组织和HCC组织进行 DEGs 分析。将DEGs与已知的铜死亡基因取交集,获得两个重叠基因SLC31A1、DBT,并将其锁定为进一步研究的关键基因。为了进一步明确SLC31A1、DBT在HCC中的临床意义,本研究对SLC31A1、DBT在HCC中的差异表达水平与临床分期、ROC、预后、肿瘤转移、免疫组化的相关性进行分析,并进一步挖掘SLC31A1、DBT相对应的活性化合物。UALCAN数据库分析结果表明,SLC31A1和DBT基因在HCC中显著低表达,这提示SLC31A1、DBT的低表达可能促进HCC的发展进程。ROC分析结果表明, SLC31A1和DBT对HCC的诊断具有一定的准确性。为了进一步验证SLC31A1和DBT与HCC的相关性,进行了临床相关性分析,性别和癌症分期分析结果表明, SLC31A1和DBT的表达下调可能是HCC发生进展的重要影响因素;淋巴结转移分析表明,SLC31A1和DBT与淋巴结转移相关性不显著。Kaplan-Meier Plortter数据库mRNA RNA-seq预后分析结果显示,SLC31A1和DBT的扩增状态影响HCC的预后状态。HCMDB数据库分析结果表明,SLC31A1转录物在肝肿瘤转移至肾上腺、肺脏中存在差异表达,但DBT在肝肿瘤至肾上腺、肺部、淋巴结转移中表达量无显著差异,这提示在肿瘤转移过程中SLC31A1的差异表达有作为预测因子的潜在可能。THPA数据库免疫组化分析结果显示SLC31A1在HCC病理组织中低表达,提示其在HCC中的表达下调可能标志着HCC的发生。
通过上述分析,验证铜死亡基因SLC31A1和DBT是影响肝癌进展的重要因子,进一步通过CTD数据、TCMSP数据库和PubChem挖掘SLC31A1和DBT相对应的活性化合物,其中分子对接最佳化合物为叶酸和白藜芦醇,对接分数分别为134.542和79.635 5。WB实验验证结果表明,200 μmol/L叶酸干预下的HepG2细胞中DBT的蛋白表达量增加,其在HCC中表达的下调可能标志着HCC的发生,这提示DBT有作为HCC预测因子及治疗靶标的潜在可能。白藜芦醇是一种多酚有机化合物,不仅可抑制HEPG2细胞增殖,还通过抑制G1期和G2/M期的细胞周期从而抑制肝细胞生长进而导致细胞凋亡[19]。此外,白藜芦醇通过抑制活性氧的产生,并增加NOS的活性和NO生产来调节NO/NOS系统[18]。已有研究表明,白藜芦醇可以通过激活p53,而抑制PI3K/AKT信号传导途径,从而导致beclin 1表达并抑制HCC细胞的增殖,侵袭和迁移[20]。白藜芦醇使有氧糖酵解的HCC细胞凋亡,糖酵解抑制剂可减轻这种效应[21]。白藜芦醇诱导线粒体凋亡与HCC细胞HK2表达的降低有关[21]。此外,白藜芦醇增强了索拉非尼诱导的有氧糖酵解HCC细胞生長抑制作用。这两种试剂联合治疗可抑制HCC小鼠的生长并促进其凋亡[21]。研究表明,叶酸在HCC的发生发展中具有重要意义,叶酸修饰的TPGS-FA可作为NCet等药物的有效载体,并有望成为治疗HCC的一种有效、安全的药物[22-23]。实验研究表明,将叶酸掺入HKUST-1可使铜离子缓慢释放,从而降低细胞毒性,增强细胞体外迁移[24]。
SLC31A1、DBT是與铜死亡相关的基因,研究发现铜可通过单独或与配体结合促进血管生成从而影响肿瘤的发生、发展与转移[16]。铜参与多种细胞过程,包括线粒体呼吸、抗氧化剂防御、氧化还原信号、激酶信号、自噬和蛋白质质量控制[17]。铜过量易导致细胞毒性,在生理浓度下细胞对铜离子的敏感性更高,各种金属离子能以独立的凋亡方式引发细胞死亡,如磷脂过氧化引发的铁中毒[14,17]。铜可被溶质载体家族31号成员1基因跨膜铜转运蛋白SLC31A1吸收,再由超氧化物歧化酶(CCS)的铜伴侣传递给SOD1,发挥抗氧化作用[17,25]。SLC31A1是主要的铜流入转运体,其表达的变化能够诱发细胞铜积累的改变,而降低SLC31A1的表达可以抑制癌细胞的增殖[26-28]。因此,SLC31A1是癌症诊断和治疗值得注意的基因。DBT是哺乳动物激酶CKIε和CKIδ的同源激酶[29],也是时钟基因之一,参与许多不同的功能,包括昼夜节律、平面细胞极性、程序性细胞死亡和生长等。DBT通过阻滞G2/M期细胞并诱导细胞死亡来抑制HepG2细胞的增殖[30]。因此,叶酸与白藜芦醇可能通过促进DBT的表达,从而促进肝癌细胞的铜离子的释放,降低SLC31A1的表达抑制癌细胞的增殖。
本研究为进一步了解铜死亡相关基因SLC31A1、DBT与HCC进程的相关性提供了初步依据,同时进行了与之对应的活性成分筛选,为HCC提供了新的诊疗思路,但其具体的生物学作用及机制还需进一步实验验证。
参考文献:
[1]BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a Cancer Journal for Clinicians, 2018, 68(6): 394-424. DOI: 10.3322/caac.21492.
[2]杨超祺, 刘松梅. DNA甲基化在肝癌中的研究进展[J]. 生命科学, 2021, 33(5): 646-652. DOI: 10.13376/j.cbls/2021068.
[3]BIAN Z L, FAN R, XIE L M. A novel cuproptosis-related prognostic gene signature and validation of differential expression in clear cell renal cell carcinoma[J]. Genes, 2022, 13(5): 851. DOI: 10.3390/genes13050851.
[4]宋厚盼, 刘恒铭, 仇婧玥, 等. 胃癌发病关键基因调控网络构建及其靶向治疗中药活性成分筛选研究[J]. 中草药, 2021, 52(22): 6939-6952. DOI: 10.7501/j.issn.0253-2670.2021.22.020.
[5]DAVIS S, MELTZER P S. GEO query: a bridge between the gene expression omnibus (GEO) and BioConductor[J]. Bioinformatics, 2007, 23(14): 1846-1847. DOI: 10.1093/bioinformatics/btm254.
[6]GU Z G, EILS R, SCHLESNER M. Complex heatmaps reveal patterns and correlations in multidimensional genomic data[J]. Bioinformatics, 2016, 32(18): 2847-2849. DOI: 10.1093/bioinformatics/btw313.
[7]TSVETKOV P, COY S, PETROVA B, et al. Copper induces cell death by targetinglipoylated TCA cycle proteins[J]. Science, 2022, 375(6586): 1254-1261. DOI: 10.1126/science.abf0529.
[8]MITTEER D R, GREER B D. Using GraphPad Prism′s heat maps for efficient, fine-
grained analyses of single-case data[J/OL]. Behavior Analysis in Practice, 2022, 15(2): 505-514. DOI:10.1007/s40617-021-00664-7.
[9]DAVIS A P, WIEGERS T C, JOHNSON R J, et al. Comparative toxicogenomics database (CTD): Update 2023[J]. Nucleic Acids Research, 2023, 51(D1): D1257-D1262. DOI: 10.1093/nar/gkac833.
[10]ZHANG Y J, WEI H Y, FAN L, et al. CLEC4s as potential therapeutic targets in hepatocellular carcinoma microenvironment[J]. Frontiers in Cell and Developmental Biology, 2021, 9: 681372. DOI: 10.3389/fcell.2021.681372.
[11]ZHENG G T, MA Y J, ZOU Y, et al. HCMDB: The human cancer metastasis database[J]. Nucleic Acids Research, 2018, 46(D1): D950-D955. DOI: 10.1093/nar/gkx1008.
[12]UHLEN M, ZHANG C, LEE S, et al. A pathology atlas of the human cancer transcriptome[J]. Science, 2017, 357(6352): eaan2507. DOI: 10.1126/science.aan2507.
[13]KIM S, CHEN J, CHENG T J, et al. PubChem in 2021: new data content and improved web interfaces[J]. Nucleic Acids Research, 2021, 49(D1): D1388-D1395. DOI: 10.1093/nar/gkaa971.
[14]WALLACE M C, PREEN D, JEFFREY G P, et al. The evolving epidemiology of hepatocellular carcinoma: A global perspective[J]. Expert Review of Gastroenterology & Hepatology, 2015, 9(6): 765-779. DOI: 10.1586/17474124.2015.1028363.
[15]EL KHOURY A C, KLIMACK W K, WALLACE C, et al. Economic burden of hepatitis C-associated diseases in the United States[J]. Journal of Viral Hepatitis, 2012, 19(3): 153-160. DOI: 10.1111/j.1365-2893.2011.01563.x.
[16]OLIVERI V. Selective targeting of cancer cells by copper ionophores: an overview[J]. Frontiers in Molecular Biosciences, 2022, 9: 841814. DOI: 10.3389/fmolb.2022.841814.
[17]GE E J, BUSH A I, CASINI A, et al. Connecting copper and cancer:from transition metal signalling to metalloplasia[J]. Nature Reviews Cancer, 2022, 22(2): 102-113. DOI: 10.1038/s41568-021-00417-2.
[18]NOTAS G, NIFLI A P, KAMPA M, et al. Resveratrol exerts itsantiproliferative effect on HepG2 hepatocellular carcinoma cells, by inducing cell cycle arrest, and NOS activation[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2006, 1760(11): 1657-1666. DOI: 10.1016/j.bbagen.2006.09.010.
[19]PIOTROWSKA H, KUCINSKA M, MURIAS M. Biological activity ofpiceatannol: leaving the shadow of resveratrol[J]. Mutation Research/Reviews in Mutation Research, 2012, 750(1): 60-82. DOI: 10.1016/j.mrrev.2011.11.001.
[20]ZHANG B C, YIN X N, SUI S G. Resveratrol inhibited the progression of human hepatocellular carcinoma by inducing autophagy via regulating p53 and the phosphoinositide 3-kinase/protein kinase B pathway[J]. Oncology Reports, 2018, 40(5): 2758-2765. DOI: 10.3892/or.2018.6648.
[21]DAI W Q, WANG F, LU J, et al. By reducing hexokinase 2, resveratrol induces apoptosis in HCC cells addicted to aerobic glycolysis and inhibits tumor growth in mice[J]. Oncotarget, 2015, 6(15): 13703-13717. DOI: 10.18632/oncotarget.3800.
[22]SHARMA R, ALI T, NEGI I, et al. Dietary modulations of folic acid affect the development of diethylnitrosamine induced hepatocellular carcinoma in a rat model[J]. Journal of Molecular Histology, 2021, 52(2): 335-350. DOI: 10.1007/s10735-020-09955-9.
[23]LI D N, LIU S G, ZHU J H, et al. Folic acid modified TPGS as a novel nano-micelle for delivery of nitidine chloride to improve apoptosis induction in Huh7 human hepatocellular carcinoma[J]. BMC pharmacology & toxicology, 2021, 22(1): 1.
[24]XIAO J S, ZHU Y X, HUDDLESTON S, et al. Copper metal-organic framework nanoparticles stabilized with folic acid improve wound healing in diabetes[J]. ACS Nano, 2018, 12(2): 1023-1032. DOI: 10.1021/acsnano.7b01850.
[25]FUJITA K, MOTOYAMA S, SATO Y, et al. Effects of SLC31A1 and ATP7B polymorphisms on platinum resistance in patients with esophageal squamous cell carcinoma receivingneoadjuvant chemoradiotherapy[J]. Medical Oncology, 2021, 38(1): 1-7. DOI: 10.1007/s12032-020-01450-1.
[26]WACHSMANN J, PENG F Y. Molecular imaging and therapy targeting copper metabolism in hepatocellular carcinoma[J]. World Journal of Gastroenterology, 2016, 22(1): 221-231. DOI: 10.3748/wjg.v22.i1.221.
[27]SAFI R, NELSON E R, CHITNENI S K, et al. Copper signaling axis as a target for prostate cancer therapeutics[J]. Cancer Research, 2014, 74(20): 5819-5831. DOI: 10.1158/0008-5472.CAN-13-3527.
[28]BARRESI V, TROVATO-SALINARO A, SPAMPINATO G, et al. Transcriptome analysis of copper homeostasis genes reveals coordinated upregulation of ‘[STBX]SLC31A1, ‘SCO1, and ‘COX11 in colorectal cancer[J]. FEBS Open Bio, 2016, 6(8): 794-806. DOI: 10.1002/2211-5463.12060.
[29]WANG J L, FAN J Y, ZHAO Z W, et al. DBT affects sleep in both circadian and non-circadian neurons[J]. PLoS Genetics, 2022, 18(2): e1010035. DOI: 10.1371/journal.pgen.1010035.
[30]SHABAN N Z, YEHIA S A, AWAD D, et al. A titanium (IV)-dithiophenolate complex and its chitosan nanocomposite: their roles towards rat liver injuries ‘in vivo and against human liver cancer cell lines[J]. International Journal of Molecular Sciences, 2021, 22(20): 11219. DOI: 10.3390/ijms222011219.
