lncRNA MIR100HG与肝细胞癌恶性生物学行为的相关性及其与hsa-miR-2355-3p调控关系的研究
2024-02-21王霞
王 霞
南京医科大学附属淮安第一医院医学检验中心,江苏淮安 223300
肝细胞癌是最常见的恶性肿瘤之一,也是全球癌症相关死亡的主要原因[1]。2020年,全球有近90.6万人被诊断出患有肝癌,其中最常见的类型是肝细胞癌[2]。肝细胞癌是全球第三大癌症死亡原因,其5年生存率约为18%[3]。因此,迫切需要探索和识别诱导肿瘤进展的关键分子,明确其机制。长链非编码RNA(lncRNA)属于长度超过200核苷酸的非编码RNA,几乎不具备蛋白质编码的能力[4],lncRNA可以通过竞争性内源性RNA的方式调控微小RNA(miRNAs)表达。越来越多的证据表明,lncRNA在肝细胞癌发生发展过程中起到了重要作用[5]。例如,lncRNA X-非活性特异性转录物通过 miR-192/三联基序蛋白 25促进乙型肝炎病毒相关肝细胞癌细胞的增殖和迁移[6]。有研究报道,miR-100-let-7a-2-miR-125b-1 宿主基因(MIR100HG)在结直肠癌、胃癌、三阴性乳腺癌、膀胱癌等多种恶性肿瘤中异常高表达,但是其在肝细胞癌中的表达和机制研究鲜有报道[7-11]。因此,本研究通过检测lncRNA MIR100HG与hsa-miR-2355-3p在肝细胞癌组织中的表达并通过细胞实验分析二者的调控关系,探讨lncRNA MIR100HG对肝细胞癌发生、发展的影响。现报道如下。
1 资料与方法
1.1一般资料 选取2017年6月至2018年10月进行手术治疗的肝细胞癌患者90例作为研究对象,研究对象按照肿瘤TNM分期分为TNM Ⅰ期59例、TNM Ⅱ期24例、TNM Ⅲ期2例、TNM Ⅳ期5例。纳入标准:(1)完整的临床病理参数、随访资料;(2)肝细胞癌患者进行根治性手术前未接受放射治疗、化学治疗及靶向治疗。排除标准:(1)临床病理参数和随访资料缺失;(2)复发后继续选择手术治疗;(3)合并其他种类的肿瘤。每例患者取材肿瘤组织及对应的癌旁组织,癌旁组织距离肝细胞癌组织约5 cm以上。本研究使用4株肝细胞癌细胞系HepG2、MHCC97H、SK-HEP-1、SMMC-7721和1株人正常肝脏细胞系LO2,HepG2、MHCC97H由上海中科院细胞所提供,SK-HEP-1、SMMC-7721购自于美国ATCC细胞库。
1.2仪器与试剂 上海芯超生物有限公司提供cDNA芯片,芯片编号:HLivH180Su16,上海吉凯生物有限公司提供敲减MIR100HG的3个干扰片段(si-MIR100HG);上海生工生物有限公司提供hsa-miR-2355-3p类似物/抑制物、lncRNA MIR100HG野生型、lncRNA MIR100HG突变型双荧光素酶报告载体;美国赛默飞生物有限公司提供双荧光素酶报告基因检测试剂盒。
1.3方法
1.3.1细胞培养 肝细胞癌细胞系SMMC-7721在RPMI 1640中培养(含有10%胎牛血清、1%青霉素、1%链霉素),其余细胞系在DMEM中培养,所有培养皿均置于37 ℃、5%CO2的湿润环境中培养。
1.3.2实时荧光定量PCR(qRT-PCR)检测lncRNA MIR100HG和hsa-miR-2355-3p相对表达水平 使用Trizol试剂盒(购自美国赛默飞生物有限公司)提取细胞株中的总RNA,随后将其逆转录为互补DNA(cDNA),另外使用的cDNA芯片也是将组织抽提后的总RNA逆转录为cDNA后铺于微阵列。使用qRT-PCR试剂盒(购自美国西格玛生物有限公司)在ABI 7500荧光定量PCR仪上检测lncRNA MIR100HG和hsa-miR-2355-3p相对表达水平。以甘油醛-3-磷酸脱氢酶(GAPDH)为lncRNA MIR100HG的内参,U6为hsa-miR-2355-3p的内参,以2-ΔΔCt的形式表示相对表达水平,所用引物见表1。
1.3.3细胞迁移实验及侵袭实验 不同处理过的细胞在12孔板中进行培养,吸取细胞悬液加入Transwell上层小室中[侵袭实验在迁移实验基础上多铺一层基质胶(上层小室中),其余操作同迁移实验],将含有10% 胎牛血清的培养液加入到下层小室;当细胞密度达到80%~90%时,将未通过筛孔的细胞用棉签刮去,磷酸缓冲盐溶液清洗掉受损的细胞,将通过筛孔的细胞使用4%多聚甲醛固定后在显微镜下拍照。
1.3.4细胞转染和双荧光素酶报告实验 取对数生长期SMMC-7721细胞并用含10% 胎牛血清的DMEM制备成单细胞悬液,均匀地接种于6孔板中,放置于37 ℃、5%CO2的孵育箱中孵育,敲减lncRNA MIR100HG所用寡核苷酸序列见表1,选取3个siRNAs寡核苷酸中敲减效率最高的指标用于后续实验。使用Starbase2.0(http://starbase.sysu.edu.cn/)及生物信息学数据库验证lncRNA MIR100HG与hsa-miR-2355-3p的潜在结合位点,将含有hsa-miR-2355-3p结合位点的lncRNA MIR100HG野生型和突变型克隆到pGL3质粒上,构建双荧光素酶报告载体,使用lipofectamine 2000依据产品说明书将双荧光素酶报告载体或阴性对照与hsa-miR-2355-3p类似物/抑制物共转染至SMMC-7721细胞中,48 h后测定各组合荧光素酶活性,依据海肾萤光素酶活性将lncRNA MIR100HG标准化为相对表达水平。

2 结 果
2.1肝细胞癌组织中lncRNA MIR100HG相对表达水平与患者临床病理参数的关系 肝细胞癌组织中lncRNA MIR100HG相对表达水平[4.251(3.260,5.302)]高于癌旁组织中lncRNA MIR100HG相对表达水平[0.044(0.039,1.037)],差异有统计学意义(Z=8.206,P<0.001)。肝细胞癌组织中hsa-miR-2355-3p相对表达水平[0.056(0.025,1.215)]低于癌旁组织中hsa-miR-2355-3p相对表达水平[3.120(2.100,4.293)],差异有统计学意义(Z=8.239,P<0.001)。肝细胞癌组织中lncRNA MIR100HG高表达组中肿瘤最大径越大,更倾向于淋巴结转移、血管侵犯、肿瘤远处转移;血清γ-谷氨酰基转移酶(γ-GGT)水平越高,肿瘤TNM分期越高,更倾向于肿瘤复发(P<0.05)。因此,肝细胞癌组织中lncRNA MIR100HG相对表达水平与肿瘤最大径、淋巴结转移、血管侵犯、肿瘤远处转移,血清γ-GGT水平、肿瘤TNM分期及肿瘤复发有关,而肝细胞癌组织中lncRNA MIR100HG相对表达水平与患者性别、年龄、肿瘤数目、肝硬化状况、肝硬化结节个数、肿瘤包膜、乙肝表面抗原状态、血清甲胎蛋白(AFP) 、丙氨酸氨基转移酶(ALT)水平无关(P>0.05)。见表2。
2.2lncRNA MIR100HG相对表达水平与肝细胞癌患者预后的关系 将肝细胞癌患者根据TNMⅠ~Ⅳ期、TNMⅠ期、TNMⅡ期分别进行预后分析(由于TNM Ⅲ期和Ⅳ期患者分别只有2例和5例,样本量太少,无法单独进行分析),TNM Ⅰ~Ⅳ期、TNMⅠ 期、TNMⅡ 期肝细胞癌患者lncRNA MIR100HG高表达组总体生存率均低于低表达组,差异有统计学意义(χ2=52.06、27.99、11.13,P<0.05);TNM Ⅰ~Ⅳ期、TNMⅠ 期、TNMⅡ 期肝细胞癌患者lncRNA MIR100HG高表达组无复发生存率均低于低表达组,差异有统计学意义(χ2=91.60、60.72、21.59,P<0.05)。见图1。经Cox比例风险模型探讨影响肝细胞癌患者生存时间的独立危险因素,发现有肿瘤远处转移、肿瘤TNM Ⅲ~Ⅳ期、有复发和lncRNA MIR100HG异常高表达(将90例肝细胞癌组织中lncRNA MIR100HG相对表达水平排序,高于或等于中位数则定义为lncRNA MIR100HG异常高表达)较之无肿瘤远处转移、TNM Ⅰ~Ⅱ期、无复发和lncRNA MIR100HG低表达对肝细胞癌患者的预后均产生不利的影响,差异有统计学意义(HR=11.156、6.462、8.585、7.799,P<0.05)。lncRNA MIR100HG异常高表达是肝细胞癌患者预后不良的独立危险因素(P<0.05)。见表3、4。

注:A、B分别评估90例TNM Ⅰ~Ⅳ期肝细胞癌患者lncRNA MIR100HG高表达组、低表达组总体生存率和无复发生存率;C、D分别评估59例TNMⅠ期肝细胞癌患者lncRNA MIR100HG高表达组、低表达组总体生存率和无复发生存率;E、F分别评估24例TNMⅡ期肝细胞癌患者lncRNA MIR100HG高表达组、低表达组总体生存率和无复发生存率。
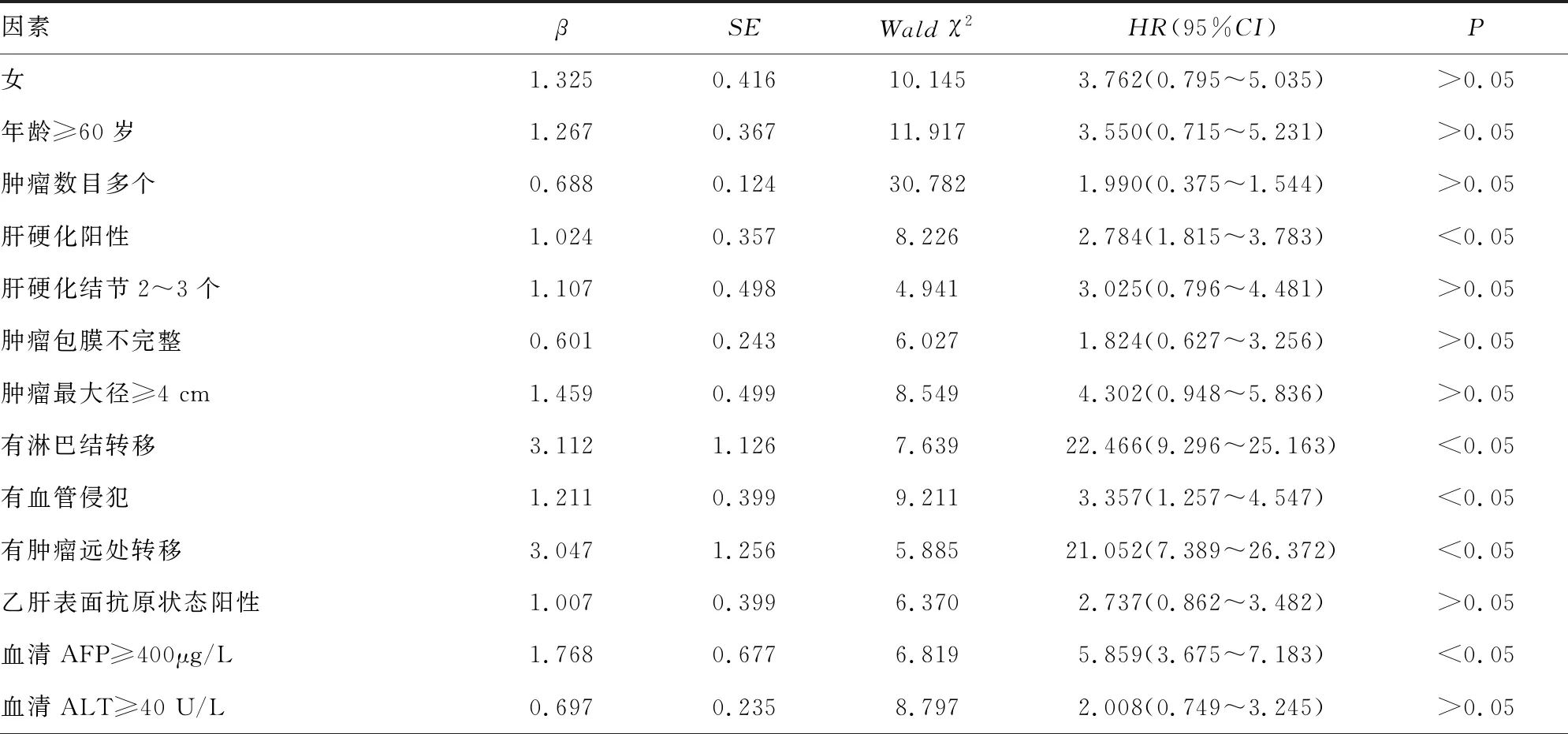
表3 影响肝细胞癌患者生存时间的单因素回归分析

表4 影响肝细胞癌患者生存时间的多因素回归分析
2.3LncRNA MIR100HG在肝癌细胞中的表达及敲减效率的验证 对4株肝细胞癌细胞系HepG2、MHCC97H、SK-HEP-1、SMMC-7721及人正常肝脏细胞系LO2中lncRNA MIR100HG相对表达水平进行检测,结果发现4株肝细胞癌细胞系HepG2、MHCC97H、SK-HEP-1、SMMC-7721中lncRNA MIR100HG相对表达水平分别为(2.50±0.20)、(2.60±0.18)、(1.30±0.11)、(6.30±0.16),其中肝细胞癌细胞系HepG2、MHCC97H、SMMC-7721细胞lncRNA MIR100HG相对表达水平高于人正常肝脏细胞系LO2中lncRNA MIR100HG相对表达水平(1.00±0.16),差异有统计学意义(P<0.05);肝细胞癌细胞系SK-HEP-1与人正常肝脏细胞系LO2中lncRNA MIR100HG相对表达水平比较差异无统计学意义(P>0.05)。选取肝细胞癌细胞系SMMC-7721转染3个干扰片段(si-MIR100HG),阴性对照、si-MIR100HG-1#、si-MIR100HG-2#、si-MIR100HG-3#敲减后lncRNA MIR100HG相对表达水平分别为(1.00±0.16)、(0.76±0.05)、(0.60±0.05)、(0.07±0.02),其中si-MIR100HG-3#”敲减后lncRNA MIR100HG相对表达水平显著下降(P<0.05)。
2.4LncRNA MIR100HG在肝细胞癌细胞中可能调控hsa-miR-2355-3p的表达 通过使用Starbase 2.0数据库(http://starbase.sysu.edu.cn/),预测hsa-miR-2355-3p可能是lncRNA MIR100HG的下游靶标,预测结合位点见图2A(处于11号染色体121962377-121962398位置)。肝细胞癌细胞系SMMC-7721中转染si-MIR100HG干扰片段后hsa-miR-2355-3p的相对表达水平(7.62±0.26)与阴性对照(1.00±0.16)相比明显升高(P<0.001)。此外,使用双荧光素酶报告实验进一步验证lncRNA MIR100HG和hsa-miR-2355-3p之间的是否存在物理学上的结合位点,通过构建与hsa-miR-2355-3p具有结合位点的lncRNA MIR100HG野生型和突变型双荧光素酶报告质粒。见图2B。“microRNA与lncRNA结合验证”实验结果显示,与阴性对照相比,共转染hsa-miR-2355-3p 类似物能够抑制lncRNA MIR100HG野生型表达载体的荧光素酶活性[荧光素酶活性从(1.80±0.11)降为(0.7±0.09),差异有统计学意义(P<0.05)],但lncRNA MIR100HG突变型表达载体的荧光素酶活性没有变化[荧光素酶活性从(1.90±0.12)降为(1.73±0.13),差异无统计学意义(P>0.05)],结果提示hsa-miR-2355-3p可能是lncRNA MIR100HG的下游靶标。

注:A表示通过Starbase2.0数据库对lncRNA MIR100HG和hsa-miR-2355-3p进行序列比对;B表示双荧光素酶报告质粒的构建,其中红色碱基为对靶基因序列进行配对和突变的说明。
2.5下调hsa-miR-2355-3p逆转敲减lncRNA MIR100HG介导的肝细胞癌细胞迁移和侵袭能力的抑制 Transwell实验结果显示,与阴性对照[细胞迁移实验和侵袭实验细胞计数分别为(101±7)个和(45±2)个]相比,转染si-MIR100HG后[细胞迁移实验和侵袭实验细胞计数分别为(55±4)个和(11±1)个]能够明显抑制肝细胞癌细胞系SMMC-7721细胞迁移和侵袭能力(P<0.001)。联合转染si-MIR100HG和hsa-miR-2355-3p抑制物后发现,与单独转染si-MIR100HG相比[细胞迁移实验和侵袭实验细胞计数分别为(55±4)个和(11±1)个],联合转染后肝细胞癌细胞系SMMC-7721细胞迁移和侵袭能力得到恢复[细胞迁移实验和侵袭实验细胞计数分别为(100±6)个和(39±2)个],差异有统计学意义(P<0.001),单独转染hsa-miR-2355-3p抑制物后[细胞迁移实验和侵袭实验细胞计数分别为(121±6)个和(59±8)个]发现,与阴性对照[细胞迁移实验和侵袭实验细胞计数分别为(101±7)个和(45±2)个]相比,肝细胞癌细胞系SMMC-7721细胞迁移和侵袭能力明显上调(P<0.05)。结果表明,敲减lncRNA MIR100HG抑制肝细胞癌细胞迁移和侵袭能力,下调hsa-miR-2355-3p可逆转其抑制功能。见图3。

图3 转染si-MIR100HG及联合hsa-miR-2355-3p抑制物对肝细胞癌细胞系SMMC-7721细胞迁移和侵袭能力的影响(×100)
3 讨 论
肝细胞癌是目前常见的高致死率的恶性肿瘤之一[12]。70%~80%患者明确诊断时已经处于晚期,只能接受姑息治疗[13-14]。因此,阐明肝细胞癌进展的分子机制迫在眉睫。近期许多研究报道lncRNA与肿瘤的许多恶性生物学行为密切相关[15]。本研究结果显示,lncRNA MIR100HG在肝细胞癌细胞系和肿瘤组织中异常高表达,推测其可能参与了肿瘤的发生。相关性分析证实,与lncRNA MIR100HG低表达组相比,lncRNA MIR100HG高表达组的肿瘤最大径较大,血清γ-GGT水平较高,γ-GGT主要存在于肝内胆管上皮和肝细胞浆中,升高往往因为胆汁淤积造成,在阻塞性黄疸、原发性肝癌及酒精性肝病发生时升高尤为明显[16-17],以上结果提示lncRNA MIR100HG可能具有促进肝细胞癌发生增殖的能力。肝细胞癌细胞发生转移一般先侵袭基底膜,突破基底膜后侵犯血液系统和淋巴系统,进一步发生远处转移,肿瘤是否有侵袭性对预后影响很大[18]。本研究结果显示,与lncRNA MIR100HG低表达组相比,lncRNA MIR100HG高表达组肿瘤细胞越倾向于淋巴结转移和肿瘤远处转移;细胞迁移和侵袭实验也证实lncRNA MIR100HG有促进肝细胞癌细胞迁移和侵袭的作用,但是需要进一步的体内动物实验佐证。肿瘤TNM分期和复发与肿瘤进展密切相关,肿瘤TNM分期越高,患者预后往往不佳,治疗后肿瘤复发往往会导致患者的生存期大幅缩短,对患者的预后产生十分不利的影响[19],相关性分析结果提示lncRNA MIR100HG与患者TNM分期及复发也有关,以上结果提示lncRNA MIR100HG异常高表达与肝细胞癌的发展密切相关。
将肝细胞癌患者根据TNM Ⅰ~Ⅳ期、Ⅰ期、Ⅱ期分别进行预后分析,结果显示lncRNA MIR100HG高表达组的总体生存率和无复发生存率均明显低于低表达组,同时多因素回归分析也佐证肝细胞癌组织中lncRNA MIR100HG异常高表达是促进患者不良预后的独立危险因素。提示lncRNA MIR100HG可以有效预测TNM Ⅰ和Ⅱ期肝细胞癌患者的预后,其lncRNA MIR100HG异常高表达提示肝细胞癌患者预后不良,由于TNM Ⅲ和Ⅳ期肝细胞癌患者例数太少,无法单独进行统计分析,今后研究会进一步纳入TNM Ⅲ期和Ⅳ期肝细胞癌患者进行预后分析。
miRNAs是一类约22个核苷酸大小的非编码RNA,通过结合mRNA调控其表达[20]。本研究通过数据库分析发现lncRNA MIR100HG与hsa-miR-2355-3p存在互补序列,hsa-miR-2355-3p在肝细胞癌组织中的表达显著低于癌旁组织,且有研究报道hsa-miR-2355-3p与肺癌和胰腺癌的恶性生物学行为密切相关[21-22];在肝细胞癌细胞系SMMC-7721中敲减lncRNA MIR100HG后引起hsa-miR-2355-3p的上调,推测二者之间可能存在“此消彼长”的调控关系。通过进一步的Transwell实验结果推断lncRNA MIR100HG可能通过介导hsa-miR-2355-3p促进肝细胞癌细胞侵袭和迁移,此外,双荧光素酶报告实验初步推测lncRNA MIR100HG和hsa-miR-2355-3p二者可能存在物理学上的结合位点,但是需要进一步的确证实验证实。
综上所述,lncRNA MIR100HG异常高表达与肝细胞癌恶性生物学行为密切相关,参与了肝细胞癌的发生、发展,并且可能通过介导hsa-miR-2355-3p促进肝细胞癌细胞系迁移和侵袭,其有望成为肝细胞癌患者潜在的预后标志物及分子治疗靶点。
