肝细胞癌患者癌组织中CRIP1、STUB1表达及临床预后意义*
2024-02-21马鹏飞郑幼伟
张 景,沈 晨,马鹏飞,郑幼伟
河南科技大学第一附属医院肝胆外科,河南洛阳 471000
肝癌是常见的消化系统恶性肿瘤。我国肝癌发病率较高,发病例数达全球50%以上[1]。肝细胞癌是肝癌最常见的病理类型[2]。肝细胞癌恶性程度高、肿瘤早期易出现肝内外转移、治疗后复发率高[3]。深入研究肝细胞癌疾病机制,寻找能够评估肝细胞癌预后的标志物具有重要意义。富含半胱氨酸肠蛋白1(CRIP1)属于LIM双锌指蛋白家族成员,广泛表达于肠道、肺及脾等器官中,参与锌吸收转运、抗炎和抗细菌等生物学作用[4]。近年来有研究发现,CRIP1在结直肠癌、宫颈癌等恶性肿瘤中表达上调,其通过抑制肿瘤细胞凋亡、增强化疗耐药性等,促进肿瘤恶性进展[5-6]。STIP1同源性和包含U-box蛋白1(STUB1)编码基因位于人类染色体16p13.3,结构上包含保守的指环结构,具有伴侣蛋白和E3泛素连接酶的功能。近年来有研究发现,结直肠癌等恶性肿瘤中STUB1表达缺失,导致丙酮酸激酶2泛素化降解减少,肿瘤糖酵解过程被激活,促进肿瘤进展[7]。目前肝细胞癌患者癌组织中 CRIP1、STUB1表达与临床病理特征和预后的关系尚不清楚。本研究旨在通过检测肝细胞癌患者癌组织中CRIP1、STUB1表达,探讨二者与患者临床病理特征的关系及其临床预后意义。现报道如下。
1 资料与方法
1.1一般资料 选取2018年2月至2020年2月本院诊治的112例肝细胞癌患者作为研究对象。纳入标准:(1)肿瘤原发于肝脏,经肝穿刺活检或术后组织病理学明确诊断为肝细胞癌;(2)初次治疗,既往无化疗、靶向药物及免疫治疗;(3)临床资料完整。排除标准:(1)合并严重心肺衰竭或严重的基础疾病;(2)合并其他器官恶性肿瘤;(3)妊娠哺乳期女性;(4)排除结缔组织疾病。肝细胞癌患者中男68例、女44例,年龄34~71岁,平均(56.26±7.13)岁;肿瘤TNM分期:Ⅰ期61例,Ⅱ~Ⅲ期51例;乙型肝炎病毒表面抗原:阳性58例,阴性54例;组织学分级:Ⅰ~Ⅱ级74例、Ⅲ级38例;肿瘤最大径:<5 cm 80例,≥5 cm 32例;甲胎蛋白:≤400 μg/L 78例,>400 μg/L 34例;有血管侵犯37例、无血管侵犯75例。本研究经医院伦理委员会批准(2018-0179),患者及家属对本研究知情并签署同意书。
1.2检测方法 免疫组化检测肝细胞癌患者癌组织和癌旁组织中CRIP1、STUB1表达。留取所有肝细胞癌患者术中获取的癌组织和癌旁组织。癌旁组织为距离癌组织边缘2 cm以上,经病理组织检查明确为正常肝组织[8]。10%福尔马林溶液固定,常规脱水、石蜡包埋、5μm切片。脱蜡后梯度酒精水化,柠檬酸盐溶液中高压热修复。滴加CRIP1、STUB1一抗(美国Abcam公司,货号ab211631、ab134064),4 ℃过夜,DAB显色,苏木素复染,脱水封片后MM-400显微镜(购自日本尼康公司)观察染色情况。染色强度评分:棕褐色(2分)、浅黄色(1分)、无色(0分)。阳性细胞百分比评分:≥75%(4分)、50%~<75%(3分)、25%~<50%(2分)、5%~<25%(1分),<5%(0分)。免疫组化评分(染色强度和阳性细胞百分比评分的乘积):≥2分为阳性,<2分为阴性。同时采用ImagePro Plus图像分析软件对肝细胞癌患者的癌组织和癌旁组织中CRIP1、STUB1蛋白表达进行定量分析,计算每张切片染色的平均吸光度值。
1.3随访 患者出院后定期随访,以门诊、电话的方式随访,每3~6个月随访1次,随访3年。以患者因疾病进展或因该疾病导致的严重并发症而死亡为研究终点,随访截止至2023年3月1日。
1.4统计学处理 采用统计软件SPSS26.0进行数据分析。计数资料以率或百分比表示,组间比较采用χ2检验。CRIP1与STUB1表达的相关性采用Spearman秩相关分析。Kaplan-Meier曲线分析(Log-rank检验)癌组织中不同CRIP1、STUB1表达对肝细胞癌患者生存预后的影响。单因素及多因素COX比例风险模型分析影响肝细胞癌患者生存预后的因素。P<0.05表示差异有统计学意义。
2 结 果
2.1肝细胞癌患者癌组织与癌旁组织中CRIP1、STUB1表达比较 肝细胞癌患者癌组织中CRIP1阳性率为62.50%(70/112),明显高于癌旁组织 [7.14%(8/112)],差异有统计学意义(χ2=76.652,P<0.05)。肝细胞癌患者癌组织中STUB1阳性率为26.23%(32/112),明显低于癌旁组织[82.14%(92/112)],差异有统计学意义(χ2=73.284,P<0.05)。见图1。肝细胞癌患者癌组织中CRIP1染色的平均吸光度值为(0.394±0.078),高于癌旁组织(0.086±0.015),差异有统计学意义(t=41.037,P<0.05)。肝细胞癌患者癌组织中STUB1染色的平均吸光度值为(0.097±0.024),低于癌旁组织(0.298±0.066),差异有统计学意义(t=30.290,P<0.05)。见图2。

图1 肝细胞癌患者癌组织与癌旁组织中CRIP1、STUB1表达(免疫组化,×200)

图2 肝细胞癌患者癌组织与癌旁组织中CRIP1、STUB1染色的平均吸光度值比较
2.2癌组织中CRIP1与STUB1表达的相关性 Spearman秩相关性分析显示,癌组织中CRIP1与STUB1表达呈负相关(r=-0.678,P<0.001)。
2.3癌组织中CRIP1、STUB1表达与临床病理特征的关系 不同肿瘤TNM分期、组织学分级及肿瘤最大径的肝细胞癌患者癌组织中CRIP1、STUB1阳性率比较,差异有统计学意义(P<0.05)。见表1。
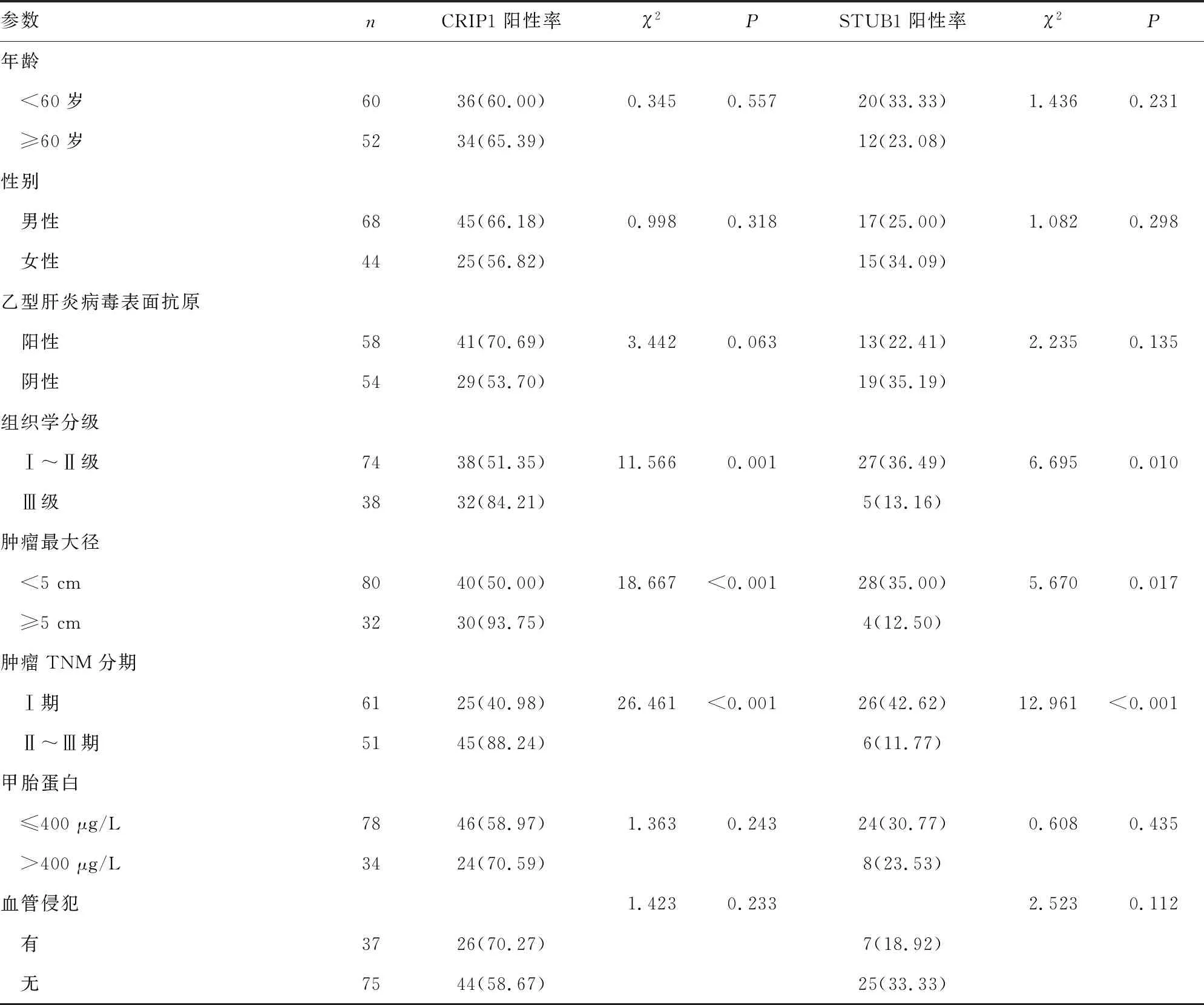
表1 癌组织中CRIP1、STUB1表达与肝细胞癌患者临床病理特征的关系[n(%)]
2.4癌组织CRIP1、STUB1表达与肝细胞癌患者生存预后的关系 112例肝细胞癌患者随访6~36个月,无失访病例,死亡51例,3年累积生存率为54.46%(61/112)。癌组织CRIP1阳性患者(CRIP1阳性组)、CRIP1阴性患者(CRIP1阴性组)3年累积生存率依次为35.71%(25/70)、85.71%(36/42),CRIP1阳性组3年累积生存率明显低于CRIP1阴性组,差异有统计学意义(Log-rankχ2=29.601,P<0.001)。STUB1阳性组、STUB1阴性组3年累积生存率依次为87.50%(28/32)、41.25%(33/80),STUB1阴性组3年累积生存率明显低于STUB1阳性组,差异有统计学意义(Log-rankχ2=13.590,P<0.001)。见图3。

图3 Kaplan-Meier曲线分析癌组织CRIP1、STUB1表达与肝细胞癌患者生存预后的关系
2.5COX比例风险模型分析影响肝细胞癌患者生存预后的因素 以肝细胞癌患者生存为因变量(1=死亡,0=存活,t=生存时间),以患者各临床病理特征及CRIP1、STUB1表达为自变量,进行单因素及多因素COX分析,结果表明,肿瘤TNM分期Ⅱ~Ⅲ期、组织学分级Ⅲ级、肿瘤最大径>5 cm、CRIP1阳性、STUB1阴性是影响肝细胞癌患者预后的独立危险因素。见表2、3。
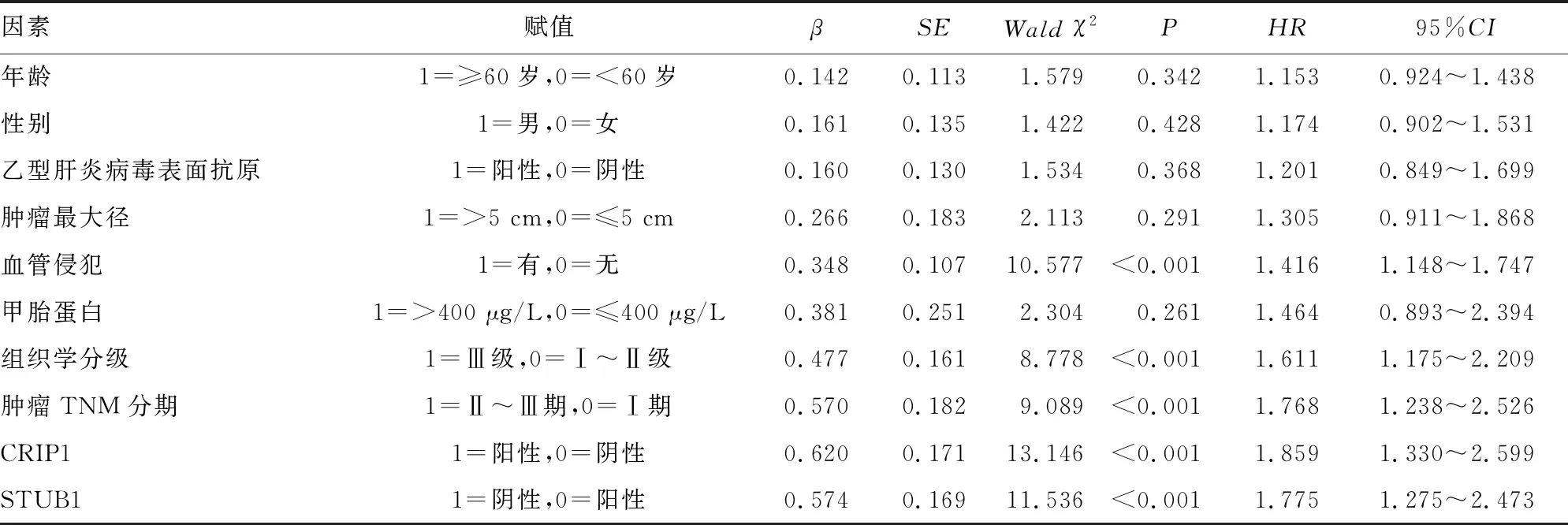
表2 单因素COX比例风险模型

表3 多因素COX比例风险模型
3 讨 论
肝癌是全世界癌症相关死亡的第二大主要原因,全球每年新发病例达85万例[9]。肝细胞癌是最常见的肝癌类型。目前肝细胞癌的治疗包括手术治疗、介入栓塞及射频消融等,但肿瘤易复发、转移,导致不良生存预后。肝细胞癌疾病机制复杂,涉及癌基因激活、肿瘤过度血管生成及肿瘤微环境免疫抑制等。深入研究肝细胞癌疾病机制,寻找能够评估肝细胞癌患者预后的肿瘤标志物,具有重要意义。
CRIP1是由富含半胱氨酸与甘氨酸和LIM基序组成的小分子蛋白,参与肠道锌的转运和锌吸收等生理学过程。有研究表明,CRIP1在转移性结直肠癌、卵巢癌等肿瘤中高表达,其通过促进肿瘤侵袭及转移,导致患者不良预后[5,10]。本研究结果显示,肝细胞癌患者癌组织中CRIP1阳性率明显高于癌旁组织,差异有统计学意义(χ2=76.652,P<0.05),提示CRIP1参与肝细胞癌发生、发展。肝细胞癌中CRIP1表达升高与表观遗传学调控异常有关[11]。本研究结果显示,不同肿瘤TNM分期、组织学分级及肿瘤最大径的肝细胞癌患者癌组织中CRIP1阳性率比较,差异有统计学意义(P<0.05),提示CRIP1表达参与促进肝细胞癌的进展。研究证实,肝癌细胞HepG2中CRIP1的表达升高能够磷酸化激活Ras及下游AKT信号通路的传导,促进肿瘤细胞恶性增殖及侵袭,导致肿瘤进展[12]。尚有研究表明,CRIP1的过度表达能够下调肝癌细胞中乙酰肉碱的表达,抑制β-连环蛋白乙酰化修饰,促进β-连环蛋白核积累,导致肿瘤干样特性形成及上皮间质转化的发生,肿瘤细胞侵袭和迁移能力增强,促进肿瘤转移[13]。本研究结果显示,CRIP1阳性是影响肝细胞癌患者预后的独立危险因素,提示CRIP1是新的肝细胞癌预后相关肿瘤标志物。分析其原因,CRIP1表达能够与Fas蛋白相互作用,抑制Fas及Fas介导的凋亡相关蛋白的表达,增强肿瘤对5-氟尿嘧啶等化疗药的耐药性,导致患者不良预后[5]。此外,CRIP1表达升高能够促进肿瘤细胞化疗时DNA损伤修复,因而在CRIP1高表达的急性白血病患者对联合化疗治疗治疗的完全缓解率较低,肿瘤治疗后容易出现复发和进展,导致患者死亡[11,14]。
STUB1是一种伴侣依赖性E3泛素连接酶,含有N端的三个四肽重复序列,能与伴侣蛋白结合,而C端的U-盒结构域介导E3泛素连接酶活性[15]。STUB1通过靶向底物蛋白K63,K27形式的泛素化,参与核因子-κB等信号通路的调控,与恶性肿瘤的发生、增殖和侵袭密切相关[15-16]。本研究结果显示,肝细胞癌患者癌组织中STUB1阳性率明显低于癌旁组织,差异有统计学意义(χ2=73.284,P<0.05),提示STUB1表达下调参与肝细胞癌发生过程。既往研究表明,三重基序蛋白6能够与STUB1相互作用,促进STUB1的泛素化降解,降低肿瘤细胞中STUB1水平,进而激活Yes相关蛋白的信号传导,促进乳腺癌的过度增殖[17]。本研究结果显示,不同肿瘤TNM分期、组织学分级及肿瘤最大径的肝细胞癌患者癌组织中STUB1阳性率比较,差异有统计学意义(P<0.05),提示STUB1的表达下调促进肝细胞癌的恶性进展。研究发现,STUB1以热休克蛋白70依赖的方式与Foxp3相互作用,促进Foxp3蛋白K48位点的多泛素化,促进肿瘤微环境中调节性T细胞功能失活,而STUB1表达缺失时,肿瘤微环境中调节性T细胞显著激活,抑制肿瘤杀伤性T淋巴细胞的效应,促进肿瘤恶性进展[18]。此外,肿瘤细胞表面的干扰素γ受体1是STUB1的作用靶点,STUB1的表达缺失导致干扰素γ受体1泛素蛋白酶体途径降解减少,干扰素通路过度激活,引起下游Jacus相关激酶的磷酸化,促进程序性死亡因子配体1表达上调,诱导肿瘤细胞免疫逃逸,导致肿瘤进展[16]。本研究结果显示,STUB1阴性是影响肝细胞癌患者预后的独立危险因素,提示检测STUB1表达有助于评估肝细胞癌患者的临床预后。有学者发现,STUB1的表达缺失导致肿瘤细胞表面表皮生长因子受体蛋白稳定性显著增加,降低肿瘤对酪氨酸激酶抑制剂及组蛋白脱乙酰酶抑制剂治疗的敏感性,导致肿瘤耐药及患者不良预后[19-20]。因此,STUB1是新的评估肝细胞癌预后的肿瘤标志物,以STUB1为靶点的治疗可能是新的治疗方案。本研究肝细胞癌患者癌组织中CRIP1与STUB1表达呈负相关,提示肝细胞癌中二者可能存在相互作用关系。有学者报道,肝癌中CRIP1能够与STUB1相互作用,促进γ-丁酰基羟化酶1的泛素化和蛋白酶体降解,进而下调肉碱能量代谢促进肝癌细胞的干样特性[13]。但二者具体作用机制及能否成为新的肝细胞癌治疗靶点,有待今后深入研究。
综上所述,肝细胞癌患者癌组织中 CRIP1表达上调,STUB1表达下调,二者与肝细胞癌患者肿瘤TNM分期、组织学分级及肿瘤最大径有关,均参与肝细胞癌的发生、发展。肿瘤TNM分期Ⅱ~Ⅲ期、组织学分级Ⅲ级、肿瘤最大径>5 cm、CRIP1阳性、STUB1阴性是影响肝细胞癌患者预后的独立危险因素。临床上可根据肝细胞癌患者癌组织中 CRIP1、STUB1表达对患者预后进行评估,对于高危患者予以积极诊治,以改善生存预后。但本研究限于样本量有限、随访时间较短,有待今后涉及多中心长期随访的临床实验,进一步研究CRIP1、STUB1在肝细胞癌中的临床价值。
