基于直扩RT-PCR技术的寨卡病毒快速检测方法的建立*
2024-02-21古莉冰何建安2李华文李福缘顾大勇2
李 浪,古莉冰,朱 丽,何建安2,,叶 颖,张 然,李华文,李福缘,顾大勇2,△
1.广东医科大学公共卫生学院,广东东莞 523808;2.深圳市检验检疫科学研究院,广东深圳 518033;3.中华人民共和国深圳海关,广东深圳 518026;4.深圳国际旅行卫生保健中心/深圳海关口岸门诊部,广东深圳 518045;5.深圳市宝安区中医院社区健康服务管理中心,广东深圳 518133
寨卡病毒属于黄病毒科,黄病毒属,主要通过蚊媒传播,其传播媒介包括埃及伊蚊和白纹伊蚊等,蚊媒叮咬寨卡病毒感染者而被感染,其后再通过叮咬的方式将病毒传染给其他人[1-2]。寨卡病毒还可以通过母婴、性传播和血液传播[3-6]。我国在2016年2月开始有输入病例报道,主要通过各出入境口岸传入。随着蚊媒活跃季节的到来,我国有伊蚊分布的地区存在本地传播的风险。目前,寨卡病毒检测主要运用聚合酶链反应(PCR)技术[7]。PCR现场快速检测面临的障碍之一是复杂的样本前处理步骤,如能取消样本预处理步骤,直接对样本进行PCR或者实时荧光定量逆转录PCR(RT-PCR),将简化实验过程、节省时间,并有可能实现寨卡病毒疫情暴发现场的快速检测与筛查,甚至实现自动化操作。目前国外已有关于样本直扩PCR技术的研究,对于临床样本而言,研究最多的样本是全血,而对其他样本如尿、唾液等的研究还较少[8-11]。本研究通过采用特殊功能的聚合酶,建立直接对多种临床样本进行扩增检测的方法,达到快速、便捷检测出靶标的目的。
1 材料与方法
1.1标本来源 寨卡病毒假病毒委托汉恒生物有限公司包被合成,浓度为2×108PFU/mL;委托宝日医生物技术(北京)有限公司合成10 μg 寨卡病毒 RNA干粉;委托生工生物(上海)有限公司合成5种虫媒病毒[登革病毒(DENV)、黄热病毒、基孔肯雅病毒(CHIKV)、西尼罗河病毒和乙型脑炎病毒]和5种细菌质粒(炭疽杆菌、布鲁氏菌、鼻疽伯克霍尔德氏菌、类鼻疽伯克氏菌和土拉杆菌)及引物探针;所有样本均来自深圳国际旅行卫生保健中心卫生检疫中心实验室。
1.2方法
1.2.1寨卡病毒靶序列及引物探针序列的设计 选择寨卡病毒高度保守基因NS5片段作为靶标,以靶标为依据,应用美国国立生物信息技术中心(NCBI)的Primer-BLAST功能及美国应用生物系统公司(ABI)公司的PrimerExpress3.0.1软件(PrimerPremier5),依据引物探针设计原则,设计满足条件的引物及探针。寨卡病毒高度保守基因NS5的查询覆盖度为100%,表明几乎blast基因库中的所有寨卡病毒序列,E值为0表明结果非常可信,序列一致性>99%表明该段序列在寨卡病毒中相似度很高,突变率低,高度保守。具体的引物、探针序列信息见表1。

表1 寨卡病毒高度保守基因NS5的引物、探针的序列信息
1.2.2DNA聚合酶的筛选 依据5种DNA聚合酶:高耐受性聚合酶(Omni Taq)、嗜热细菌的耐热DNA聚合酶(Tth)、 耐受特性的DNA聚合酶(Alpha Taq)、热启动DNA聚合酶(Hot Taq)、基于Tth酶改造的DNA聚合酶(TTX)的商家使用指南,初步建立反应体系与反应程序,对5种样本(全血、血清、唾液、咽拭子和尿)进行检测扩增。
1.2.3PCR增强剂的优选 向反应混合物中直接加6.25 μL 0.5×PCR增强剂-2(PEC-2)进行样本检测扩增;并分别向反应混合物中加入PCR增强剂,浓度为0.05%十二烷基硫酸钠(SDS)、5%甘油、0.4 mg/mL牛血清白蛋白(BSA)、1∶10的明胶水溶液、2 mmol/L,二硫苏糖醇(DTT)、10%二甲基亚砜(DMSO)和10%去离子甲酰胺,按PCR增强剂所需的浓度分别配成不含酶和引物探针的2.5×预混液,然后以1×预混液的量加入到反应混合物中对5种样本进行检测扩增。
1.2.4程序的优化 优化的逆转录温度和退火/延伸温度范围分别为45~65 ℃和50~70 ℃,伯乐CFX96 Touch实时荧光定量PCR仪对设置的温度范围自动生成8个温度梯度,对其中6个温度(逆转录温度:46.2、48.9、52.7、57.6、61.6、63.8 ℃;退火/延伸温度:51.3、54.0、58.0、62.9、67.0、69.3 ℃)进行优化。所有优化实验均以寨卡病毒假病毒的浓度为106PFU/mL的样本为检测对象,除了对全血样本用磷酸缓冲盐溶液(PBS)缓冲液进行稀释后作为检测对象外,其余4种样本均直接用于检测扩增。PCR反应体系的建立实验在ABI 7500 实时荧光定量PCR仪上进行,逆转录温度和退火/延伸温度的优化实验在伯乐CFX96 Touch实时荧光定量PCR仪上进行,每个实验孔至少重复2次,每次实验均包括1个阳性对照(RNA标准品)、无模板对照(NTC)及1个阴性对照,以最小阈值循环数(Ct)值和最大扩增效率为优化原则选择最佳条件。结果分析条件设定:阈值设定原则,阈值线设定于刚好超过阴性对照扩增曲线的最高点。结果描述及判断:阳性对照Ct值≤30并出现特定的扩增曲线,阴性对照无Ct值并且无特定扩增曲线,实验结果成立;被检样本若羧基荧光素(FAM)荧光信号Ct值<40并出现特定的扩增曲线,则判断为阳性;被检样本Ct值≥40时,则判定为阴性;对于某些未呈现S型曲线,但本底较高的样本,应为阴性。
1.2.5检测限、特异性实验和重复性实验 对5种样本的系列梯度浓度(2×100~ 2×106PFU/mL)进行扩增,每个浓度设置3个重复孔,以能检测到最低病毒滴度作为检测限。以5种非寨卡病毒(属于黄病毒科)质粒和5种细菌质粒为模板,进行特异性实验。选择其中3种样本进行6次重复性实验。
1.2.6方法的临床应用 对8个寨卡病毒样本、54个DENV样本、8个CHIKV样本和12阴性样本即正常的临床样本进行扩增,以常规RT-PCR技术(以提取的核酸为模板)为金标准,计算临床检测灵敏度和特异度。其中8个寨卡病毒样本包括患者1的血清样本,患者2的血清样本,患者3的咽拭子样本,以及其他5个样本。

1.2.8直扩RT-PCR技术 常规的RT-PCR需要以高质量的核酸为模板进行反应,如模板中有样本抑制物或提取试剂组分残留时就会抑制RT-PCR的顺利进行。而直扩RT-PCR与其的主要区别在于,样本可不经过核酸抽提,直接进行RT-PCR。直扩RT-PCR能够节省时间,实现快速检测。
2 结 果
2.1基于直扩RT-PCR技术的寨卡病毒快速检测方法
2.1.1DNA聚合酶的筛选 5种DNA聚合酶对5种样本的扩增曲线结果得知,Hot Start对5种样本均未能扩增,只有Omin Taq对5种样本均得到了不同程度的扩增。4种DNA聚合酶对5种样本的扩增Ct值见图1,Omni Taq和Alpha Taq对4种样本(血清、唾液、咽拭子和尿)的扩增平均Ct值分别为16.40和16.79,Tth和TTX对这4种样本的扩增平均Ct值分别为21.05和21.48,Omni Taq和Alpha Taq扩增平均Ct值明显比Tth和TTX扩增平均Ct值小。基于Alpha Taq不能成功扩增全血样本,DNA聚合酶选择Omni Taq。
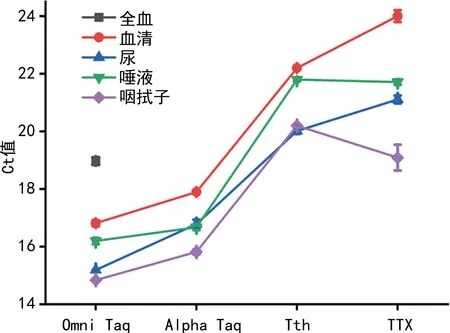
图1 4种DNA聚合酶对5种样本的扩增平均Ct值比较
2.1.2PCR增强剂的优化 7种PCR增强剂对基于直扩RT-PCR技术的寨卡病毒快速检测5种样本的扩增Ct值的影响见图2。除了添加去离子甲酰胺、SDS对基于直扩RT-PCR技术的寨卡病毒快速检测方法检测5种样本有明显的抑制作用外(Ct值明显比添加其他5种增强剂的Ct值高),添加其余5种PCR增强剂对基于直扩RT-PCR技术的寨卡病毒快速检测方法检测其他4种样本(除了全血样本)的扩增Ct值影响不大(Ct值波动范围<1);添加甘油、BSA、明胶水溶液、DTT和DMSO有助于增强基于直扩RT-PCR技术的寨卡病毒快速检测方法检测全血样本的扩增效率,其中添加明胶水溶液时Ct值最大相差2.18。基于5种样本扩增效率及PCR反应体系已有成分的考虑,选择不添加以上7种PCR增强剂。
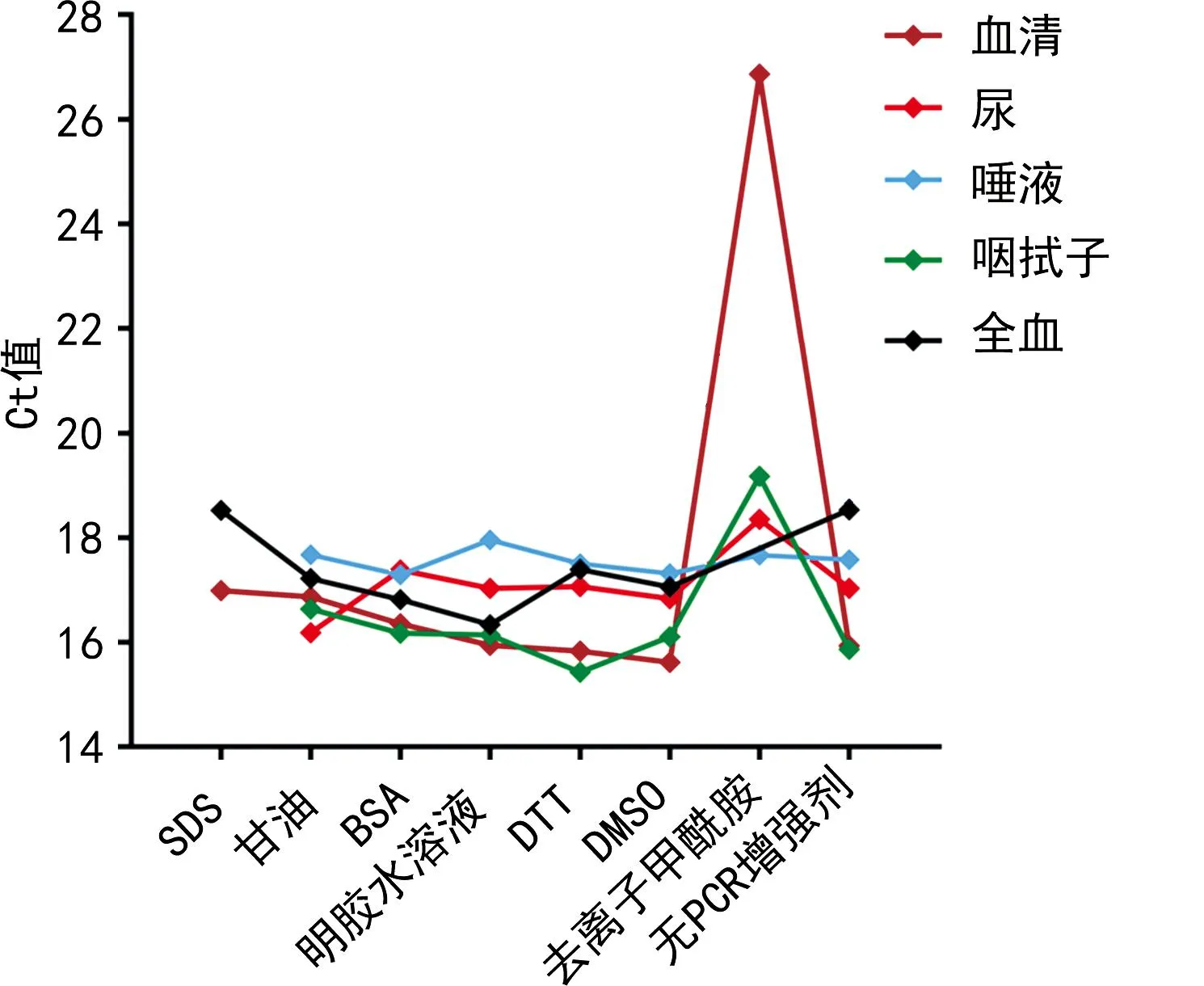
图2 7种PCR增强剂对基于直扩RT-PCR技术的寨卡病毒快速检测方法检测5种样本的扩增Ct值影响
2.1.3反应程序的优化 在一系列梯度逆转录温度下,基于直扩RT-PCR技术的寨卡病毒快速检测方法检测各样本的扩增曲线和扩增产物电泳结果见图3。从扩增曲线看出,不同逆转录温度对血清、尿和咽拭子的Ct值影响不明显(最大Ct值与最小Ct值相差<0.5),但是对唾液的Ct值有着明显的影响;从图3得知,在逆转录温度为46.2、48.9、52.7、57.6、61.6、63.8 ℃下的Ct值分别是16.95、16.56、16.55、17.13、18.17和18.62,由此可知,在逆转录温度46.2~52.7 ℃,Ct值变化较小,平均为16.69,从FAM荧光信号强度变化曲线可看出,在逆转录温度46.2~52.7 ℃,FAM荧光强度较高,平均为2 675.2,而在逆转录温度57.6~63.8 ℃,FAM荧光强度较低,平均为1 235.2,故逆转录温度选取46.2~52.7 ℃的任何温度达到的扩增效果相似。
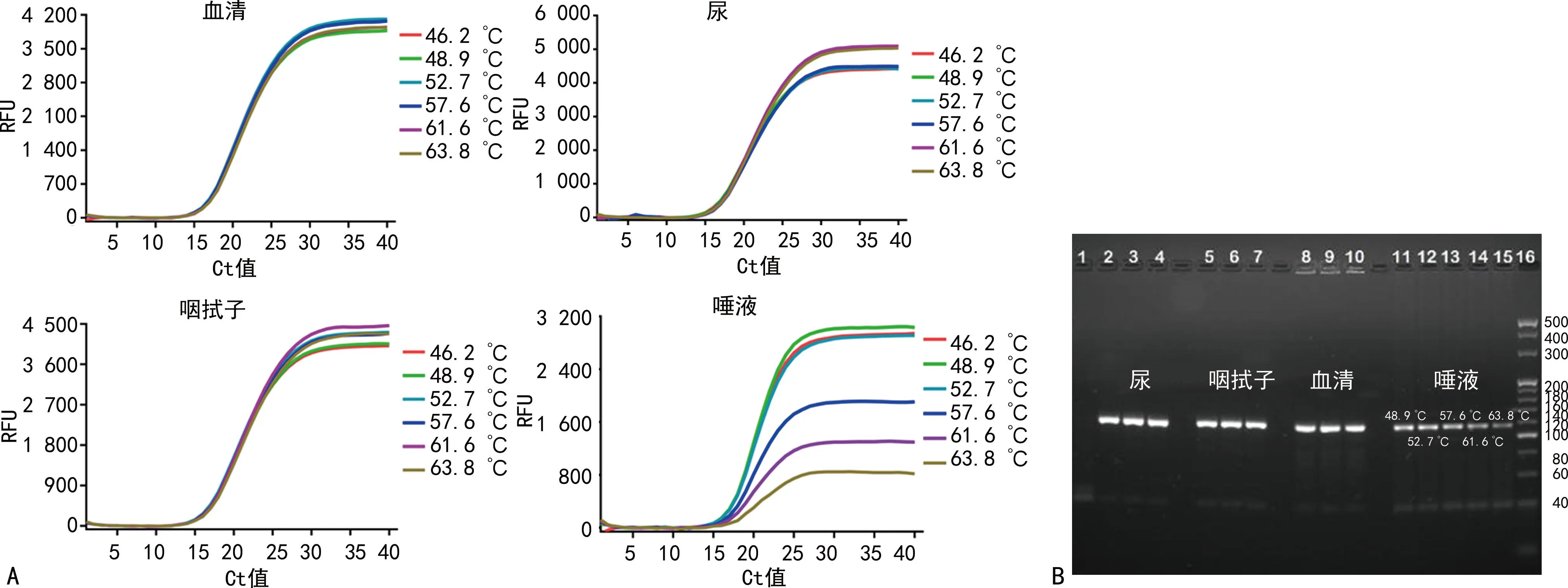
注:A为不同逆转录温度下各样本的扩增曲线;B为扩增产物电泳结果。泳道1为NTC,泳道2~4和泳道5~7分别为尿和咽拭子在逆转录温度为48.9、52.7和57.6 ℃条件下的产物电泳条带;泳道8~10为血清在逆转录温度为48.9、52.7 和57.6 ℃条件下的产物电泳条带;泳道11~15为唾液在逆转录温度为48.9、52.7、57.6、61.6和63.8 ℃条件下的产物电泳条带;泳道16为DNA标准带。
在一系列梯度退火温度下采用直扩RT-PCR技术的寨卡病毒快速检测方法检测不同样本扩增曲线和扩增产物电泳结果见图4,由扩增曲线结果发现,退火温度对扩增唾液、血清、咽拭子和尿的Ct值影响作用相似;从图4可知,在退火温度从67.0 ℃降至51.3 ℃的扩增Ct值和FAM荧光强度变化不显著,但是从电泳结果发现,在较高退火温度下,产生了较多的非特异性扩增产物,因此,在从67.0 ℃降至51.3 ℃尽量选择较低退火温度,故选择51.0 ℃。

注:A为不同退火温度下各样本的扩增曲线;B为扩增产物电泳结果。泳道1、19为DNA标准带;泳道2为NTC;泳道3~6和泳道7~10分别为尿和咽拭子在退火温度为69.3、67.0、62.9和58.0 ℃条件下的产物电泳条带;泳道11~14和泳道15~18分别为血清和唾液在退火温度为69.3、67.0、62.9和58.0 ℃条件下的产物电泳条带。
2.2直扩RT-PCR技术的效果验证
2.2.1检测限实验 5种样本的10倍梯度稀释浓度的扩增曲线,咽拭子、血清、尿R2分别为0.999、0.994和0.998;扩增效率分别为102.15%、90.32%、96.02%,均在90%~110%;最低能检测到的假病毒病毒滴度分别为血清103PFU/mL、尿、咽拭子和唾液102PFU/mL、全血104PFU/mL。见图5。
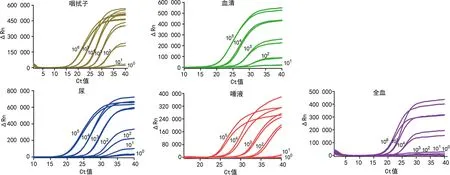
图5 直扩RT-PCR技术检测5种样本的灵敏度实验扩增曲线
2.2.2特异性实验 5种非寨卡病毒和5种细菌质粒的扩增结果见图6,除了寨卡病毒 RNA有特异性扩增曲线,其他均未扩增。说明该方法与其他几种病毒和细菌无交叉反应。
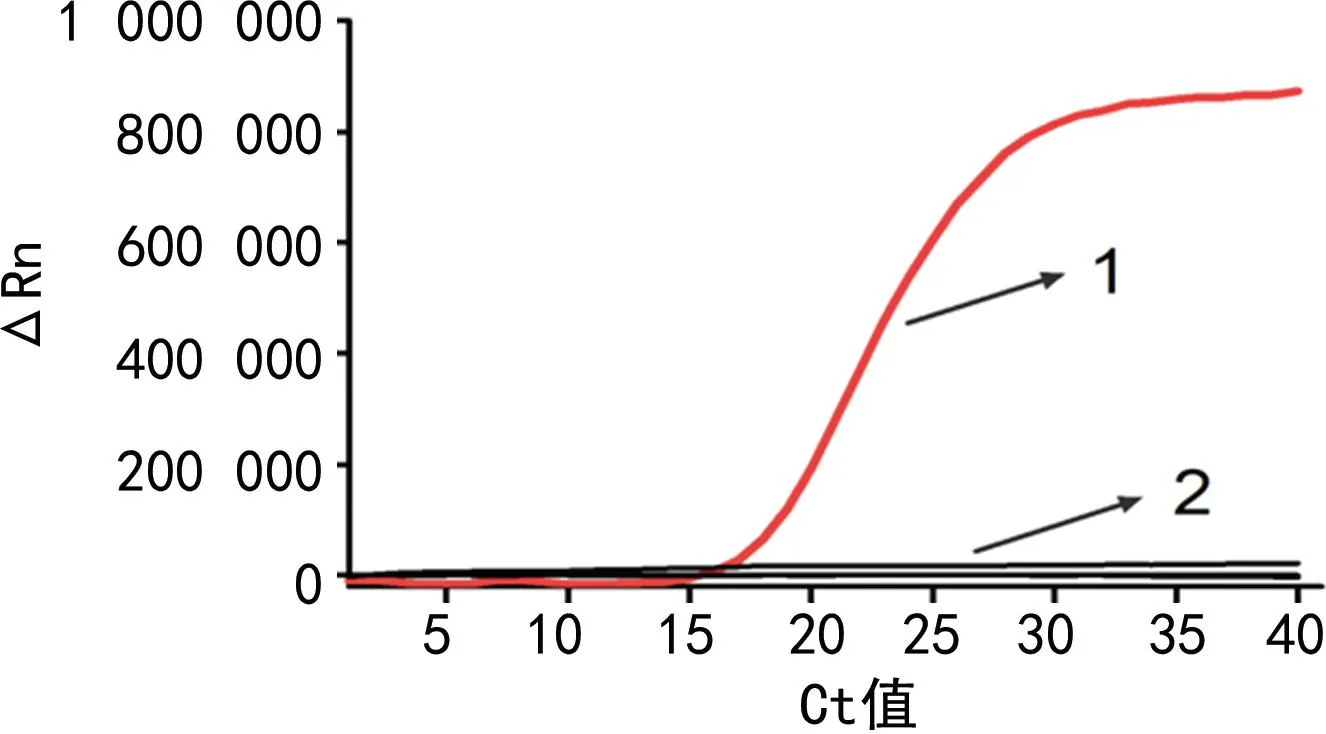
注:1为寨卡病毒 RNA;2为其他病毒和细菌质粒。
2.2.3重复性实验 基于直扩RT-PCR的寨卡病毒快速检测尿、全血和唾液样本的重复性实验的扩增曲线及重复性参数分别见图7、表2。3种样本的2个浓度重复6次的Ct值的变异系数百分比分别为1.33%和1.54%;1.03%和1.80%;1.07%和1.63%,均<5%。说明本研究建立的基于直扩RT-PCR的寨卡病毒快速检测方法的重复性较好,可以保证不同样本检测结果的可靠性。
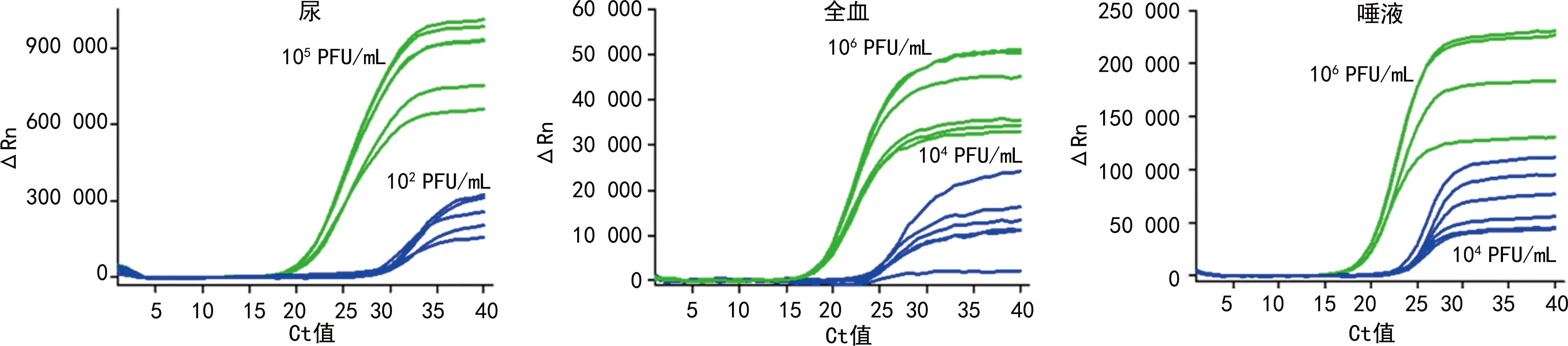
图7 基于直扩RT-PCR的寨卡病毒快速检测方法检测3个样本的重复性实验的扩增曲线
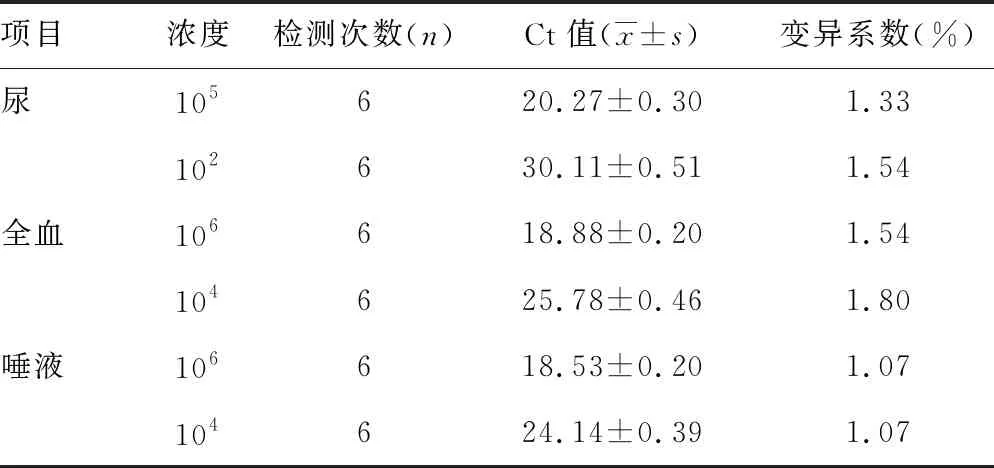
表2 基于直扩RT-PCR技术的寨卡病毒快速检测方法的重复性实验
2.2.4方法的临床应用 用本研究建立的直扩RT-PCR技术和常规RT-PCR技术对8个寨卡病毒样本进行检测,结果两种方法的检测结果一致(均只检测到2个血清样本)。同时利用直扩RT-PCR技术检测非寨卡病毒感染的样本,结果表明在对8个CHIKV样本、54个DENV样本及12个阴性样本检测时,均没有发生扩增反应。见图8、9。
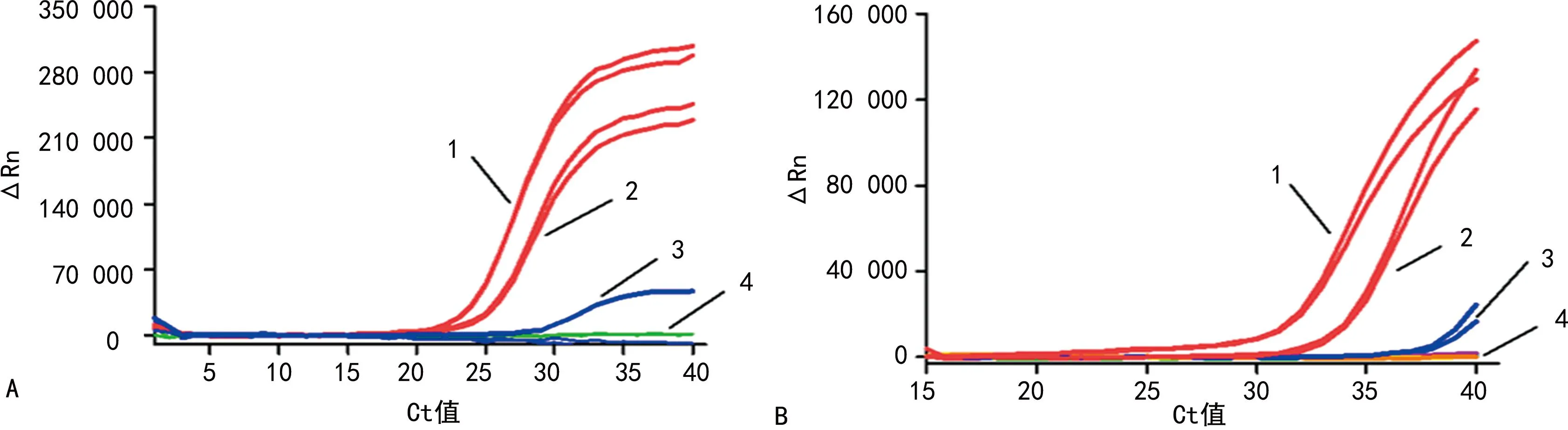
注:A为本研究建立的直扩RT-PCR技术检测各样本,B为常规RT-PCR技术检测各样本;1为患者1血清、2为患者2血清、3为患者3咽拭子、4为其余5个样本。
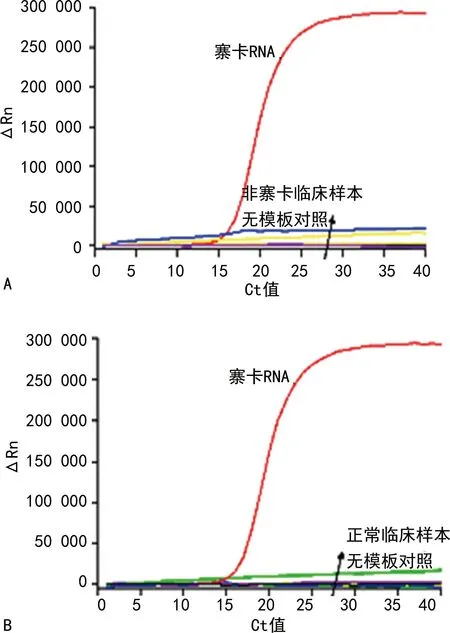
注:A表示检测非寨卡病毒样本的结果,B表示检测正常临床样本的结果。
3 讨 论
针对临床上诊断生物材料而言,目前研究最多的是全血样本。普遍认为全血中主要存在3种抑制物,即是红细胞内的血红蛋白和白细胞内的乳铁蛋白及血浆中的免疫球蛋白G[12-15]。尿也是临床上常用的检测样本,而且尿作为一种非侵入性样本具有一定的检测优势。尿中主要存在的抑制物是尿素[16]。尿素的抑制作用与其浓度有关,浓度达到50 mmol/L时会产生完全抑制作用[17]。目前作用机制尚不清楚,但是大多数研究者认为尿素直接作用于聚合酶而导致聚合酶降解或阻碍引物退火而产生抑制作用。唾液中主要的抑制物可能是其所含的少量的蛋白或者其他物质,目前尚且不清楚[18]。
本研究结果发现,全血的直接扩增技术最难,其他4种样本扩增较易且难度差不多。在只使用特殊DNA聚合酶时,5种样本均被成功扩增,但是相比于其他4种样本,全血样本扩增的相对荧光强度较低,极大低于其他4种样本的荧光强度。分析原因:考虑全血中存在严重影响其荧光收集的物质,对比全血样本与其他样本所含成分的差别,全血中含有独特的细胞(红细胞、白细胞)、血小板及一些蛋白,高温会使细胞破裂,从而释放出里面的血红蛋白等成分,但是具体是哪种成分对荧光强度的吸收造成了影响,本研究中未来得及进一步研究;其次考虑血液中所含抑制成分多且浓度高,抑制作用因而较强,针对此原因,采用样本稀释的方法来提高扩增的荧光强度。结果表明随着稀释倍数的增加,荧光强度明显逐渐增强,由此证明样本的浓度确实会影响荧光强度的吸收。
聚合酶区是催化合成核酸的关键区域,该区域由手指区、掌心区和拇指区构成[19]。样本直扩RT-PCR技术的可行性,在一定程度上取决于聚合酶的耐受特性。本研究结果显示,用普通DNA聚合酶进行样本直接RT-PCR扩增,其活性被完全抑制,然而,在未加任何PCR增强剂的情况下,使用耐抑制作用的DNA聚合酶能成功对未经过任何处理过的样本进行一定程度的扩增。相比通过调节缓冲液成分来达到直扩目的,改用特殊的聚合酶,因不需要对反应体系进行过多优化而简单易行,并且产生的增强效果也更加明显,所以通过直接使用特殊的聚合酶来进行样本的直接扩增更加具有优势。
目前主要通过定点诱导突变、酶嵌合或酶组合等方式对酶进行改造来获得高耐受的聚合酶。在本研究中优化的4种具有耐受特性的DNA聚合酶,其中Omni Taq和Alpha Taq均属于聚合酶突变体,是Taq或Klentaq1聚合酶的三重突变,其中OmniTaq能在20%~25%全血存在下仍然保持一定活性,而Alpha Taq虽然具有耐受特性,但研究结果发现,不能耐受全血的抑制作用。Tth DNA聚合酶来源于Thermus thermophilus HB8的耐热性DNA多聚酶,经大肠杆菌表达生成的重组型酶。TTX DNA聚合酶是一种比Taq DNA聚合酶更能对抗抑制剂影响的重组突变酶,与Tth相同,也具有逆转录活性,所以无论是DNA还是RNA,都可以高效率地进行扩增,但这两种酶的耐受能力均低于Omni Taq和Alpha Taq,且均不耐受全血的抑制,推测原因可能是本身酶的耐受能力低,或者是该酶作为逆转酶时被样本抑制,导致逆转录活性不高,从而导致后续的PCR扩增受到影响。
本研究结果发现,不同PCR增强剂对不同样本产生的效果不同,如加入SDS不仅没有增强作用,反而抑制了对血清、唾液和咽拭子的扩增,已知SDS是一种非常高效的离子型表面活性剂,几乎能溶解所有的蛋白质,因此在破坏病毒外壳促进核酸释放的同时,可能也破坏了聚合酶的结构,从而使聚合酶失去活性。加入去离子甲酰胺,除了对唾液的扩增没有明显的影响外,对其余样本的扩增均产生了明显的抑制作用。除了SDS和去离子甲酰胺对不同样本产生了明显的不同效果外,其余5种PCR增强剂对样本的扩增无明显影响作用,这也表明,不是所有的PCR增强剂都能促进PCR扩增,加入的PCR增强剂会与现有体系中的反应成分进行相互作用,而产生抑制作用。
本研究建立的直扩RT-PCR技术的寨卡病毒快速检测方法,可以直接从全血、血清、尿、唾液和咽拭子中检测出寨卡病毒,该方法简便快捷,灵敏度高,特异度强,为监测虫媒病毒疫情及国内各出入境与口岸机关对病毒的检验检疫提供了一种非常方便简便快速的技术手段。
